
Железо как химический элемент в химии - формулы и определение с примерами
Содержание:
Фуррум это один из важнейших металлических элементов. Его простое вещество — металл железо — человек использует уже несколько тысячелетий. Без железа и его сплавов нельзя представить современную жизнь. Соединения Феррума играют особую роль в живой природе.
Атом Феррума может потерять 2 электрона и превратиться в ион 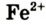
Железо
Феррум образует простое вещество — железо. Из этого металла изготавливали орудия труда и оружие за тысячи лет до нашей эры. Тогда человек использовал метеоритное железо, а позднее научился получать металл из руды.
Распространенность феррума в природе
По распространенности в земной коре Феррум разделяет с Кальцием б—7-е места (в каждой тысяче атомов содержится по 18 атомов этих элементов).
Известно много природных соединений Феррума. Соединения Феррума с Оксигеном — красный, магнитный и бурый железняки — являются сырьем для получения железа; это железные руды. Свыше 14 % их разведанных запасов находится в Украине. Криворожское месторождение — одно из крупнейших в мире.
Кроме соединений Феррума, в природе иногда встречается метеоритное железо.
Небольшое количество Феррума содержится в природной воде (в виде ионов 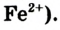 При ее кипячении на стенках сосуда образуется накипь, которая имеет желтоватый оттенок из-за примеси соединений Феррума.
При ее кипячении на стенках сосуда образуется накипь, которая имеет желтоватый оттенок из-за примеси соединений Феррума.
По утверждениям ученых, железо вместе с никелем образуют ядро нашей планеты.
В живых существах Феррума очень мало. Ионы 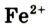 входят в состав гемоглобина крови. Это соединение «переносит» кислород от легких к живым тканям, а часть углекислого газа — от тканей к легким. Благодаря наличию Феррума гемоглобин, а следовательно, и кровь, имеют красный цвет. Недостаточное количество этого элемента в организме служит причиной малокровия. Поэтому рекомендуют чаще употреблять в пищу богатые на Феррум гречку, яблоки, свеклу, зеленые овощи.
входят в состав гемоглобина крови. Это соединение «переносит» кислород от легких к живым тканям, а часть углекислого газа — от тканей к легким. Благодаря наличию Феррума гемоглобин, а следовательно, и кровь, имеют красный цвет. Недостаточное количество этого элемента в организме служит причиной малокровия. Поэтому рекомендуют чаще употреблять в пищу богатые на Феррум гречку, яблоки, свеклу, зеленые овощи.
В организме взрослого человека содержится 3-5 г Феррума.
Физические свойства железа
Железо — серовато-серебристый пластичный металл, который плавится при температуре 1539 °С, притягивается магнитом. Образует много сплавов с различными металлами.
Химические свойства железа
Железо проявляет в химических реакциях достаточную активность, но она меняется в зависимости от размера частиц и наличия примесей. Так, в очень измельченном состоянии этот металл самовозгорается на воздухе. Довольно чистое железо (например, метеоритное) не ржавеет.
В отличие от кислорода, который реагирует почти со всеми простыми веществами, железо взаимодействует только с неметаллами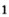 .
.
Реакции с неметаллами
При сильном нагревании на воздухе железо раскаляется и медленно окисляется, а в чистом кислороде горит. Очень эффектным является опыт по сжиганию лезвия или стальной пружинки (рис. 67). На пружинке закрепляют спичку (напротив ее головки) и зажимают ее в лабораторых щипцах. Спичку, опущенную головкой вниз, поджигают. Когда пламя достигнет пружинки, ее сразу переносят в стакан с кислородом. Дно сосуда заранее засыпают слоем песка, чтобы на стекло не попали капли расплавленного металла. Пружинка сгорает в кислороде, разбрасывая искры во все стороны (это напоминает сварку металла):
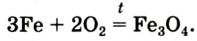

Рис. 67. Горение стальной пружинки в кислороде
Формулу продукта реакции можно записать и так: 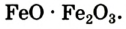 Эта запись свидетельствует о том, что вещество является соединением двух оксидов Феррума, а не их смесью. Химическое название соединения — феррум
Эта запись свидетельствует о том, что вещество является соединением двух оксидов Феррума, а не их смесью. Химическое название соединения — феррум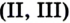 оксид, а тривиальное —железная окалина.
оксид, а тривиальное —железная окалина.
 Реакции между металлами не происходят.
Реакции между металлами не происходят.
Железо сгорает и в газе хлоре (рис. 68):
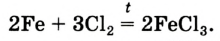 феррум
феррум  хлорид
хлорид
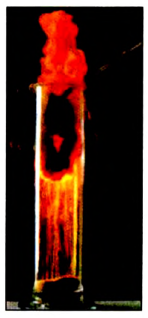 Рис. 68. Горение железа в хлоре
Рис. 68. Горение железа в хлоре
Если нагреть смесь порошков железа и серы, то при определенной температуре начинается реакция, которая происходит с выделением значительного количества теплоты. Продуктом реакции является соединение Феррума
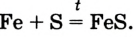 феррум
феррум 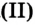 сульфид
сульфид
Реакция с водой. Железо при высокой температуре может взаимодействовать с водой (раскаленный металл реагирует с водяным паром):
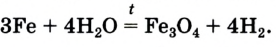
Раньше с помощью этой реакции получали в промышленности водород.
Ржавление (коррозия) железа
С водой железо реагирует и в обычных условиях, но очень медленно и с участием кислорода. В результате на поверхности металла образуется коричневый или желто-бурый налет — ржавчина. Разрушение железа под действием воды и кислорода называют ржавлением, или коррозией.
Использовав для ржавчины формулу 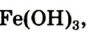 запишем уравнение реакции:
запишем уравнение реакции:
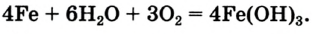
Ежегодно из-за коррозии теряется примерно 1/5 всего произведенного металла (рис. 69, а). Для предотвращения разрушения железа его смазывают специальными


Рис. 69.Коррозия железа: а — бочка, которую «съела» ржавчина; б — ржавая проволока, на которой закреплена оцинкованная железная сетка
смазочными маслами, покрывают красками, лаками, керамическими эмалями, слоем другого металла, устойчивого к коррозии, — никеля, хрома, цинка (рис. 69, б).
Полностью исключает коррозию замена железа нержавеющей сталью — сплавом железа с хромом и никелем.
Применение железа
Наверное, нет такой отрасли производства или потребления, где бы не использовались чугун и сталь — важнейшие сплавы на основе железа. Из чугуна отливают металлические изделия различного назначения, а из стали изготовляют арматуру, рельсы, трубы, инструменты, транспорт, оружие, военную технику, железа промышленное оборудование и т. п. (схема 10).
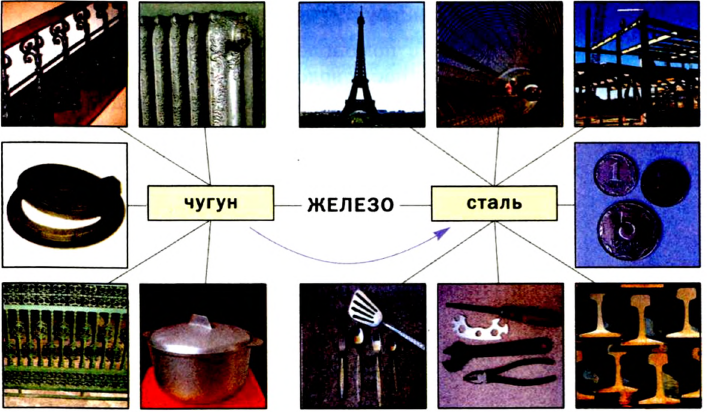
Схема 10.Применение железа
Выводы:
- Феррум — металлический элемент; его простое вещество — металл железо. Кроме атомов Феррума, существуют ионы
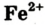 + и
+ и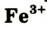 , которые входят в состав соединений Феррума
, которые входят в состав соединений Феррума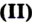 и Феррума
и Феррума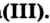 Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами.
Феррум широко распространен в литосфере. Природные соединения этого элемента с Оксигеном являются железными рудами. - Железо — тугоплавкий металл, который притягивается магнитом, вступает в реакции с активными неметаллами, реагирует с водой, в частности при наличии кислорода.
- Химическое превращение железа при участии кислорода и воды называют ржавлением, или коррозией.
- Для предотвращения коррозии изделия из железа покрывают красками, лаками, смазочными маслами или слоем другого металла. Часто вместо железа используют нержавеющую сталь — сплав железа с хромом и никелем.
- Сплавы на основе железа, прежде всего чугун и сталь, широко используют в промышленности, технике, других отраслях.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |