
Типы химических реакций в химии - присоединения, разложения, обмена и замещения с примерами
Содержание:
Типы химических реакций: присоединения, разложения, обмена и замещения:
Химические реакции подразделяются на несколько типов в зависимости от вступающих в реакцию исходных веществ (реагентов), количества образующихся продуктов реакции и выделения или поглощения энергии.
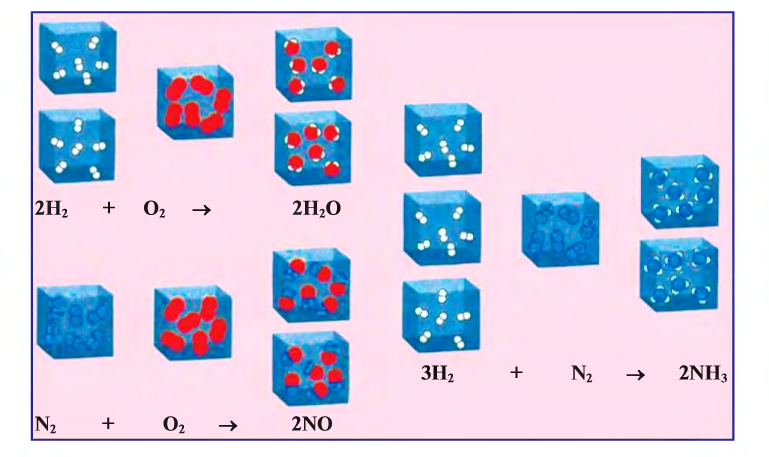
Рис. 17. Образование различных веществ (реакции присоединения)
По количеству образующихся и вступающих в реакцию компонентов их можно разделить на следующие типы:
Реакции присоединения
1. В реакциях присоединения (рис. 17) из одного или нескольких исходных веществ получается одно новое вещество: А + В + ... = С:
Реакции разложения
2. В реакциях разложения из одного вещества образуется несколько новых веществ: С = А + В ...:
Реакции замещения
3. В реакциях замещения простое вещество, вступая в реакцию со сложным веществом, занимает место в составе сложного вещества, в результате образуются новое простое и сложное вещества: АВ + С = АС + В:
Реакции обмена
4. В реакциях обмена составные части сложных веществ взаимообмениваются: АВ + CD = AD + ВС:
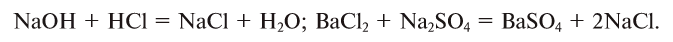
В процессе протекания химических реакций может выделяться или поглощаться тепло.
Энергия, выделяющаяся в процессе химической реакции, называется химической энергией.
Химическая энергия может быть превращена в тепловую, световую, механическую и электрическую энергию.
В большинстве случаев химическая энергия превращается в тепловую энергию и наоборот.

Рис. 18. Экзотермические реакции
Количество выделяемой или поглощаемой во время химической реакции энергии называется тепловым эффектом (Q).
Тепловой эффект наблюдается в результате разрыва или возникновения химической связи и количественно выражается в килоджоулях (кДж).
Реакции, сопровождающиеся выделением тепла (энергии), называются экзотермическими (ekzo — наружу) (см. рис. 18). В этих реакциях тепловой эффект изображается знаком «+» (плюс).
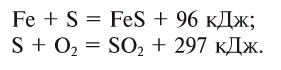
Реакции, сопровождающиеся поглощением тепла (энергии), называются эндотермическими (endo — внутрь). В таких реакциях тепловой эффект обозначается знаком «—» (минус):
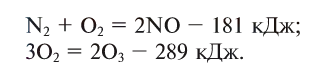
Расчет относительной молекулярной массы и количества вещества
Для определения относительной молекулярной массы вещества 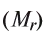 необходимо сложить величины относительных атомных масс, входящих в состав молекулы элементов.
необходимо сложить величины относительных атомных масс, входящих в состав молекулы элементов.
Например, 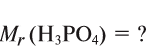
Зная относительную атомную массу водорода, фосфора и кислорода, вычисляем относительную молекулярную массу 
1. Определите относительную молекулярную массу следующих веществ:

Расчет массовой доли элементов в сложных веществах
Массовые доли (содержание) элементов в составе вещества выражаются в процентах (%).
Найдем процент содержания (со) углерода и кислорода в углекислом газе
Расчет:
1. Вычисляем относительную молекулярную массу 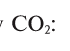
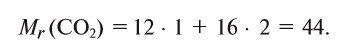
2. Находим массовую долю кислорода в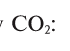
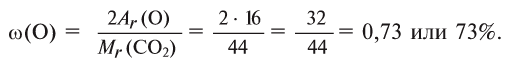
3. Находим массовую долю углерода в 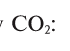
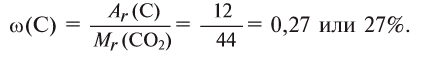
О т в е т: 73% О и 27% С.
1. Определите массовые доли элементов, входящих в состав следующих веществ:
2. Каковы массовые доли (%) S и О в составе оксида серы (IV)?
3. На предприятии «Ферганаазог» производится минеральное удобрение 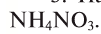 . Сколько процентов азота в этом удобрении?
. Сколько процентов азота в этом удобрении?
4. В каком из этих удобрений процентная доля азота наибольшая: 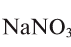 ,
, 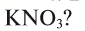
Определение формулы вещества по количественным отношениям входящих в его состав элементов
1. Определите формулу соединения, в состав которого входит 50% серы и 50% кислорода.
Вычисление:
Из условия задания известно, что вещество содержит атомы серы (S) и кислорода (О). Следовательно, формулу вещества можно изобразить как 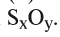 . Для установления соотношения атомов в молекуле вещества и расчета значений х и у необходимо процент содержания каждого элемента разделить на относительную атомную массу входящих в состав вещества атомов:
. Для установления соотношения атомов в молекуле вещества и расчета значений х и у необходимо процент содержания каждого элемента разделить на относительную атомную массу входящих в состав вещества атомов:
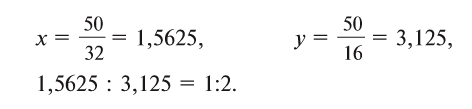
Отсюда формула вещества - 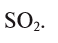
2. Определите формулу соединения, содержащего 2,4% Н, 39,1% S и 58,5% О.
Расчет:
Известно, что в состав вещества входят атомы Н, S и О. Искомая формула вещества будет иметь вид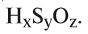 . Для нахождения х, у, z необходимо процент содержания элементов разделить на их атомные массы и найти их численные соотношения:
. Для нахождения х, у, z необходимо процент содержания элементов разделить на их атомные массы и найти их численные соотношения:
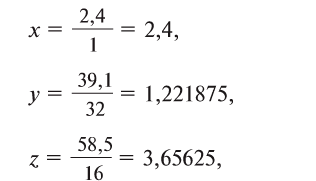
Из этого следует, что формула вещества — 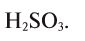
Вычисление эквивалента простых и сложных веществ
Определение эквивалента простых веществ и элементов.
Эквивалент химического элемента (£) — отношение атомной массы 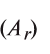 и валентности элемента (V), которое вычисляется по формуле:
и валентности элемента (V), которое вычисляется по формуле:
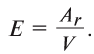
Пользуясь этой формулой, можно легко вычислить эквивалент элемента. Например, Аг алюминия — 27, а его валентность V — 3. Подставляя эти значения в формулу, находим его эквивалент:
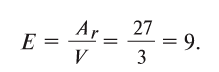
Если элемент обладает переменной валентностью, то меняется и его эквивалент. Например, медь может иметь валентность 1 и 2, при этом в первом случае ее эквивалент будет равен 64, а во втором — 32.
Определение эквивалента оксидов
Чтобы определить эквивалент оксида, необходимо его относительную молекулярную массу 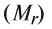 разделить на произведение валентности (V) на число элемента (n), образующего оксид:
разделить на произведение валентности (V) на число элемента (n), образующего оксид:
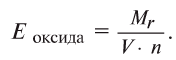
Например, эквивалент оксида меди (СиО) будет равен:
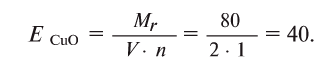
Определение эквивалента оснований
Для определения эквивалента оснований следует относительную молекулярную массу вещества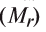 разделить на число (n) гидроксильных групп, имеющихся в составе основания:
разделить на число (n) гидроксильных групп, имеющихся в составе основания:
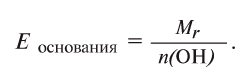
Например, эквивалент гидроксида меди 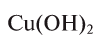 2 будет равен:
2 будет равен:
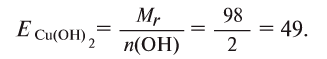
Определение эквивалента кислот
Для определения эквивалента кислот нужно относительную молекулярную массу вещества 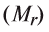 разделить на число (n) водородных атомов, входящих в состав кислоты:
разделить на число (n) водородных атомов, входящих в состав кислоты:
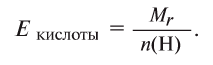
Например, эквивалент 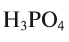 определяется так:
определяется так:
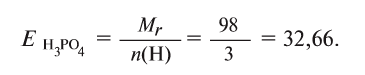
32’66'
Определение эквивалента солей
Для определения эквивалента солей следует относительную молекулярную массу вещества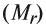 разделить на произведение валентности (V) металла на число атомов металла, входящего в состав соли (n):
разделить на произведение валентности (V) металла на число атомов металла, входящего в состав соли (n):
Например, эквивалент хлорида меди (II)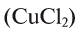 определяется так:
определяется так:
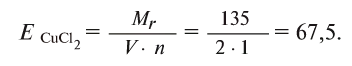
Решение задач на закон эквивалентов
Под эквивалентностью вещества понимают количество участвующего в определенной реакции вещества с 1 г водорода 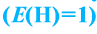 или с 8 г кислорода
или с 8 г кислорода
Вещества вступают в реакции пропорционально их эквивалентам.
При вступлении в реакцию вещества A и вещества В математическое выражение их эквивалентной закономерности будет следующим:
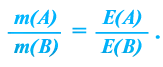
1. В составе оксида алюминия имеется 52,94% алюминия и 47,06% кислорода. Найдите эквивалент алюминия, если известно, что эквивалент кислорода равен 8.
Решение:
Из условия задачи известно массовое соотношение А1 и О: 52,94 : 47,06
В соответствии с формулой 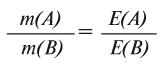
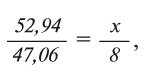 отсюда х=9
отсюда х=9
Следовательно, эквивалент алюминия А1 равен 9.
Расчеты по уравнениям химических реакций и закону сохранения массы
Массы всех веществ, участвующих в химических реакциях, находятся в постоянных пропорциональных соотношениях. Например:
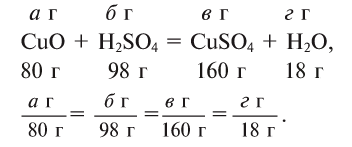
Если известно количество хотя бы одного вступающего в реакцию вещества, то можно рассчитать количество других участвующих в реакции веществ.
Пример:
Сколько граммов 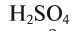 вступят в реакцию с 4 г CuO и сколько при этом образуется соли и воды?
вступят в реакцию с 4 г CuO и сколько при этом образуется соли и воды?
Решение:
Напишем уравнение реакции:
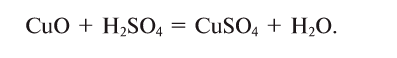
Под формулами участвующих в реакции веществ запишем значения их молярных масс. Над уравнением запишем приведенные в условиях задачи значения масс веществ и те, которые необходимо найти:
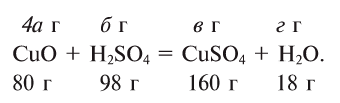
Теперь находим, сколько серной кислоты нужно для реакции. Для этого составляем пропорцию и решаем ее:
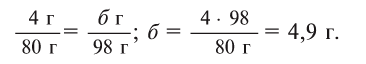
Далее рассчитываем, сколько образуется сернокислой меди (II):
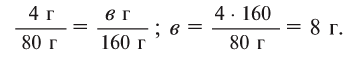
Теперь находим количество образовавшейся воды:
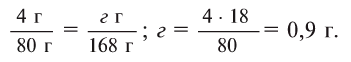
Ответ: 4,9 г серной кислоты, 8 г сульфата меди и 0,9 г воды.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |