
Тепловые явления в физике - виды, формулы и определения с примерами
Содержание:
Тепловые явления:
В жизни мы часто наблюдаем явления и процессы, которые происходят благодаря передаче теплоты и связаны с обменом тепловой энергией. Они протекают по-разному: при непосредственном контакте тел с различной температурой, благодаря теплообмену между телами, в результате сгорания топлива и т. д. На основе многовекового опыта познания окружающего мира человечество осознало закономерности протекания тепловых явлений и процессов, обобщив их в виде понятий, законов, теорий теплоты.
Сильно нагретый предмет, опущенный в холодную воду, со временем охлаждается, а вода нагревается; лед, принесенный с улицы в теплую комнату, тает; солнечные лучи нагревают поверхность Земли, благодаря чему земная жизнь продолжается, и т. д.
Для определения теплового состояния тел человек сначала использовал свои ощущения, применяя такие слова, как холодное, теплое, горячее. Например, мы говорим: холодный лед, горячий песок, теплая вода и т. д. Однако оценить его таким образом можно лишь приблизительно и не всегда однозначно. В подтверждение этого выполним такой опыт.
Погрузим на некоторое время одну руку в горячую воду, а другую - в холодную (рис. 134, а). Затем обе руки поместим в воду при комнатной температуре (рис. 134, б) и попытаемся на основании своих ощущений установить, какая в сосуде вода - холодная или горячая? На удивление, мы не сможем этого сделать однозначно, поскольку наши ощущения будут разными: рука, которая находилась в горячей воде, будет чувствовать холод, а рука, находившаяся в холодной воде, будет ощущать тепло. Возникло противоречие. Ведь на самом деле температура воды в сосуде одинаковая.

Следовательно, мы убедились, что человек не всегда может однозначно определить тепловое состояние тел на основании своих ощущений. Для этого ему надо найти количественную меру - физическую величину, на основании которой можно объективно оценить, какое из тел и на сколько теплее или холоднее другого. Поэтому для характеристики теплового состояния тел используют понятие температуры.
В природе тепловые процессы протекают согласно законам, связанным с теплообменом. Установлено, что тела, имеющие более высокую температуру, отдают теплоту менее нагретым, при этом остывая; менее нагретые тела получают теплоту и их температура при этом повышается. При таком теплообмене температуры тел со временем выравниваются. В обычных условиях теплота не может самопроизвольно перейти от менее нагретых тел к телам, температура которых выше.
Действительно, наш жизненный опыт подтверждает этот вывод. Когда мы кладем в холодильник пакет молока, его температура понижается и сравнивается с температурой холодильной камеры. Вместе с тем в результате теплообмена температура внутри холодильника немного повышается, и поэтому он включается для того, чтобы привести ее к норме.
Таким образом, протекание тепловых процессов при теплообмене всегда происходит в направлении выравнивания температур. Со временем между телами устанавливается тепловое равновесие и их температуры становятся одинаковыми. Между телами, имеющими одинаковые температуры, теплообмен не происходит.
Температура тела определяет его тепловое состояние: чем она выше, тем больше степень «нагретости» тела.
Температура тел и измерение температуры тела
Тепловое состояние тела характеризуется его температурой. Чтобы ее определить, необходимо установить способ измерения данной физической величины и найти измеритель, с помощью которого она может быть определена количественно. По разным причинам мы не можем это сделать таким же образом, как при измерении длины или массы тела, т. е. сравнить свойство с эталоном. Поэтому температуру тел измеряют другим способом.
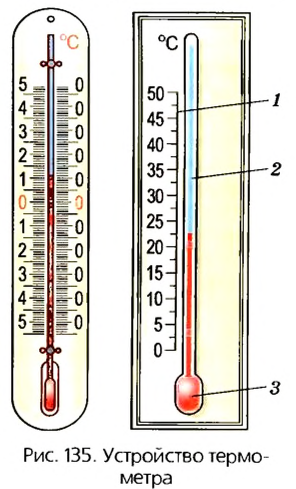
В 1742 г. шведский ученый А. Цельсий предложил измерять температуру на основе свойства тела расширяться при его нагревании. Он изобрел прибор, названный термометром, который состоял из маленькой колбочки-резервуара 3, заполненной жидкостью (спиртом или ртутью), тонкой капиллярной трубочки 2 и шкалы 1 (рис. 135). Цельсий предложил температурную шкалу, в которой «О» соответствовал температуре плавления льда, а температуру кипения воды обозначил «100»1.
1 В действительности он построил обратную шкалу, ноль которой соответствовал температуре кипения воды, а 100 температуре плавления льда. Однако со временем для удобства эти точки поменяли местами.
Принцип действия такого жидкостного термометра основывается на том, что благодаря контакту колбочки с телом, температуру которого следует измерить, между ними устанавливается тепловое равновесие, и температура колбочки становится равной температуре тела. Жидкость в колбочке вследствие изменения температуры будет либо расширяться (при нагревании), либо уменьшать свой объем (при охлаждении). Поскольку изменение объема незначительно, чтобы его можно было зафиксировать, к колбочке присоединяют тонкую трубочку-капилляр. Благодаря ей можно визуально наблюдать даже незначительные изменения объема жидкости в колбочке, поскольку диаметр трубочки очень маленький.
Для того чтобы количественно определить температуру тела, необходимо установить размер единицы температуры и проградуировать температурную шкалу. Продемонстрируем это на опыте, который отражает ход рассуждений А. Цельсия в построении температурной шкалы, названной в его честь.
Сначала поместим термометр в сосуд с тающим льдом (рис. 136, а). Затем, через некоторое время, после установления теплового равновесия обозначим уровень жидкости в капиллярной трубочке меткой «0». После этого перенесем термометр в сосуд с кипящей водой (рис. 136, б). В результате нагревания жидкость в колбочке увеличит свой объем, уровень в капиллярной трубочке поднимется и остановится в точке, которую обозначим «100». Таким образом, мы зафиксировали значения, которые соответствуют температурам таяния льда и кипения воды. Очевидно, что при определенных условиях (нормальном атмосферном давлении, равном 760 мм рт. ст. или 101 293 Па) эти значения температуры легко воспроизвести, поскольку они постоянны.
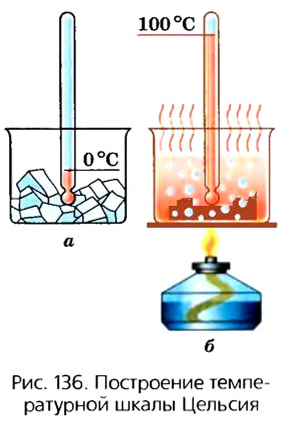
Если теперь разделить интервал между этими метками на 100 равных частей, то получим температурную шкалу, предложенную А. Цельсием. Единица температуры на этой шкале называется градусом Цельсия (обозначается °С).
Температуры таяния льда и кипения воды называют реперны-ми точками шкалы Цельсия.
В быту мы, как правило, пользуемся температурной шкалой Цельсия, поскольку она удобна для измерения температур в пределах значений, привычных для жизнедеятельности человека (погодные условия, температура человеческого тела и т. п.). Вместе с тем в физике чаще применяют абсолютную шкалу температур, которую предложил английский ученый В. Томсон, лорд Кельвин. Ноль этой шкалы соответствует такому тепловому состоянию тела, при котором прекращается тепловое движение атомов и молекул. Установлено, что это происходит при температуре -273,15 °С. Эту температуру называют абсолютным нулем температуры.
Международной системой единиц в качестве основной единицы температуры принята единица абсолютной шкалы «кельвин» (обозначается К). По размеру кельвин равен градусу Цельсия: 1 К = 1°С. Перевод температуры из одной шкалы в другую производится по формуле: 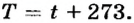 Например, комнатная температура 20 °С в абсолютной шкале температур будет равна 293 К. Отметим, что в большинстве измерений применяют признанную мировым сообществом единицу температуры - кельвин. Однако, в случаях, когда температуру определяют по шкале Цельсия, используют обозначение °С.
Например, комнатная температура 20 °С в абсолютной шкале температур будет равна 293 К. Отметим, что в большинстве измерений применяют признанную мировым сообществом единицу температуры - кельвин. Однако, в случаях, когда температуру определяют по шкале Цельсия, используют обозначение °С.
Температуру по абсолютной шкале температур обозначают буквой Т,а по шкале Цельсия - t.
Внутренняя энергия тел и два способа изменения внутренней энергии
До сих пор тепловое состояние тел мы связывали с температурой и не выясняли, какое свойство характеризует эта физическая величина, от чего зависит и что определяет.
Как известно, атомно-молекулярное учение о строении вещества дает нам общее представление о зависимости хаотического движения атомов и молекул от температуры: чем она выше, тем быстрее движутся микрочастицы, из которых состоит тело.
Тепловое движение - это хаотическое (неупорядоченное) р движение атомов, молекул и других микрочастиц, скорость которых зависит от температуры тела.
Следовательно, соотнося скорость движения атомов и молекул с температурой, мы можем констатировать, что это движение характеризует тепловое состояние тела, т. е. хаотическое движение микрочастиц, из которых состоит тело, является, по сути, тепловым движением.
Атомы и молекулы постоянно находятся в движении, поэтому они обладают кинетической энергией. В результате столкновений между собой они имеют разные скорости, поэтому следует учитывать их среднюю кинетическую энергию, которая и определяет температуру тела. Этот вывод, сделанный Дж. Максвеллом в XIX в., положен в основу современной молекулярно-кинетической теории строения вещества.
Наличие внутренней энергии у всех тел обусловлено тепловым движением и взаимодействием атомов и молекул, из которых состоят тела.
Другое предположение, высказанное выдающимся немецким физиком Л. Больцманом о потенциальной энергии взаимодействия атомов и молекул, дополняет предыдущий вывод. Ведь согласно атомно-молекулярному учению микрочастицы взаимодействуют между собой. В газах - это кратковременные столкновения. В жидкостях и твердых телах — продолжительное взаимодействие, благодаря которому атомы и молекулы находятся в относительно устойчивых положениях.
Оба предположения, сделанные Дж. Максвеллом и 158 Л. Больцманом, дают основание утверждать, что каждое тело обладает внутренней энергией, состоящей из кинетической энергии теплового движения атомов и молекул и потенциальной энергии их взаимодействия.
Тепловые явления и процессы протекают таким образом, что, как правило, происходит изменение внутренней энергии или выполнение работы. Например, если нагревать какой-то предмет, то средняя кинетическая энергия его молекул возрастает, поскольку повышается температура тела. Следовательно, возрастает и внутренняя энергия тела.
Нам известно, что изменить температуру тела можно не только в результате передачи теплоты, но и за счет выполнения механической работы. Например, если молотком несколько раз ударить по металлической пластине, то она нагреется. Рассмотрим детальнее способы изменения внутренней энергии тела.
Одним из наиболее распространенных тепловых процессов является передача энергии от одних тел другим в результате теплообмена, когда более нагретые тела отдают теплоту менее нагретым. Этот процесс называется теплопередачей. Количественно его характеризует физическая величина, которая называется количеством теплоты (обозначается Q).
Теплопередача может происходить с поглощением теплоты или ее отдачей.
Как и энергия, количество теплоты измеряется в джоулях (Дж). Для тепловых процессов это довольно маленькая единица. Например, для нагревания 1 г воды на 1 К необходимо затратить 4,19 Дж теплоты. Поэтому используют кратные единицы количества теплоты - килоджоуль (кДж) и мегаджоуль (МДж): 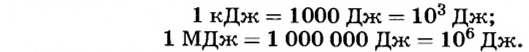
Раньше для измерения количества теплоты применяли единицу, которая называется калорией (от лат. calor - тепло). 1 калория равна количеству теплоты, которое необходимо сообщить 1 г воды для ее нагревания на 1 К. Сейчас эту единицу используют для определения энергетической ценности пищевых продуктов (ее можно найти на упаковках многих продуктов).

При теплопередаче либо происходит повышение или понижение температуры тела, либо изменяется агрегатное состояние вещества (плавление твердых тел, испарение жидкостей и т. д.). Например, вода, помещенная в морозильную камеру холодильника, постепенно охлаждается, отдавая часть своей тепловой энергии камере; через определенное время, когда ее температура достигнет 0 °С, она начнет превращаться в лед. То есть в результате теплообмена вода теряет часть внутренней энергии, поэтому ее температура снижается, а затем изменяется ее агрегатное состояние. Изменение внутренней энергии в результате теплопередачи равно количеству теплоты, полученному телом или отданному им: 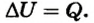
Другой способ изменения внутренней энергии обусловлен выполнением работы. Убедимся в этом на опыте. Нальем в колбу миксера воду и измерим ее температуру. Затем включим миксер на несколько минут и снова измерим температуру воды после его выключения. Полученные результаты свидетельствуют, что она повысилась. Это можно объяснить лишь тем, что вследствие выполнения миксером работы (других процессов при этом не происходило) увеличилась средняя кинетическая энергия молекул воды. Очевидно, что в данном случае изменение внутренней энергии равно выполненной работе: 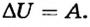
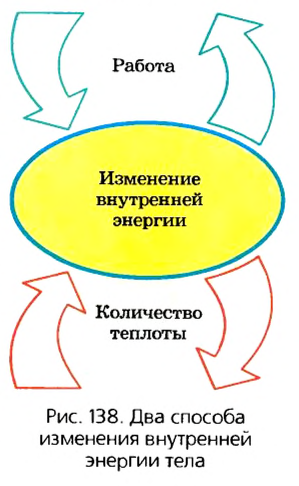
Многочисленные факты и жизненный опыт подтверждают, что существует лишь два способа изменения внутренней энергии тела -теплопередача и выполнение работы (рис. 138). Если эти два процесса происходят одновременно, то изменение внутренней энергии тела будет равно сумме работы, выполненной над телом, и количества теплоты, переданного этому телу: 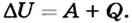
Следовательно, на основании многолетнего опыта человечества и научных фактов можно утверждать, что все тела обладают внутренней энергией, которая состоит из кинетической энергии теплового движения атомов и молекул и потенциальной энергии их взаимодействия. Внутренняя энергия тела может изменяться в результате двух процессов - теплопередачи и выполнения работы.
Виды теплопередачи
Известно, что теплота передается от более нагретых тел к менее нагретым. Однако нам пока что неизвестно, каким образом это происходит. Одинаково ли протекают теплообменные процессы в твердых телах, жидкостях и газах? Какова природа передачи теплоты? Чтобы ответить на эти вопросы, проведем эксперимент.
Возьмем железный гвоздь и стеклянную палочку и будем нагревать их концы в пламени газовой горелки (рис. 139). Через некоторое время мы почувствуем тепло. К пальцам, которые держат железный гвоздь, оно дойдет быстрее, и вскоре мы не сможем гвоздь удержать, поскольку его температура значительно повысится. Стеклянную же палочку мы еще долго сможем держать, хотя со временем и ее температура повысится до такой степени, что будет печь пальцы.

Рассмотрим механизм передачи теплоты в данном случае. Как известно, повышение температуры свидетельствует об увеличении средней кинетической энергии микрочастиц тела, из которых оно состоит. В пламени горелки молекулы воздуха имеют энергию значительно большую, чем молекулы не нагретых стеклянной палочки и железного гвоздя. Поэтому во время столкновения они передают им часть своей энергии, вследствие чего температура концов палочки и гвоздя постепенно повышается. В свою очередь, микрочастицы нагретых концов палочки и гвоздя, получив дополнительную кинетическую энергию, частично отдают ее соседним атомам и молекулам, а те — далее.
Такая передача энергии в результате столкновения частиц происходит как бы по цепочке, последовательно слой за слоем, и со временем температура всех частей тела выравнивается. Поскольку атомы и молекулы твердых тел не перемещаются от одного конца к другому, то и переноса вещества при этом не происходит. Такой вид теплопередачи от более нагретых частей тела к менее нагретым, который вызывает выравнивание температур без переноса вещества, называется теплопроводностью.
Опытным путем мы убедились, что вещества имеют различную теплопроводность. У металлов она больше. Наилучшими проводниками теплоты являются медь и серебро. Значительно хуже тепло распространяется в древесине, кирпиче, тканях, бумаге и т. д. Существуют вещества, плохо проводящие теплоту: асбест, полистирол, вата и т. п. Их применяют для теплоизоляции, например при утеплении жилых помещений. Хуже всех проводят теплоту газы, особенно разреженные. Это их свойство применяют, в частности, в термосах, чтобы продолжительное время сохранять в них жидкости при постоянной температуре (рис. 140).

Существует также иной вид теплопередачи, который в отличие от теплопроводности сопровождается переносом вещества. Его называют конвекцией, и он присущ жидкостям и газам.
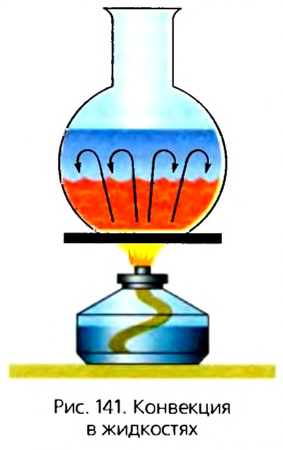
Для наблюдения конвекции в жидкости нальем в колбу воду и будем ее нагревать (рис. 141). Чтобы лучше видеть перемещение потоков жидкости, бросим в воду два-три зернышка перманганата калия (в быту — марганцовки). Мы увидим, что нижние слои воды поднимаются вверх, а верхние опускаются вниз. Это можно объяснить тем, что нижние нагретые слои воды, плотность которых меньше, вытесняются наверх более тяжелыми холодными слоями, плотность которых больше. Поскольку имеет место разница плотностей, возникает выталкивающая сила, которая способствует перемешиванию холодных и теплых слоев воды. Перенос вещества конвекционными потоками происходит до тех пор, пока существует разность температур между слоями жидкости.
Конвекция обусловливает множество явлений природы и процессов, происходящих в повседневной жизни. Например, благодаря ей происходит обогрев комнаты от системы отопления: потоки теплого воздуха от обогревателя (радиатора) поднимаются вверх, а холодный воздух замещает его, нагревается от радиатора и вытесняется холодным воздухом. Такая циркуляция холодного и теплого воздуха выравнивает температуру в разных уголках комнаты и обеспечивает ее обогрев.
Кроме теплопроводности и конвекции, благодаря которым осуществляется теплопередача (с переносом вещества или без него), существует особый вид теплообмена, обусловленный излучением, подобно световому. Иногда его называют лучистым теплообменом. Тела не только излучают тепловую энергию, но и поглощают ее. Например, Земля поддерживает жизнедеятельную температуру благодаря солнечному излучению, которое она поглощает.
Тепловое излучение обусловлено преобразованием части внутренней энергии тел в энергию излучения; и наоборот, энергия поглощенного теплового излучения превращается во внутреннюю энергию. Энергия излучения зависит от многих факторов, в частности от температуры тела: чем она выше, тем больше энергии излучает тело. Действительно, если ладони рук поочередно подносить к холодному и нагретому предметам, например к чайнику, то мы почувствуем теплоту лишь от горячего чайника. Однако это не значит, что тела, имеющие низкую температуру, не излучают тепловую энергию. Просто следует учитывать, что энергия, которую они отдают, меньше той, которую излучают тела с более высокой температурой.
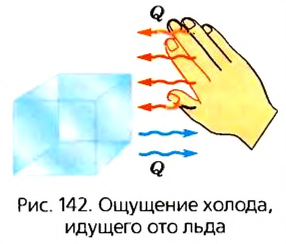
Лед тоже излучает теплоту! Почему же нам кажется, что от него «тянет холодом»? Такое ощущение возникает потому, что рука поглощает меньше тепловой энергии, чем сама излучает, ведь ее температура выше (рис. 142). Фактически нарушен баланс между получаемой энергией и той, которую рука отдала. Поэтому мы ощущаем холод, идущий ото льда.
Кроме температуры, тепловое излучение зависит также от цвета поверхности тела и ее состояния: шероховатые и черные поверхности излучают и поглощают теплоту лучше, чем гладкие и блестящие. Поэтому, например, рефрижераторы (автомобильные или железнодорожные холодильные камеры) красят в серебристый или белый цвет.
Следовательно, в зависимости от природы теплообмена различают три вида теплопередачи:
- — теплопроводность, которая обусловлена взаимодействием атомов и молекул вещества и осуществляется без переноса вещества;
- — конвекция, присущая теплообмену в жидкостях и газах, которая протекает путем перемешивания теплых и холодных потоков вещества;
- — тепловое излучение, которое свойственно всем телам, поскольку они обладают внутренней энергией, часть которой преобразуется в энергию излучения.
Количество теплоты и удельная теплоемкость вещества
Многочисленные факты свидетельствуют о том, что одним из следствий теплопередачи является изменение температуры тела. Действительно, если на плите подогревать воду в чайнике, то ее температура будет повышаться и в конечном итоге она закипит. Таким же образом кузнец раскаляет в горне деталь, которую собирается обрабатывать. Ее температура повышается вследствие передачи определенного количества теплоты, и чем больше она его получит (например, чем дольше ее будут нагревать), тем выше будет температура детали. Следовательно, в процессе теплопередачи изменение температуры тела 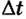 зависит от количества теплоты
зависит от количества теплоты 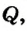 переданного телу; и наоборот, количество теплоты
переданного телу; и наоборот, количество теплоты 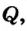 полученное телом, прямо пропорционально изменению температуры:
полученное телом, прямо пропорционально изменению температуры: 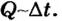
Из курса математики известно, чтобы записать равенство, надо найти коэффициент пропорциональности:

Коэффициент пропорциональности С называют теплоемкостью тела. Он показывает, какое количество теплоты необходимо передать (отобрать) данному телу, чтобы увеличить (уменьшить) его температуру на 1 К. Теплоемкость тела измеряется в джоулях на кельвин 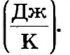
Теплоемкость тела 500 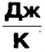 означает, что для повышения его температуры на 1К телу надо предоставить 500 Дж теплоты.
означает, что для повышения его температуры на 1К телу надо предоставить 500 Дж теплоты.
Можно убедиться, что теплоемкость тела зависит от его массы и рода вещества, из которого оно изготовлено (рис. 143). С этой целью сообщим телам разной массы, например ведру воды ( = 10 кг) и стакану воды (
= 10 кг) и стакану воды ( = 200 г), одинаковое количество теплоты 1000 Дж (при этом достаточно влить в них около 2 г кипятка). Очевидно, что температура воды в ведре практически не изменится, а температура стакана с водой повысится приблизительно на 1 К.
= 200 г), одинаковое количество теплоты 1000 Дж (при этом достаточно влить в них около 2 г кипятка). Очевидно, что температура воды в ведре практически не изменится, а температура стакана с водой повысится приблизительно на 1 К.
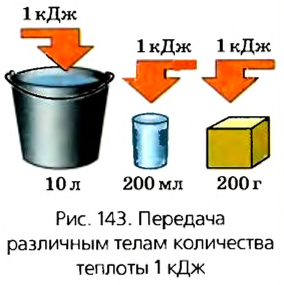
Чем больше масса тела, тем большее количество теплоты необходимо ему передать, чтобы изменить температуру на 1 К.
Если теперь те же 1000 Дж теплоты передать телам одинаковой массы (например, 200 г), но изготовленным из различных веществ, то результат также будет отличаться. В данном случае температура железного предмета повысится на 10 К, свинцового - на 36 К, а масла - лишь на 3 К.
Следовательно, количество теплоты, поглощенное телом в результате теплопередачи, зависит от его массы, рода вещества и разности температур в конечном и начальном состояниях:
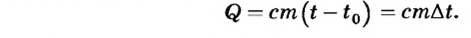
Если сравнить эту формулу количества теплоты с предыдущей, то можно убедиться, что существует величина 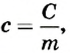 которая не зависит от массы тела и характеризует, таким образом, теплоемкость вещества. Эту физическую величину назвали удельной теплоемкостью вещества. Она показывает, какое количество теплоты поглощает или отдает 1 кг вещества при изменении температуры тела на 1 К:
которая не зависит от массы тела и характеризует, таким образом, теплоемкость вещества. Эту физическую величину назвали удельной теплоемкостью вещества. Она показывает, какое количество теплоты поглощает или отдает 1 кг вещества при изменении температуры тела на 1 К:

Из этой формулы можно установить, что удельная теплоемкость вещества измеряется в 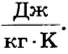
Каждое вещество имеет определенное значение удельной теплоемкости (в таблице на форзаце приведены соответствующие значения). Это значит, что для разных веществ требуется разное количество теплоты для изменения их температуры на 1 К. Подтвердим это утверждение опытным путем.
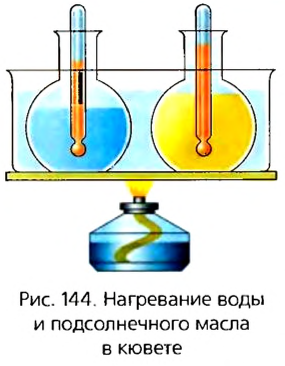
Возьмем две колбы и нальем в одну из них воду, а в другую подсолнечное масло равных масс. Чтобы теплопередача происходила в одинаковых условиях, поместим их в кювету с водой, которую будем нагревать на горелке (рис. 144). Теперь будем наблюдать за изменениями температуры воды и масла. Мы заметим, что температура масла растет быстрее, чем воды. Это значит, что для изменения температуры подсолнечного масла на 1 К требуется меньшее количество теплоты, чем для воды.
Следовательно, физический смысл удельной теплоемкости вещества состоит в том, что эта физическая величина определяет, каким образом теплопередача влияет на тепловое состояние тела. Численное значение удельной теплоемкости вещества указывает, на сколько изменится при теплопередаче внутренняя энергия тела массой 1 кг при изменении его температуры на 1 К. Например, значение удельной теплоемкости алюминия 900 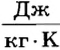 означает, что повышение температуры 1 кг алюминия на 1 К вызовет возрастание его внутренней энергии на 900 Дж.
означает, что повышение температуры 1 кг алюминия на 1 К вызовет возрастание его внутренней энергии на 900 Дж.
Тепловой баланс
В жизненных ситуациях довольно часто возникает необходимость в определении значений физических величин, характеризующих теплообменные процессы после того, как настанет тепловое равновесие. Например, определить температуру после смешивания горячей и холодной воды, либо вычислить количество теплоты, полученное телом при теплопередаче, или найти, какую температуру будет иметь тело в результате теплообмена.
Расчёт тепловых процессов
Для расчета тепловых процессов необходимо составить уравнение относительно количества теплоты, которое приобретают и отдают все тела, находящиеся в теплообменном процессе.
Во всех этих случаях надо составить уравнение, которое содержит неизвестные величины, и найти его решения относительно искомого. Для расчета теплообменных процессов применяют правила, позволяющие учитывать протекание тепловых явлений и процессов и находить искомые величины. Сформулируем их.
Во-первых, все тела, длительное время находящиеся в тепло-обменном процессе, достигают состояния теплового равновесия и их температуры выравниваются. На основании этого можно утверждать: если температура тела А равна температуре тела В, а температура тела В, в свою очередь, равна температуре тела С, то тела А и С также имеют одинаковые температуры.

Во-вторых, следует учесть, что по закону сохранения энергии, который справедлив для всех явлений и процессов природы, теплота не может бесследно исчезнуть или возникнуть из ничего. В этой связи говорят об условии теплового баланса: в процессе теплопередачи одни тела отдают такое количество теплоты, какое получают другие тела.
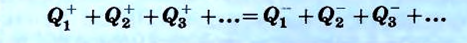
В-третьих, в физике принято приписывать положительное значение количеству теплоты, если тело его получает, и отрицательное значение, если оно отдает теплоту. На основании этого правила записывают уравнение теплового баланса: сумма количества теплоты, которое получили тела, равна сумме количества теплоты, которое другие тела отдали в результате теплопередачи.
Эти три правила определяют последовательность действий, которую целесообразно соблюдать при решении физических задач на расчет теплообменных процессов.
- Шаг 1. Выяснить, какие тела участвуют в теплообмене.
- Шаг 2. Выяснить, при какой температуре тела достигают состояния теплового равновесия. Если по условию задачи она не задана, обозначить ее буквой t.
- Шаг 3. Установить, какие из тел отдают теплоту, а какие ее получают. Записать формулу количества теплоты для каждого из тел, находящихся в теплообменном процессе (при этом следует всегда от большего значения температуры отнимать меньшее).
- Шаг 4. Составить уравнение теплового баланса. В левой его части записать суму количества теплоты, которую получили тела при теплообмене, в правой — сумму количества теплоты, которую они отдали.
- Шаг 5. Решить уравнение относительно искомой величины и найти ее значение.
Примеры решения задач на расчет теплообменных процессов
Пример №1
Какой станет температура воды, если смешать 100 г кипятка и 100 г воды, температура которой 20 °С?
Дано:
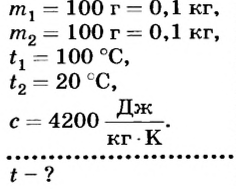
Решение
Согласно условию теплового баланса количество теплоты 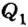 , отдаваемое кипятком, равно количеству теплоты
, отдаваемое кипятком, равно количеству теплоты 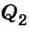 , которое получает холодная вода, достигая температуры t, то есть
, которое получает холодная вода, достигая температуры t, то есть 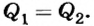
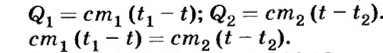
Отсюда 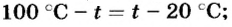
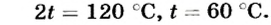
Ответ. Температура воды будет равна 60°С.
Пример №2
В алюминиевую кастрюлю массой 1,5 кг налили 800 г воды при комнатной температуре (20 °С). Сколько кипятка следует долить в кастрюлю, чтобы температура воды повысилась до 45 °С?
Дано:
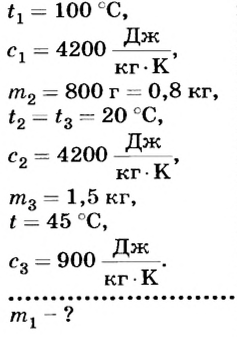
Решение
В теплообмене участвуют алюминиевая кастрюля, кипяток и холодная вода. По условию теплового баланса количество теплоты 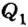 , отданное кипятком, равно количеству теплоты, которое получили холодная вода
, отданное кипятком, равно количеству теплоты, которое получили холодная вода 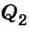 и кастрюля
и кастрюля 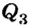 , нагреваясь до температуры 45°С:
, нагреваясь до температуры 45°С:
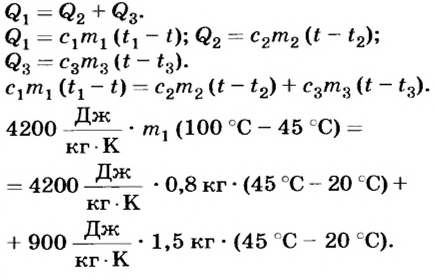
Отсюда 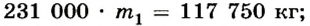
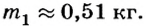
Ответ. Необходимо долить 0,51 кг кипятка.
Пример №3
В алюминиевый калориметр, масса которого 100 г, налили 100 г воды при комнатной температуре. Затем в него погрузили тело массой 150 г, температура которого 80 °С. Через некоторое время температура в калориметре стала 27 °С. Определить удельную теплоемкость тела, погруженного в калориметр.
Дано:

Решение
В результате теплообмена между калориметром, водой и телом температура в калориметре повысилась от 20 до 27°С. По условию теплового баланса количество теплоты 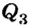 , отданное телом, равно сумме количества теплоты, которое получила вода в калориметре
, отданное телом, равно сумме количества теплоты, которое получила вода в калориметре 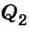 и сам калориметр
и сам калориметр 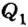 , т.е.:
, т.е.:
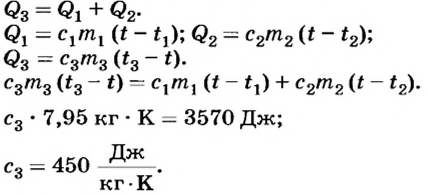
Ответ. Удельная теплоемкость тела равна 450 т. е. оно изготовлено из железа.
т. е. оно изготовлено из железа.
Теплота сгорания топлива и КПД нагревателя
Довольно часто люди получают тепловую энергию за счет химической реакции горения, которая сопровождается выделением определенного количества теплоты. Например, во время сгорания природного газа, используемого в быту, происходит химическая реакция окисления с выделением теплоты, в результате которой образуется оксид карбона 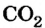 и вода. Расчет показывает, что при сгорании 1 м3 природного газа, состоящего на 90 % из метана
и вода. Расчет показывает, что при сгорании 1 м3 природного газа, состоящего на 90 % из метана 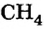 , выделяется примерно 40 МДж теплоты. Этого достаточно, чтобы нагреть почти 100 л воды от 0 до 100 °С.
, выделяется примерно 40 МДж теплоты. Этого достаточно, чтобы нагреть почти 100 л воды от 0 до 100 °С.
Естественно, что разные вещества при горении выделяют разное количество теплоты. Наивысшую теплотворную способность имеют вещества, называемые топливом. Для ее характеристики применяют физическую величину, которая называется удельной теплотой сгорания топлива (обозначается 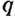 ). Единицей удельной теплоты сгорания топлива является джоуль на килограмм
). Единицей удельной теплоты сгорания топлива является джоуль на килограмм 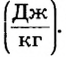 Значения удельной теплоты сгорания некоторых видов топлива приведены в таблице на форзаце.
Значения удельной теплоты сгорания некоторых видов топлива приведены в таблице на форзаце.
Химическая реакция, во время которой происходит окисление, сопровождаемое выделением теплоты, называется горением.
Существуют различные виды топлива: твердое (уголь, дрова, сланцы, торф), жидкое (бензин, мазут, керосин, диз-топливо, спирт), газообразное (метан, пропан, ацетилен).
Числовое значение удельной теплоты сгорания показывает, какое количество теплоты получают при сгорании 1 кг топлива. Например, при сжигании 1 кг сухих дров выделяется приблизительно 12 000 кДж теплоты. Для того чтобы вычислить количество теплоты, получаемое в результате сгорания произвольного количества топлива, необходимо удельную теплоту сгорания умножить на его массу:

Пример решения задачи на теплоту сгорания топлива
Пример №4
Какое количество теплоты выделится при сгорании 40 кг каменного угля? Сколько воды можно нагреть от 10 до 60 °С, используя это количество теплоты?
Дано:
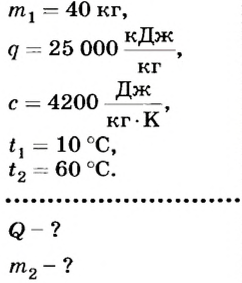
Решение
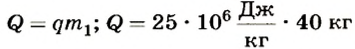
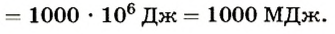
Из формулы количества теплоты 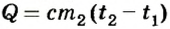 находим массу воды:
находим массу воды:
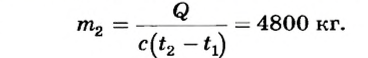
Ответ. При сгорании 40 кг каменного угля выделится 1000 МДж теплоты; за счет этого количества теплоты можно нагреть 4800 кг воды от 10 до 60°С.
В процессе теплопередачи часто применяют нагреватели, с помощью которых можно использовать полученную тепловую энергию от сгорания топлива - газовые горелки, спиртовки, различные печи и т. д. При этом получаемое от сгорания топлива количество теплоты частично идет на нагревание тел, а часть уходит на неэффективные потери (рассеивание в окружающую среду, обогрев самого нагревателя и т. д.). Поэтому вводят коэффициент полезного действия нагревателя, который определяет в процентном отношении ту часть теплоты 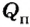 , что пошла на нагревание, относительно всего количества теплоты
, что пошла на нагревание, относительно всего количества теплоты 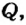 полученного от сгорания топлива:
полученного от сгорания топлива:
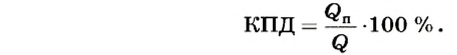
КПД нагревателя характеризует эффективность использования тепловой энергии, полученной в результате сгорания топлива.
Как следует из формулы, чтобы повысить КПД нагревателя, надо увеличить полезно используемую часть тепловой энергии 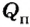 , т. е. уменьшить расход теплоты не по назначению.
, т. е. уменьшить расход теплоты не по назначению.
Плавление твердых тел и кристаллизация
Как известно, при определенных условиях тело может находиться в том или ином агрегатном состоянии - твердом, жидком или газообразном. В обычных условиях древесина, гранит, железо и другие металлы - это твердые тела; вода, бензин, ацетон - это жидкости; воздух, метан, кислород - газы. Вместе с тем изменение физических условий, в частности температуры тел, может вызвать качественные преобразования их свойств: твердые тела могут стать жидкостями, а жидкости, в свою очередь, образовать газообразный пар; и наоборот, газы могут стать сжиженными, а жидкости отвердеть.
Такие преобразования происходят вследствие теплопередачи, которая вызывает соответствующее изменение внутренней энергии тел. Если, например, твердому телу передать некоторое количество теплоты, то его температура начнет повышаться и со временем, при достижении определенного значения температуры, оно может начать плавиться. Тепловой процесс, в результате которого твердое тело переходит в жидкое состояние, называется плавлением.
У разных твердых тел процесс плавления протекает по-разному. Одни тела (их называют кристаллическими) начинают плавиться при строго определенной температуре, которая называется температурой плавления. У других тел (их называют аморфными) такой фиксированной температуры плавления не существует. Кристаллические тела имеют определенное значение температуры плавления. Например, у вольфрама она равна 3387 °С, у стали ее значение равно 1300-1500 °С, а ртуть плавится при -39 °С.
Плавление происходит обязательно с поглощением некоторого количества теплоты. Если ее не сообщать телу, процесс плавления прекратится. Это объясняется тем, что для снижения взаимодействия между атомами и молекулами в твердом 178 теле, которое удерживает их в связанном состоянии, необходима дополнительная энергия, способная разрушить упорядоченное связанное их размещение. Такая энергия может поступать твердому телу благодаря теплопередаче, в результате чего оно начинает постепенно плавиться. Во время этого процесса температура тела не изменяется, поскольку вся сообщаемая тепловая энергия идет на разрушение существующих связей атомов и молекул в твердом теле.
Лед, плавающий в воде при О °С, будет таять лишь в том случае, если ему передать определенное количество теплоты, например, если температура воздуха будет выше и вследствие этого будет происходить теплообмен с окружающей средой.
Ввиду того, что у разных веществ сила взаимодействия атомов и молекул неодинакова, на их плавление идет разное количество теплоты. Поэтому для характеристики энергетических затрат, необходимых для перехода вещества из твердого состояния в жидкое, вводят физическую величину, которая называется удельной теплотой плавления (обозначается 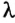 ). Она равна количеству теплоты, которое необходимо для превращения 1 кг вещества из твердого состояния в жидкое при температуре плавления. Удельная теплота плавления измеряется в джоулях на килограмм
). Она равна количеству теплоты, которое необходимо для превращения 1 кг вещества из твердого состояния в жидкое при температуре плавления. Удельная теплота плавления измеряется в джоулях на килограмм 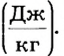 Значения температуры плавления и удельной теплоты плавления для некоторых веществ приведены в таблице на форзаце.
Значения температуры плавления и удельной теплоты плавления для некоторых веществ приведены в таблице на форзаце.
Например, удельная теплота плавления льда равна 332 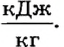
Это означает, что 1 кг льда, находящемуся при температуре О °С, необходимо передать 332 кДж теплоты, чтобы он полностью растаял.
Для того чтобы найти количество теплоты, необходимое для плавления твердого тела произвольной массы 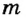 при температуре плавления, надо удельную теплоту плавления вещества
при температуре плавления, надо удельную теплоту плавления вещества 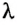 умножить на массу тела:
умножить на массу тела:

Примеры решения задач на плавание твёрдых тел
Пример №5
Какое количество теплоты необходимо для того, чтобы расплавить 2 т чугуна при температуре плавления? Сколько каменного угля для этого надо сжечь, если считать, что вся выделившаяся при горении энергия пойдет на плавление чугуна?
Дано:
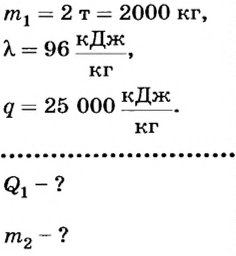
Решение
По определению теплота плавления равна: 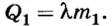 Следовательно,
Следовательно,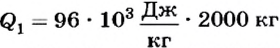
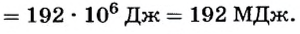
Поскольку по условию вся теплота от сгорания угля идет на плавление чугуна, то 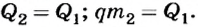 Отсюда
Отсюда
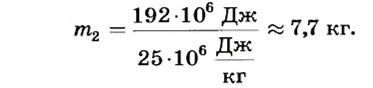
Ответ. Для плавления 2 т чугуна необходимо 192 МДж теплоты; чтобы получить такое количество теплоты, надо сжечь 7,7 кг каменного угля.
Переход вещества из твердого состояния в жидкое происходит вследствие передачи телу определенного количества теплоты. Обратный процесс — переход из жидкого состояния в твердое - происходит при условии, если жидкость будет терять энергию, например, в результате охлаждения. Процесс перехода жидкостей в твердое состояние называется отвердеванием.
Если в процессе плавления твердое тело поглощает энергию, то при кристаллизации, наоборот - жидкость отдает часть своей внутренней энергии. Как и в случае плавления, для характеристики этого процесса вводят понятие удельной теплоты кристаллизации. Ее физический смысл схож с удельной теплотой плавления: это такое количество теплоты, которое выделяется при переходе 1 кг вещества из жидкого состояния в твердое при температуре кристаллизации. Экспериментально подтверждено, что удельная теплота плавления и удельная теплота кристаллизации имеют одно и то же значение. Следовательно, чтобы найти количество теплоты, которое выделяется при кристаллизации, необходимо удельную теплоту кристаллизации 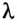 умножить на массу образовавшегося твердого тела
умножить на массу образовавшегося твердого тела 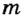 :
:

Для превращения 1 кг вещества из твердого состояния в жидкое надо такое же количество теплоты, какое выделяется при образовании 1 кг твердого тела из жидкости.
Установлено, что кристаллизация происходит при той же 180 температуре, что и плавление. Например, спирт кристаллизуется при —115°С, бензин при 60°С, подсолнечное масло при -16°С.
Пример №6
Какое количество теплоты отдает вода при 0 СС, если образовалось 5 кг льда?
Дано:
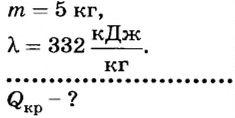
Решение
По определению 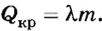
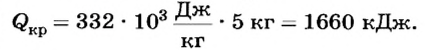
Ответ. При образовании 5 кг льда выделяется 1660 кДж теплоты.
Примеры решения задач на расчет тепловых процессов
При решении задач на расчет тепловых процессов с учетом плавления и кристаллизации тел следует соблюдать общие правила составления уравнения теплового баланса. Вместе с тем надо учитывать и специфические особенности протекания этих тепловых процессов.
- Во-первых, надо помнить, что плавление и кристаллизация происходят при условии достижения температуры плавления. Учитывая это, иногда необходимо дополнительно вычислить количество теплоты, необходимое для нагревания или охлаждения тела до такой температуры.
- Во-вторых, необходимо учитывать, что плавление будет происходить, если твердое тело получает некоторое количество теплоты, и наоборот, в процессе кристаллизации выделяется количество теплоты, равное потере внутренней энергии тела. При этом температура тела не изменяется.
Эти правила вместе с условием теплового баланса определяют последовательность действий, которых целесообразно придерживаться при решении задач на расчет тепловых процессов с учетом плавления и кристаллизации.
- Шаг 1. Из условия задачи выяснить значения температуры тел, находящихся в теплообмене. Если она больше или меньше температуры плавления (кристаллизации), учесть это при составлении уравнения.
- Шаг 2. Определить, какие тепловые процессы предусмотрены условием задачи. Записать формулы количества теплоты для каждого из них.
- Шаг 3. Если в теплообменном процессе находится несколько тел, одни из которых поглощают теплоту, а другие выделяют ее, составить уравнение теплового баланса с учетом следующего правила: в левой части уравнения записать сумму количества теплоты, полученной телами в результате теплообмена; в правой его части — сумму количества теплоты, отданной ими при этом.
- Шаг 4. Решить уравнение относительно искомой величины и найти ее значение.
Приведем примеры решения задач на расчет количества теплоты с учетом процессов плавления и кристаллизации.
Пример №7
Какое количество теплоты надо затратить, чтобы расплавить 10 кг алюминия, температура которого 20оС?
Дано:
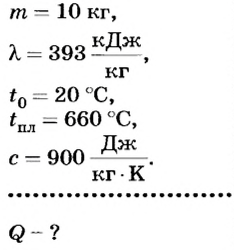
Решение
Чтобы расплавить алюминий, надо сначала нагреть его до температуры плавления (660°С), затратив количество теплоты 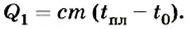
Количество теплоты, необходимое для плавления алюминия: 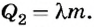
Суммарно необходимо количество теплоты: 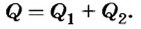
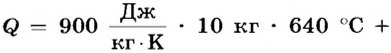
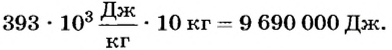
Ответ. Для плавления 10 кг алюминия необходимо 9,7 МДж теплоты.
Пример №8
Внутренняя энергия 5 кг воды комнатной температуры в результате охлаждения уменьшилась на 1 МДж. Какие тепловые процессы произошли при этом? Сколько образовалось льда в результате охлаждения?
Дано:
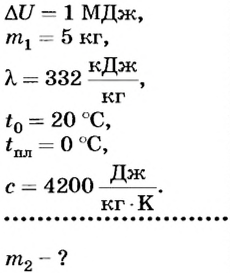
Решение
В процессе охлаждения температура воды сначала понизилась до 0°С. На это ушла часть внутренней энергии, равная:
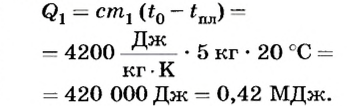
Дальнейшее уменьшение внутренней энергии привело к образованию некоторой массы льда 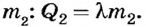
Поскольку 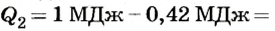
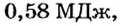 то
то
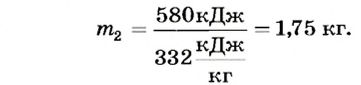
Ответ. Сначала произошло охлаждение воды до 0°С, а затем образовалось 1,75 кг льда.
Испарение и конденсация жидкостей
В жизни мы довольно часто наблюдаем переход жидкостей в газообразное состояние: высыхают лужи после дождя, сохнет выстиранное белье, летом уровень воды в открытых водоемах снижается и т. д. Явление, лежащее в основе этих процессов, называется испарением. С точки зрения атомно-молекулярного учения оно объясняется тем, что часть молекул, которые обладают достаточно высокой кинетической энергией, вылетают с поверхности жидкости, образуя пар -газообразное ее состояние.
Испаряются также и твердые тела (вспомните, что в морозную погоду мокрое белье, покрываясь ледяной коркой, все равно высыхает). У твердых тел процесс испарения называется сублимацией.
Энергетические затраты, идущие на испарение жидкостей, характеризует удельная теплота парообразования. Это физическая величина, которая определяется количеством теплоты, необходимым для испарения 1 кг жидкости при заданной температуре. Ее обозначают буквой г и измеряют в джоулях на килограмм 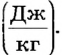
Численное значение удельной теплоты парообразования зависит от различных факторов, в частности от температуры жидкости и давления окружающей среды. Например, удельная теплота парообразования воды при О°С и нормальном атмосферном давлении (760 мм рт. ст.) равна 2500 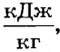 при 20°С - 2454
при 20°С - 2454 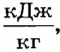 а при температуре кипения (100оС) - всего 2257
а при температуре кипения (100оС) - всего 2257 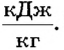 Это значит, что для испарения 1 кг воды, взятой при 0оС, надо сообщить 2500 кДж теплоты, а при 100оС - всего 2257 кДж. Значения удельной теплоты парообразования некоторых веществ при температуре кипения и нормальном атмосферном давлении приведены в таблице на форзаце.
Это значит, что для испарения 1 кг воды, взятой при 0оС, надо сообщить 2500 кДж теплоты, а при 100оС - всего 2257 кДж. Значения удельной теплоты парообразования некоторых веществ при температуре кипения и нормальном атмосферном давлении приведены в таблице на форзаце.
Для того чтобы вычислить количество теплоты, необходимое для испарения жидкости произвольной массы 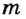 , надо удельную теплоту парообразования жидкости
, надо удельную теплоту парообразования жидкости 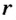 умножить на ее массу:
умножить на ее массу:

Наиболее интенсивно испарение происходит во время кипения жидкости. Для объяснения этого процесса пронаблюдаем, что произойдет с водой в прозрачной стеклянной колбе при ее нагревании (рис. 147).
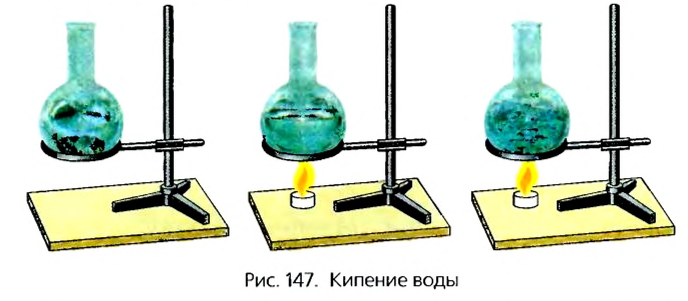
Вначале мы увидим, что на дне и стенках сосуда образуются маленькие пузырьки. Очевидно, что это воздух, которым насыщена вода в результате проникновения в нее молекул газа. Со временем, в результате нагревания объем воздушных пузырьков будет увеличиваться (рис. 148) и внутри их образуется водяной пар, т. е. будет происходить внутреннее испарение жидкости.

Перед закипанием воды мы услышим характерный шум: увеличиваясь в размере, пузырьки под действием силы Архимеда начнут всплывать и лопаться, с шумом выбрасывая в воздух накопившийся в них водяной пар. То есть начнется кипение. Замечено, что при этом температура жидкости остается постоянной. Температура, при которой кипит жидкость, называется температурой кипения. Постоянное ее значение объясняется тем, что все количество теплоты, переданное жидкости, идет на внутреннее испарение во всем ее объеме. Следовательно, кипение - это внутреннее испарение жидкости, в результате которого образовавшийся внутри нее пар вырывается наружу.
Для каждого вещества температура кипения имеет свое определенное значение, зависящее от различных факторов. В частности, она зависит от внешнего давления, поскольку пузырькам необходимо преодолевать его противодействие, чтобы вырваться наружу. Поэтому с увеличением давления будет возрастать и температура кипения, и наоборот, с его уменьшением она будет снижаться. Например, в высоких горах вода кипит при более низкой температуре, чем при нормальном атмосферном давлении.
Таким образом, увеличивая внешнее давление, можно повышать температуру кипения жидкости. В быту это свойство используют в кастрюлях-скороварках: благодаря плотно прилегающей крышке, внутри такой кастрюли дополнительное давление может достигать 2-5 гПа, повышая тем самым температуру кипения воды до 120-150оС. В специальных котлах-автоклавах из-за высокого давления воду нагревают до 250 300оС.
В природе наряду с испарением наблюдается также обратный процесс, когда при определенных условиях газ превращается в жидкость. Например, летним утром часто выпадает роса, осенью при резком снижении температуры воздуха образуется туман и т. д. Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией. Для того чтобы это произошло, нужны центры конденсации, роль которых в газах играют различные порошинки, примеси и т. п. Как правило, конденсация происходит на поверхности жидкостей или твердых тел.
Образование туч объясняется конденсацией водяного пара в атмосфере.
В отличие от испарения, когда теплота поглощается, при конденсации теплота высвобождается. Количество теплоты, выделяемое при конденсации, вычисляется по такой же формуле, что и для испарения (как взаимообратный процесс): 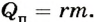 Установлено, что удельная теплота конденсации равна удельной теплоте парообразования.
Установлено, что удельная теплота конденсации равна удельной теплоте парообразования.
При определенных условиях возможна конденсация вещества из газообразного сразу в твердое состояние. Например, зимой из водяного пара, находящегося в воздухе, образуются снежинки и изморозь на деревьях либо прекрасные узоры на стекле в морозную погоду.
Примеры решения задач на расчет количества теплоты с учетом испарения и конденсации
При решении задач на расчет количества теплоты с учетом испарения и конденсации, как и для любых тепловых процессов, следует придерживаться правил составления уравнения теплового равновесия (см. § 53). Вместе с тем существуют особенности протекания этих процессов, которые целесообразно также учитывать.
- Во-первых, надо помнить, что испарение жидкостей, в отличие от плавления и кристаллизации, происходит при любой температуре. Поэтому при вычислении количества теплоты следует выбирать соответствующее значение удельной теплоты парообразования для заданной условием задачи температуры. Если оно не указано, то из таблицы берут значение как для температуры кипения, однако учитывают, что жидкость необходимо нагреть до этой температуры. В таком случае общее количество теплоты равно
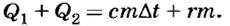
- Во-вторых, при составлении уравнения следует учитывать, что испарение требует определенных затрат теплоты, а конденсация сопровождается выделением определенного количества теплоты.
- В-третьих, конденсация происходит при некоторых физических условиях, зависящих от температуры и давления. Несоблюдение этих условий, указанных в задаче, исключает возможность протекания самого явления.
Пример №9
Какое количество теплоты надо затратить, чтобы нагреть 5 кг воды от О°С до температуры кипения и полностью ее испарить при нормальном атмосферном давлении?
Дано:
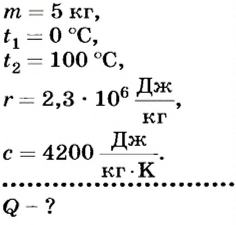
Решение
По условию задачи воду сначала надо нагреть от 0 до 100°С, а затем испарить. Следовательно, 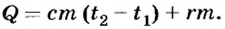
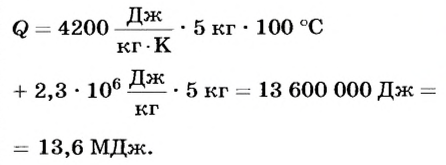
Ответ. Для нагревания и испарения 5 кг воды потребуется 13,6 МДж теплоты.
Пример №10
Воде массой 2 кг при комнатной температуре (20°С) передано 1050 кДж теплоты. Сколько воды при этом испарилось?
Дано:
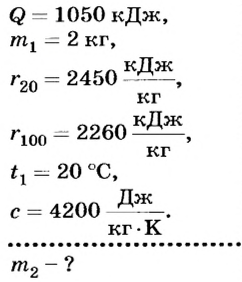
Решение
Поскольку в условии задачи не сказано, каким образом происходило испарение - с нагреванием до кипения или при комнатной температуре, рассмотрим оба случая.
1) Если испарение происходило при температуре 20°С, то 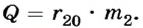 Отсюда
Отсюда 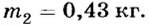
2) Если сначала воду нагрели до температуры кипения, а затем испарили, то 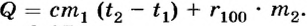 Отсюда
Отсюда 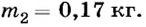
Ответ. В зависимости от способа испарения, используя 1050 кДж теплоты, можно испарить 0,43 кг или 0,17 кг воды.
Пример №11
Какое количество теплоты выделится при конденсации 200 г водяного пара при температуре 100°С? Сравните его с количеством теплоты, необходимым для нагревания воды такой же массы от 0 до 100°С.
Дано:
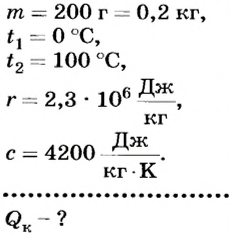
Решение
По определению 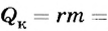
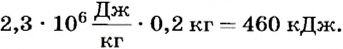
Для нагревания воды от 0 до 100°С необходимо передать ей
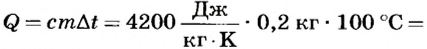
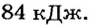
Следовательно, 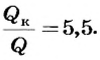
Ответ. При конденсации водяного пара выделяется 460 кДж теплоты. Это в 5,5 раза больше, чем необходимо для нагревания воды такой же массы от 0 до 100°С.
Пример №12
В калориметр, в котором находится 1 л воды при 10°С, впустили 100 г водяного пара, температура которого 100°С. Какая температура воды установится в калориметре после наступления теплового равновесия?
Дано:
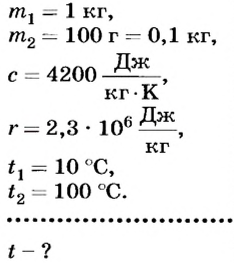
Решение
В теплообменном процессе находятся вода и водяной пар. В результате конденсации водяной пар и образовавшаяся при этом вода отдают теплоту, а находящаяся в калориметре вода ее поглощает. Запишем уравнение теплового баланса:
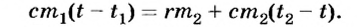
Сделав определенные преобразования и решив уравнение относительно неизвестного t, получим:
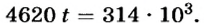
Отсюда 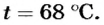
Ответ. Температура воды будет равна 68°С.
Объяснение изменения агрегатных состояний вещества на основе атомно-молекулярного учения
Как известно, вещество находится в одном из агрегатных состояний - твердом, жидком или газообразном - в зависимости от характера движения и взаимодействия атомов и молекул. Поглощение или потеря телом определенного количества теплоты может привести к изменению его агрегатного состояния. Как следствие, изменяется и его внутренняя энергия. Объясним, каким образом это происходит, на примере воды.
Возьмем лед массой 1 кг при температуре -40°С и будем наблюдать за тем, что произойдет в результате поглощения им некоторого количества теплоты (рис. 149).
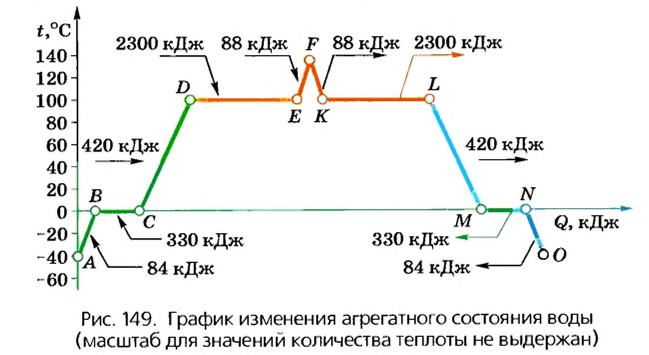
Участок АВ - нагревание льда, участок ВС - таяние льда.
Вначале термометр будет фиксировать повышение температуры льда от -40°С до 0°С (температура плавления льда), однако он не будет таять. Происходит это потому, что у льда молекулы жестко связаны между собой и могут лишь колебаться в узлах кристаллической решетки. Очевидно, что повышение температуры льда будет влиять на подвижность молекул, однако потенциальная энергия их взаимодействия значительно превосходит кинетическую энергию колебаний, и поэтому связи не разрываются и форма твердого тела сохраняется. При достижении температуры плавления (точка В) потенциальная и кинетическая энергии становятся приблизительно равными, следовательно, молекулярные связи могут разрушаться - лед начинает таять при условии, что ему сообщают теплоту. Образуется смесь воды и льда, температура которой не изменяется (участок ВС), пока весь лед не растает (точка С).
Участок CD - нагревание воды, участок DE - испарение воды.
Дальнейшая передача теплоты будет сопровождаться нагреванием воды, молекулы которой станут более подвижными. Кинетическая энергия молекул воды будет незначительно превышать потенциальную энергию их взаимодействия, поэтому отдельные из них смогут вылететь из жидкости, образуя пар. При достижении температуры кипения (точка D) она не изменяется и все полученное количество теплоты идет на преодоление межмолекулярного взаимодействия и превращение воды в водяной пар (переход жидкости в газообразное состояние).
Участок EF- нагревание пара.
В данном случае кинетическая энергия молекул намного превышает потенциальную энергию их взаимодействия. Если сосуд закрыт, то дальнейшее сообщение теплоты приведет к повышению температуры водяного пара. Молекулы воды будут свободно перемещаться в предоставленном им пространстве и взаимодействовать лишь при столкновении. Чем выше температура пира, тем быстрее они будут перемещаться, следовательно, тем больше будет их кинетическая энергия.
Рассмотрим теперь обратные процессы, которые будут происходить, когда тело теряет определенное количество теплоты.
Участок FK - охлаждение пара, участок KL - конденсация пара.
Если водяной пар охлаждать (участок FK), то кинетическая энергия его молекул будет уменьшаться. Через некоторое время настанет момент (точка К), когда пар начнет конденсироваться. В зависимости от давления это может происходить при разной температуре, ведь температура кипения жидкостей зависит от давления. При нормальном давлении (760 мм рт. ст.) конденсация пара наступит при температуре 100°С. В данном случае средняя кинетическая и потенциальная энергии молекул станут приблизительно равными, и молекулы воды будут взаимодействовать между собой с такой силой, что образуется жидкость. Конденсация продолжается до тех пор, пока у пара отбирают теплоту и его внутренняя энергия уменьшается. При этом температура пара остается постоянной (участок KL), поскольку изменение внутренней энергии равно количеству теплоты, которое теряет пар при охлаждении.
Участок LM - охлаждение воды.
После того как весь пар сконденсируется, дальнейшее отбирание теплоты вызовет охлаждение воды (участок LM) до температуры кристаллизации (у воды она равна 0°С). Молекулы воды теряют подвижность, их кинетическая энергия будет уменьшаться. Настанет момент (точка М), когда потенциальная энергия взаимодействия начнет превосходить кинетическую энергию, и тогда происходит кристаллизация, образование льда.
Участок MN - кристаллизация воды, участок NO - снижение температуры льда.
На протяжении всего этого процесса температура остается постоянной, равной температуре плавления льда, поскольку количество теплоты, отобранное у воды, равно изменению ее внутренней энергии. После того как вода полностью перейдет в твердое состояние (точка N), дальнейшее уменьшение внутренней энергии вследствие потери количества теплоты приведет к снижению температуры льда (участок NO).
Следовательно, из графика изменения агрегатных состояний вещества видно, что протекание обратных тепловых процессов (охлаждение, конденсация, кристаллизация) происходит симметрично процессам, какие наблюдались при сообщении теплоты (нагревание, плавление, испарение)1. При этом:
- а) температуры плавления и кристаллизации вещества одинаковые;
- б) количество теплоты, необходимое для плавления вещества, равно количеству теплоты, которое выделяется в процессе кристаллизации такой же массы вещества;
- в) пар конденсируется при той же температуре, при которой вода кипит;
- г) количество теплоты, поглощаемое в процессе испарения жидкости, равно количеству теплоты, которое выделяется при конденсации пара такой же массы.
1 График будет симметричен, если передача и отбирание теплоты происходят одинаково в количественном отношении, а потерями энергии можно пренебречь.
Превращение тепловой энергии в механическую. Принцип действия тепловых машин
Издавна человек задумывался над тем, как сделать механизмы, которые помогали бы ему выполнять тяжелую работу. Сначала он использовал простые механизмы - рычаги, наклонную плоскость, различные передающие механизмы, блоки и т. п.
С тех пор как человечество познало закономерности тепловых явлений, ученые стремились найти способы использования тепловой энергии, в частности преобразования ее в механическую.
В 1784 г. английский изобретатель Дж. Уатт создал первый паровой двигатель, который на протяжении долгого времени применялся в качестве универсального двигателя, приводящего в движение паровозы и пароходы, даже первые автомобили. В 1766 г. русский изобретатель И. И. Ползунов создал паровую машину, которая долгие годы работала на одном из горнодобывающих заводов Урала.
Тепловая машина -это механизм, выполняющий механическую работу за счет тепловой энергии.
Принцип действия тепловых машин объясним на основе эксперимента. Возьмем цилиндр с поршнем, положим на него груз, например гирю, и начнем нагревать газ в цилиндре под поршнем (рис. 150).
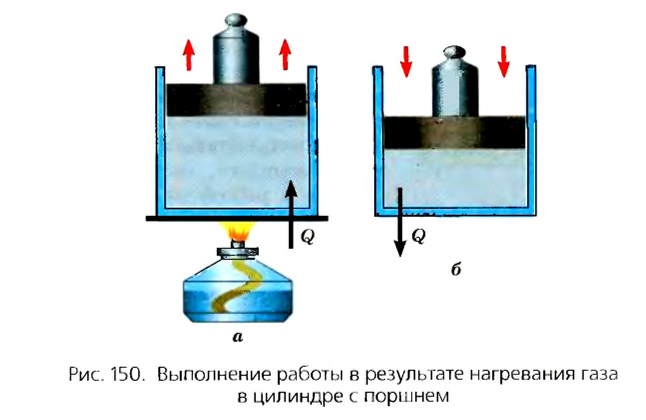
С повышением температуры газа поршень начнет постепенно перемещаться вверх, поскольку вследствие нагревания газ расширяется. Следовательно, в процессе теплопередачи газ под поршнем выполняет механическую работу, поднимая груз на некоторую высоту.
Если нагревание газа прекратить, то в результате теплообмена с окружающей средой он будет остывать, его объем уменьшится и поршень опустится вниз.
На таком способе преобразования тепловой энергии в механическую путем выполнения работы основывается действие тепловых машин. Это двигатели внутреннего сгорания, паровые и газовые турбины, дизельные и турбореактивные двигатели и т. д. Со времен их изобретения они постоянно совершенствуются, но их принцип действия неизменно основывается на общих закономерностях преобразования тепловой энергии в механическую.
В 1824 г. французский ученый С. Карно предположил, что тепловая машина конструктивно должна состоять из нагревателя (источника теплоты), рабочего тела, которое собственно и выполняет работу (например, пар в паровых двигателях либо смесь воздуха и паров бензина в двигателях внутреннего сгорания), и охладителя (рис. 151). Такая машина может выполнять работу при условии, что температура охладителя ниже температуры нагревателя.
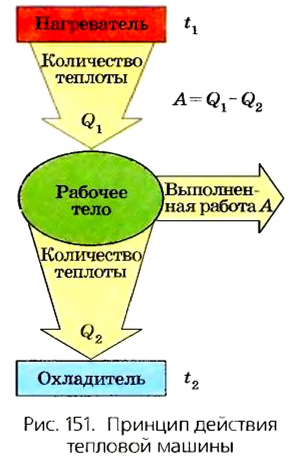
В 1851 г. английский физик В. Томсон (лорд Кельвин) открыл закон, сыгравший решающую роль в создании тепловых машин. Он установил, что в природе невозможен процесс, единственным результатом которого будет выполнение механической работы лишь за счет охлаждения источника тепловой энергии, без нагревания окружающих тел. Это утверждение означает, что нельзя создать вечный двигатель, т. е. тепловую машину, которая бы превратила в работу всю ее внутреннюю энергию.
Как известно, согласно закону сохранения энергии механическая работа, выполненная тепловой машиной, равна разности количества теплоты 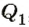 , переданного нагревателем рабочему телу, и количества теплоты
, переданного нагревателем рабочему телу, и количества теплоты 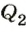 , которое рабочее тело отдаст охладителю:
, которое рабочее тело отдаст охладителю: 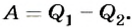 Следовательно, каждая тепловая машина характеризуется коэффициентом полезного действия (КПД), который определяет ее способность преобразовывать тепловую энергию в механическую работу. По определению КПД тепловой машины равен отношению выполненной работы А к сообщенному ей количеству теплоты
Следовательно, каждая тепловая машина характеризуется коэффициентом полезного действия (КПД), который определяет ее способность преобразовывать тепловую энергию в механическую работу. По определению КПД тепловой машины равен отношению выполненной работы А к сообщенному ей количеству теплоты 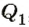 :
:
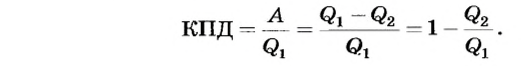
Поскольку 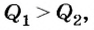 to можно сделать вывод, что КПД тепловых машин всегда меньше 1.
to можно сделать вывод, что КПД тепловых машин всегда меньше 1.
Чаще всего КПД выражают в процентах. Тогда необходимо численное значение КПД умножить на 100 %. Тепловые двигатели имеют невысокий КПД, как правило, 20-30 %.
Двигатель внутреннего сгорания
Одним из наиболее распространенных видов тепловой машины является двигатель внутреннего сгорания (ДВС), широко применяемый сейчас в различных транспортных средствах, в частности, в автомобилях.
В современных двигателях различают карбюраторные ДВС и дизельные (названные в честь их создателя, немецкого инженера Р. Дизеля).
Рассмотрим принцип действия четырехтактного двигателя внутреннего сгорания (рис. 152). Основным его элементом является цилиндр с поршнем, где происходит сгорание топлива (отсюда название двигателя). Как правило, их несколько. Поэтому говорят о двух-, четырех-, восьмицилиндровых двигателях.
- I такт - впуск топливной смеси.
- II такт - сжатие смеси.
- III такт - рабочий ход.
- IV такт — выпуск отработанных газов.
Цилиндр имеет два или больше отверстий с клапанами -впускным и выпускным. Работа ДВС основывается на четырех последовательных процессах - тактах, которые непрерывно повторяются. Первый такт — это впуск топливной смеси, осуществляемый через впускной клапан, когда поршень перемещается вниз. После того как он достигнет нижней точки, всасывание топлива прекращается и оба клапана закрываются. Во время второго такта, когда поршень движется вверх, происходит сжатие смеси, вследствие чего ее температура повышается. В верхней точке поршня смесь зажигается искрой от электрической свечи (в карбюраторных двигателях) или самовоспламеняется от высокой температуры сильно сжатого газа (в дизельных двигателях). Смесь воспламеняется, ее температура резко возрастает, давление газа растет, в результате чего он толкает поршень вниз. Начинается третий такт - рабочий ход, во время которого собственно и выполняется работа. С помощью специального соединения - кривошипно-шатунного механизма - движение поршня передается коленчатому валу, а через него — к колесам автомобиля. Выполняя работу, газ расширяется, охлаждаясь при этом. После прохождения поршнем нижней точки открывается выпускной клапан, поршень по инерции движется вверх, выполняя четвертый такт - выпуск отработанных газов. На этом рабочий цикл четырехтактного двигателя заканчивается и начинается следующий цикл работы ДВС с первого такта.
В связи с тем, что из четырех тактов ДВС лишь один — рабочий, двигатель имеет инерционный механизм. Как правило, это маховик, за счет своих инерционных свойств передает приобретенную энергию коленчатому валу. Благодаря этому обеспечивается выполнение остальных тактов ДВС.
Паровая и газовая турбины
С целью преобразования тепловой энергии в механическую на тепловых и атомных электростанциях применяют турбины. Их, как основной движущий элемент, применяют также в газотурбинных двигателях, используемых в авиации. В зависимости от рабочего тела (пара или газа) различают паровые и газовые турбины.
Слово «турбина» происходит от латинского turbo -вихрь, вращение с большой скоростью.
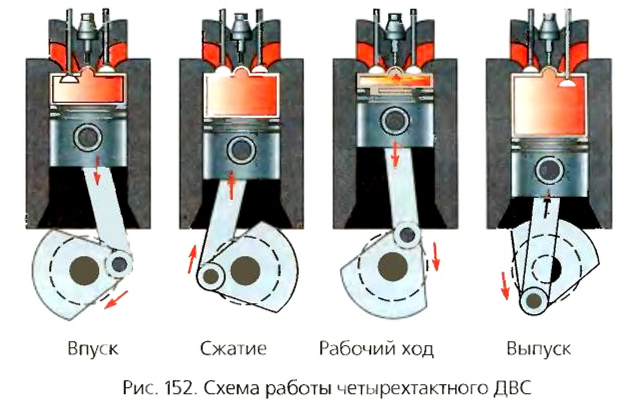
В основу действия турбин положена издавна известная идея вращения колеса с лопастями под давлением водяного пара или газа. Эту идею человек реализовал в работе ветряков и водяных мельниц: поток воздуха или воды действует на лопасти или ковши колеса мельницы и вынуждает их вращаться (рис. 153).
В паровых турбинах преобразование энергии происходит за счет разности давлений водяного пара на входе (вводящий паропровод 1) и выходе (выводящий паропровод 2) (рис. 154). Поэтому они имеют блоки высокого и низкого давления. На пути водяного пара находятся несколько рабочих колес 3 с лопастями. Пар, производимый паровым котлом теплоэлектростанции, направляется под высоким давлением по вводящему паропроводу 1 на рабочие колеса с лопастями. Под его действием турбина вращается.
Теплоэнергетическая установка преобразует тепловую энергию в механическую.
Таким образом, тепловая энергия водяного пара, образованного в теплоэнергетическом блоке электростанции, благодаря турбине превращается в механическую. В свою очередь, с помощью особого устройства, которое называется генератором, механическая энергия преобразуется в электрическую.
Паровые турбины современных теплоэлектростанций развивают мощность до 1300 МВт.
Газовая турбина отличается от паровой тем, что в ней есть специальная камера сгорания, благодаря которой повышается энергетическая эффективность установки.
В газовых турбинах дополнительно устанавливают специальную камеру сгорания, в которую впрыскивается топливо. Сжатый в ней воздух имеет очень высокую температуру, и поэтому попавшее в нее топливо воспламеняется. В результате стремительного повышения температуры газ действует на лопасти рабочего колеса, вращая его. Часть энергии газовая турбина отдает компрессору, нагнетающему воздух в камеру сгорания. Другая ее часть идет на выполнение работы движущим элементом газотурбинного двигателя, например, винтом самолета, колесом автомобиля, валом электрогенератора и т. д.
Мощность современных газовых турбин достигает 100-150 МВт.
Экологические проблемы применения тепловых машин
Широкое применение тепловых машин в жизнедеятельности человека привело к обострению экологических проблем, связанных с выбросами в атмосферу вредных веществ. Среди них особенное место занимает диоксид карбона  , опасный тем, что способствует образованию «парникового эффекта», вследствие чего температура Земли повышается. По данным международных исследований, по сравнению с 1961 г. средняя температура воздуха на Земле возросла почти на 1°С. Основной причиной изменения климата нашей планеты ученые считают рост выбросов диоксида карбона в атмосферу.
, опасный тем, что способствует образованию «парникового эффекта», вследствие чего температура Земли повышается. По данным международных исследований, по сравнению с 1961 г. средняя температура воздуха на Земле возросла почти на 1°С. Основной причиной изменения климата нашей планеты ученые считают рост выбросов диоксида карбона в атмосферу.
В мире сегодня из разных источников в атмосферу попадает почти 30 млрд тонн 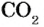 , а лесами поглощается лишь 4 млрд тонн; доля Украины в этом общепланетном процессе составляет 1,1 %. Почти половина выбросов
, а лесами поглощается лишь 4 млрд тонн; доля Украины в этом общепланетном процессе составляет 1,1 %. Почти половина выбросов 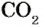 , в атмосферу принадлежит производителям энергии - тепловым электростанциям, работающим на угле, нефти и газе (рис. 155). Выбросы автомобильного и иного транспорта составляют 24,1 %. Остальное — это производственная деятельность (заводы и фабрики), процессы жизнеобеспечения и т. д.
, в атмосферу принадлежит производителям энергии - тепловым электростанциям, работающим на угле, нефти и газе (рис. 155). Выбросы автомобильного и иного транспорта составляют 24,1 %. Остальное — это производственная деятельность (заводы и фабрики), процессы жизнеобеспечения и т. д.
В природе сейчас нарушено динамическое равновесие восстановления кислорода в реакциях фотосинтеза. Если не принимать необходимых мер но улучшению экологической ситуации, такое положение может привести к ужасным катастрофам, которые угрожают всему человечеству. Поэтому в последнее время мировым сообществом предлагаются меры, направленные на уменьшение выбросов 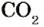 в атмосферу.
в атмосферу.

В частности, сегодня производители автомобильных двигателей уделяют много внимания техническому усовершенствованию ДВС, например, использованию различных катализаторов и фильтров, улучшающих экологические показатели двигателей. Например, на одной из выставок автомобиль 200 «Mercedes-Benz Е-320» был награжден за внедрение топливной системы, уменьшающей выбросы диоксида карбона на 80 % и приведение их к экологическим нормам «Евро-5». Однако такие усовершенствования происходят в основном за счет уменьшения мощности и КПД двигателей, что ухудшает их технические характеристики.
Использование современных технологий в ДВС не может в целом снять проблему выбросов 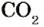 , поскольку продуктами сгорания в этих двигателях остаются нефтепродукты (бензин или дизельное топливо). Поэтому в последнее время в автомобилестроении ищут иные подходы. Например, производители автомобилей «Toyota» выпускают машины с гибридным приводом, в котором используется два типа двигателей — электрический и ДВС. Электродвигатели конструктивно вмонтированы в каждое колесо и помогают основному двигателю, создавая дополнительную тягу.
, поскольку продуктами сгорания в этих двигателях остаются нефтепродукты (бензин или дизельное топливо). Поэтому в последнее время в автомобилестроении ищут иные подходы. Например, производители автомобилей «Toyota» выпускают машины с гибридным приводом, в котором используется два типа двигателей — электрический и ДВС. Электродвигатели конструктивно вмонтированы в каждое колесо и помогают основному двигателю, создавая дополнительную тягу.
Предлагаются также конструктивные решения в виде электромобилей, работающих от аккумуляторных батарей. Однако незначительный ресурс обычных кислотных аккумуляторных батарей (сегодня это приблизительно 300-400 км на одном за ряде батареи), а также проблемы их утилизации не позволяют пока сделать электромобили массовыми. Вместе с тем продолжаются поиски компактных и легких аккумуляторов, например, на так называемых водородных элементах, которые позволят решить эту проблему.
В последнее время инженеры ведущих автомобильных фирм «Ford» и «Volvo» производят двигатели, способные работать.
как на бензине, так и на альтернативном виде топлива - биоэтаноле или их смеси, что снижает выбросы 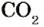 до 30- 80 %.
до 30- 80 %.
Однако использование всех этих видов топлива не может окончательно решить экологические проблемы применения ДВС, поскольку продукты сгорания все равно будут содержать вредные вещества. Поэтому сейчас ведутся поиски восстанавливающихся источников энергии. Одним из них является водород (гидроген), который считают одним из наиболее перспективных видов топлива, способным заменить бензин и дизтопливо. Водородные двигатели считаются экологически чистыми, поскольку продуктом сгорания в них является водяной пар, не вызывающий вредных выбросов 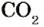 . Кроме того, водород сгорает в камере практически полностью в широком диапазоне температур, и поэтому в отношении эффективности использования может быть идеальным топливом.
. Кроме того, водород сгорает в камере практически полностью в широком диапазоне температур, и поэтому в отношении эффективности использования может быть идеальным топливом.
Экологические проблемы применения тепловых машин не ограничиваются лишь их конструктивными усовершенствованиями с целью уменьшить вредные выбросы. Важнейшей проблемой является также возобновление энергетических запасов, 201 которые беспрерывно расходуются в процессе человеческой деятельности. Ведь полезные ископаемые воссоздаются природой на протяжении веков, а расходуются практически мгновенно. Их запасы не беспредельны и требуют рационального использования. В Украине основным источником энергоресурсов (83,4 %) остаются тепловые электростанции, работающие на угле, нефти или газе. Доля атомной энергетики составляет 16,1 %; меньше 1 % принадлежит возобновляемым источникам энергии. Мировые тенденции развития энергетики говорят о том, что для жизнедеятельности человека надо искать альтернативные источники, которые основываются на воспроизводстве природных ресурсов: воде, солнце, ветре и т. д.
Не менее важной является проблема утилизации отходов жизнедеятельности человека, экономного использования энергоресурсов. В настоящее время во многих странах мира пытаются решить проблему утилизации бытовых отходов, которых становится все больше, а также возможность получения энергии в результате экологически «чистого» сжигания мусора. Это становится важным не только для больших городов, но и для малых селений и городков. Ведь планета Земля - это общий наш дом. Мы живем на разных континентах, в разных городах и селах. Но наш мир - глобальный, взаимосвязанный прежде всего экологическими проблемами. Нарушение динамического равновесия в одной его части неизменно отражается природными катаклизмами на всей планете.
Итоги:
Протекание тепловых явлений и процессов в природе происходит по определенным законам, которые человечество познавало на протяжении своей многовековой истории.
- Тепловое состояние тел определяет температура, характеризующая среднюю кинетическую энергию хаотического движения атомов и молекул. Температуру тел измеряют при помощи термометров, которые могут быть проградуированы за разными шкалами. Одной из самых распространенных является шкала Цельсия, в которой 0°С соответствует температуре таяния льда, а 100°С - температуре кипения воды при нормальном атмосферном давлении (760 мм рт. ст.). Единицей температуры в Международной системе единиц является кельвин (обозначается К), по размеру равный градусу Цельсия (обозначается °С).
- Тепловые явления и процессы всегда протекают так, что более нагретые тела отдают теплоту менее нагретым и со временем их температуры выравниваются.
- Внутренняя энергия тела обусловлена тепловым движением и взаимодействием атомов и молекул, из которых оно состоит. Ее можно изменить двумя способами: за счет выполнения работы либо в результате теплопередачи. В природе существует три вида теплопередачи - теплопроводность, конвекция и тепловое излучение.
- Следствием теплообмена между телами может быть: повышение или снижение их температуры, изменение агрегатного состояния вещества или выполнение механической работы.
- Количество теплоты, сообщенное телу, определяется его теплоемкостью и изменением температуры:
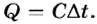 Теплоемкость тела равна произведению удельной теплоемкости вещества на массу тела:
Теплоемкость тела равна произведению удельной теплоемкости вещества на массу тела: 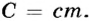 Отсюда в общем виде количество теплоты вычисляется по формуле:
Отсюда в общем виде количество теплоты вычисляется по формуле: 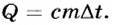
- В теплообменных процессах выполняется условие теплового баланса: сумма количества теплоты, полученного телами в результате теплообмена, равна сумме количества теплоты, которое отдали другие тела, находящиеся в теплообмене.
- Различные виды топлива имеют разную теплотворную способность, которая характеризуется удельной теплотой сгорания топлива. Количество теплоты, выделяемое при горении, равно произведению удельной теплоты сгорания топлива на его массу:
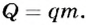 Коэффициент полезного действия (КПД) нагревателя вычисляется в процентах как отношение количества теплоты
Коэффициент полезного действия (КПД) нагревателя вычисляется в процентах как отношение количества теплоты 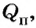 которое пошло на нагревание, к полному количеству теплоты
которое пошло на нагревание, к полному количеству теплоты 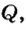 полученному в результате сгорания топлива:
полученному в результате сгорания топлива:
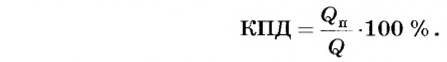
- Изменение агрегатных состояний вещества определяют тепловые процессы, которые сопровождаются поглощением или выделением некоторого количества теплоты. В частности, во время плавления или кристаллизации твердых тел, происходящих при определенной температуре, количество теплоты равно произведению удельной теплоты плавления вещества на массу тела:
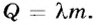 Количество теплоты при испарении или конденсации жидкости вычисляется как произведение удельной теплоты парообразования на массу жидкости или пара:
Количество теплоты при испарении или конденсации жидкости вычисляется как произведение удельной теплоты парообразования на массу жидкости или пара: 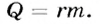
- Для преобразования тепловой энергии в механическую существуют тепловые машины, конструктивно состоящие из источника тепловой энергии (нагреватель), рабочего тела, превращающего полученное количество теплоты
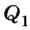 в механическую работу А, и охладителя, которому рабочее тело отдает неиспользованную часть тепловой энергии
в механическую работу А, и охладителя, которому рабочее тело отдает неиспользованную часть тепловой энергии 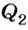 . Тепловые машины характеризуются коэффициентом полезного действия:
. Тепловые машины характеризуются коэффициентом полезного действия:
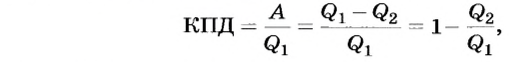 который всегда меньше 1.
который всегда меньше 1.
- В основу принципа действия тепловых машин положены фундаментальные законы природы. В частности, закон сохранения и превращения энергии гласит, что невозможен такой тепловой процесс, единственным результатом которого было бы выполнение механической работы лишь за счет охлаждения источника тепловой энергии, без каких-либо изменений в окружающей среде. Это значит, что нельзя создать так называемый вечный двигатель, который способен превратить всю переданную ему тепловую энергию в работу.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |