
Строение и свойства твёрдых тел в физике - формулы и определение с примерами
Твердые тела и некоторые их свойства
Твердые тела — это тела, сохраняющие свою форму и объем при отсутствии внешнего воздействия. Например, тела, изготовленные из металла, пластмассы, стекла и эбонита, являются твердыми телами. Твердые тела по своей природе и физическим свойствам делятся на две группы: кристаллические и аморфные тела. К кристаллическим телам относятся минералы, например, поваренная соль, кварц, горный хрусталь, металлы в твердом состоянии. К аморфным же телам относятся эбонит, стекло, пластмассы, смола, канифоль, янтарь, опал, обсидиан и другие. Чем отличаются кристаллические тела от аморфных?
Кристаллические тела. Частички кристаллических тел (атомы, молекулы или ионы) обладают в пространстве упорядоченным расположением, образующим кристаллическую решетку. Кристаллическим телам присуща определенная температура плавления.
• Места расположения частиц в кристаллической решетке называют узлами кристаллической решетки.
Идеальное кристаллическое тело состоит из множества повторяющихся в пространстве кристаллических ячеек на произвольном удалении. По этой причине в кристаллических телах наблюдается расположение их частиц в дальнем порядке.
Кристаллические тела могут быть монокристаллическими (mono — "единица") и поликристаллическими (poli — "много").
• Монокристалл — это кристалл, возникающий в результате роста его из одного центра.
В результате упорядоченного расположения частиц монокристалл имеет симметричную геометрическую форму, ограниченную плоскими поверхностями (а). Основное свойство монокристаллов - их анизотропность:

• Анизотропность — это зависимость физических свойств вещества (механических, тепловых, электрических, оптических и др.) от направления. Например, тепловое расширение монокристалла в разных направлениях разное.
Большинство твердых тел, встречающихся в природе и получаемых на производстве, состоит из маленьких беспорядочно ориентированных монокристаллов. Такие твердые тела называются поликристаллами:
• Поликристаллы возникают в результате роста и соединения многочисленных монокристаллов, хаотично ориентированных в пространстве.
Все металлы, можно сказать, поликристаллы. Например, если внимательно посмотреть на свежий разлом чугуна, то видно, что он состоит из многочисленных кристаллических зерен, не имеющих правильную форму и направленных в разные стороны (b). Каждое кристаллическое зерно поликристалла в отдельности - анизотропно, однако, ввиду того, что эти зерна расположены беспорядочно, поликристалл в целом изотропен:
• Изотропностью называется независимость физических свойств от направления. Например, тепловое расширение поликристалла, можно сказать, во всех направлениях одинаково.
Виды кристаллической решетки. В зависимости от вида химической связи и взаимодействия между частицами, расположенными в узлах кристаллической решетки, существуют четыре вида кристаллических решеток. Это металлическая, атомная, ионная и молекулярная кристаллическая решетка.
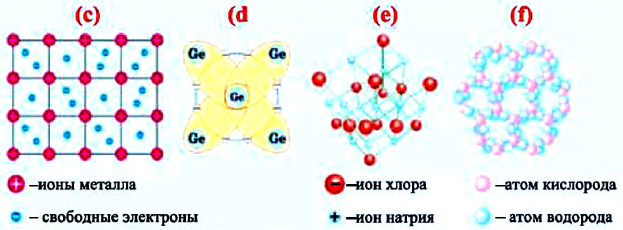
Металлическая решетка. В узлах металлической решетки находятся положительные ионы металла. Такие кристаллы возникают в результате взаимодействия между атомами одного вида металла с очень маленькой энергией ионизации. Внешние валентные электроны в атомах металлов очень слабо связаны с ядром. При переходе в твердое состояние атомы располагаются настолько близко друг к другу, что валентные электроны покидают свой атом и становятся свободными внутри кристалла.
Освобожденные валентные электроны в виде электронного газа беспорядочно движутся между положительными ионами кристаллической решетки и, связывая их, образуют металлическую связь (с). Концентрация свободных электронов в металле равна концентрации ионов.
Атомная решетка. В узлах атомной решетки находятся нейтральные атомы. Ковалентная связь между атомами возникает за счет электронной пары их валентных электронов. Ковалентная связь характерна для кристаллов 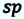 элементов. Как пример таких кристаллов можно привести кремний, германий и другие. Атомы этих элементов на внешнем электронном уровне имеют четыре валентных электрона. Каждый электрон такого атома образует ковалентную связь с одним из электронов соседнего атома, в результате образуются четыре ковалентные связи. Таким образом, атом, присоединив к себе четыре электрона, приобретает устойчивую электронную конфигурацию восьмиэлектронного инертного газа
элементов. Как пример таких кристаллов можно привести кремний, германий и другие. Атомы этих элементов на внешнем электронном уровне имеют четыре валентных электрона. Каждый электрон такого атома образует ковалентную связь с одним из электронов соседнего атома, в результате образуются четыре ковалентные связи. Таким образом, атом, присоединив к себе четыре электрона, приобретает устойчивую электронную конфигурацию восьмиэлектронного инертного газа 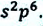 В ковалентной связи движение электронов имеет направленный характер, то есть каждый электрон движется вокруг ядер четырех атомов (d).
В ковалентной связи движение электронов имеет направленный характер, то есть каждый электрон движется вокруг ядер четырех атомов (d).
Ионная решетка. В узлах ионной решетки находятся положительные и отрицательные ионы. Ионная связь возникает из-за обмена электронами в результате взаимодействия двух разных атомов с малой и большой энергией ионизации. Кулоновская сила притяжения между ионами противоположных знаков удерживает их в узлах кристаллической решетки. Как образец такого вида вещества можно привести кристаллическую решетку соединения водорода с щелочным металлом, например, NaCl (е).
Молекулярная решетка. В узлах молекулярной кристаллической решетки находятся молекулы. Молекулы, располагаясь в определенном порядке, создают друг с другом межмолекулярную связь. Находящиеся в газообразном состоянии водород, хлор, четырехоксидный углерод в твердом состоянии образуют молекулярную решетку. У кристаллов такого типа связь между молекулами очень слабая, поэтому она разрушается при низких температурах, то есть вещество плавится. Это можно ясно видеть на модели кристалла льда (f). Из модели видно, что каждый атом кислорода окружен четырьмя атомами водорода. Атомы водорода играют связывающую роль между атомами кислорода. При нагревании льда его кристаллическая решетка быстро разрушается.
Аморфные тела. Аморфные тела характеризуются отсутствием дальнего порядка в расположении частиц. Так как этот порядок выполняется только для соседних частиц, то говорят, что аморфные тела — это твердые тела, частицы которых обладают ближним порядком расположения. Высококонцентрированные жидкости (вязкие жидкости) можно отнести к твердым аморфным телам.
• Аморфные тела - это твердые тела, частички которых не упорядочены в пространстве, и физические свойства внутри по всем направлениям одинаковы - они изотропны. У аморфных тел нет определенной температуры плавления, то есть по мере нагревания они смягчаются и превращаются в жидкость.
Вещества могут переходить из аморфного состояния в кристаллическое и обратно. Например, если сначала расплавить кристалл сахара, а затем охладить его, он превращается в аморфный леденец ("стеклянную" конфету). С течением времени на поверхности леденца снова начинают возникать кристаллы сахара.
Плавление и отвердевание, сублимация и десублимация.
• Процесс перехода вещества из твердого состояния в жидкое называется плавлением, а процесс перехода из жидкого состояния в твердое — отвердеванием, или кристаллизацией.
Плавление кристаллического тела происходит при определенной температуре — температуре плавления, например, температура плавления вольфрама 3410°С, льда 0°С, ртути - 39°С.
• Температура, при которой данный кристалл плавится, называется температурой плавления, или точкой плавления.
Опыты показывают, что для плавления тела не достаточно нагреть его до температуры плавления, а необходимо продолжать передачу количества теплоты. Однако несмотря на нагревание, температура плавящегося кристалла не увеличивается. Только после того, как кристалл полностью расплавится, передаваемое ему количество теплоты приводит к увеличению температуры полученной жидкости (g). Участок АВ графика плавления кристаллического тела соответствует нагреванию твердого тела до температуры плавления; участок ВС графика соответствует процессу плавления, в это время тело находится как в твердом, так и жидком состоянии; участок CD графика соответствует процессу нагревания жидкости (см: g). Согласно закону сохранения энергии, отвердевание данной жидкости происходит при той же температуре, при которой твердое тело плавится (h).
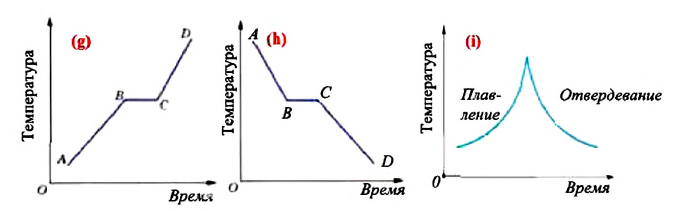
Так как для аморфных тел отсутствует определенная температура плавления и отвердевания, то их графики зависимости температуры от времени для процесса плавления и отвердевания отличаются от соответствующих графиков кристаллических тел (i).
• Количество теплоты, необходимое для перехода тела из твердого состояния в жидкое при температуре плавления, называется теплотой плавления.
Чтобы перевести одинаковые массы разных веществ, нагретых до их температур плавления, в жидкое состояние, необходимо сообщить каждому из них различное количество теплоты.
• Удельная теплота плавления - это физическая величина, показывающая, какое количество теплоты необходимо сообщить 1 кг кристаллического вещества, чтобы перевести его из твердого состояния в жидкое при температуре плавления:

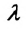 — удельная теплота плавления данного вещества. Единица удельной теплоты плавления в СИ:
— удельная теплота плавления данного вещества. Единица удельной теплоты плавления в СИ: 
Согласно закону сохранения энергии, полученное телом количество теплоты во время плавления равно количеству теплоты, выделяемому при отвердевании этого тела. Иногда твердые тела, минуя жидкое состояние, сразу переходят в газообразное или наоборот, происходит процесс превращения из газообразного состояния сразу в твердое:
• Процесс перехода твердого тела, минуя жидкое состояние, в газообразное состояние называется сублимацией (испарение твердого тела), а обратный процесс перехода газообразного вещества, минуя жидкое состояние, в твердое называется десублимацией.
Строение и свойства твёрдых тел
В повседневной жизни мы считаем твёрдым любое тело, сохраняющее форму и объём в отсутствие внешних воздействий, например, тела, изготовленные из металлов, пластмассы, льда, стекла. Твёрдые тела делят на две группы, различающиеся по своим свойствам: кристаллические и аморфные. Чем же отличаются кристаллические твёрдые тела от аморфных?
Кристаллы. К кристаллическим телам относят минералы, например поваренную соль, медный купорос, кварц, квасцы (рис. 40), горный хрусталь и металлы в твёрдом состоянии.

Кристаллы — твёрдые тела, атомы, ионы или молекулы которых совершают тепловые колебания около определённых, упорядоченных в пространстве положений равновесия.
Упорядоченное размещение частиц твёрдого кристаллического тела обусловливает его правильную геометрическую форму, вследствие чего поверхность кристалла образована плоскими гранями (рис. 41).

Частицы кристалла удерживаются на определённом усреднённом расстоянии друг от друга  силами межатомного и межмолекулярного взаимодействий. Несмотря на тепловые колебания, они образуют упорядоченную пространственную структуру. Геометрическим образом этой структуры является кристаллическая решётка. Узлы кристаллической решётки — положения устойчивого равновесия колеблющихся частиц (ионов, атомов или молекул), образующих кристалл.
силами межатомного и межмолекулярного взаимодействий. Несмотря на тепловые колебания, они образуют упорядоченную пространственную структуру. Геометрическим образом этой структуры является кристаллическая решётка. Узлы кристаллической решётки — положения устойчивого равновесия колеблющихся частиц (ионов, атомов или молекул), образующих кристалл.
Основой строения кристалла служит так называемая элементарная кристаллическая ячейка — многогранник наименьших размеров, последовательным переносом без изменения ориентации которого вместе с частицами, находящимися внутри этого многогранника, можно построить весь кристалл.
На рисунках 42 представлены самые простые элементарные ячейки: кубические (а — примитивная, б — объёмно-центрированная, в — гранецентрированная) и гексагональная призма (г).
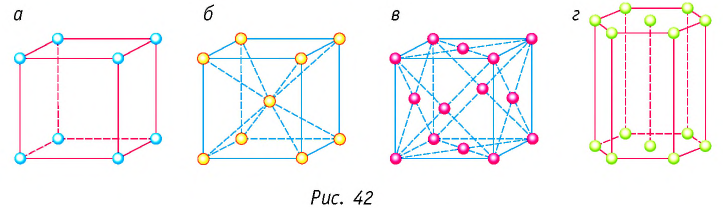
В кристаллических телах упорядоченное размещение частиц повторяется во всём объёме кристалла, поэтому говорят, что в кристалле существует дальний порядок в расположении частиц.
Интересно знать
Чтобы понять, почему в кристаллических телах упорядоченное размещение частиц, проделаем опыт. Насыплем на вогнутое стекло одинаковые маленькие шарики (рис. 43, а) и слегка встряхнём их несколько раз. Можно увидеть, что шарики разместятся в строгом порядке (рис. 43, б). Шарики располагаются на стекле в самом низком из возможных положений, что соответствует минимуму их потенциальной энергии в гравитационном поле Земли.

Кристаллическая структура так же связана с минимумом потенциальной энергии, т. е. при образовании кристаллов частицы самопроизвольно располагаются так, чтобы потенциальная энергия их взаимодействия была минимальной.
Типы кристаллов. В зависимости от вида частиц, образующих кристалл, и от характера сил взаимодействия между ними различают четыре основных типа кристаллов.
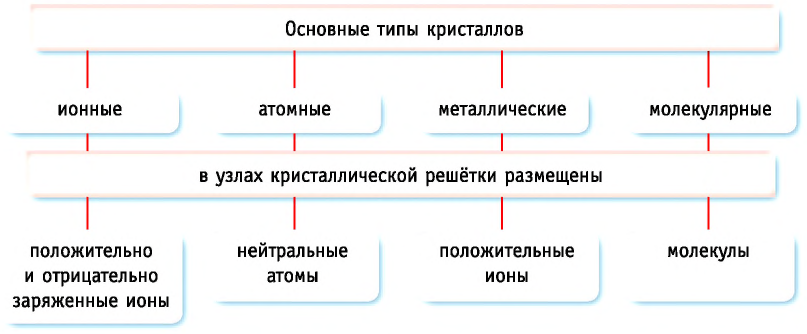
Типичным примером ионного кристалла является кристалл хлорида натрия NaCl (рис. 44, а, б). Кристаллы с ионной решёткой тугоплавки и обладают высокой твёрдостью.
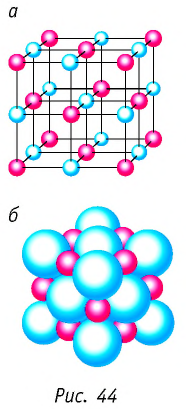
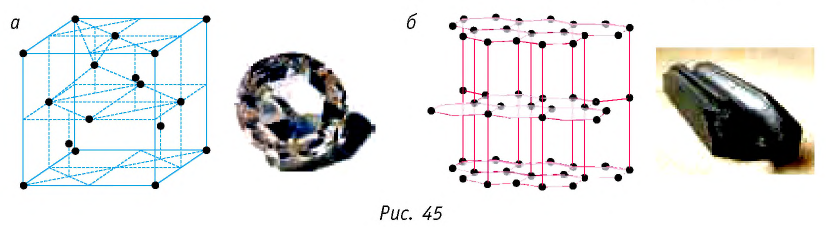
Примерами атомных кристаллов могут служить алмаз и графит. Эти кристаллы тождественны по химической природе (они состоят из атомов углерода), но отличаются по своему строению (рис. 45). В кристаллической решётке алмаза каждый атом углерода находится в центре тетраэдра, вершинами которого служат четыре ближайших атома, и прочно связан с этими атомами посредством объединения валентных электронов (рис. 45, а). Именно такой жёсткой связью и обусловлена уникальная твёрдость алмаза. Кристаллическая решётка графита имеет слоистую структуру (рис. 45, б). Атомные слои графита слабо связаны друг с другом, так как расстояние между ними в несколько раз больше, чем расстояние между соседними атомами в одном слое. Это приводит к тому, что слои могут легко отделяться друг от друга, чем и объясняется мягкость и крохкость графита.
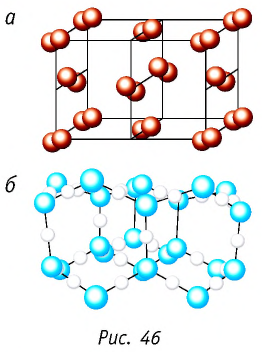
Примерами металлической кристаллической решётки являются полоний Ро (см. рис. 46, а), железо Fe (см. рис. 46, б), серебро Ag (см. рис. 46, в), магний Mg (см. рис. 46, г).
Молекулярные кристаллы образуют большинство простых веществ неметаллов в твёрдом состоянии, например под 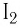 (рис. 46, а), водород
(рис. 46, а), водород 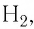 кислород
кислород 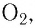 и их соединения друг с другом (лёд
и их соединения друг с другом (лёд 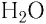 ) (рис. 46, б), а также практически все твёрдые органические вещества.
) (рис. 46, б), а также практически все твёрдые органические вещества.
Монокристаллы и поликристаллы. Существуют одиночные кристаллы, называемые монокристаллами, которые могут иметь довольно большие размеры. Примерами могут служить кристаллы горного хрусталя, размеры которых иногда соизмеримы с ростом человека.
Монокристаллы — твёрдые тела, имеющие во всём объёме единую кристаллическую решётку.
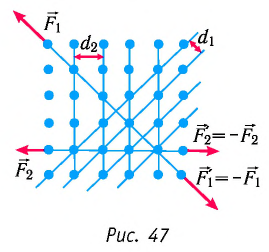
Характерной особенностью монокристаллов является их анизотропия, т. е. зависимость физических свойств (механических, тепловых, электрических, оптических) от направления внутри кристалла. Анизотропия монокристаллов обусловлена различием в плотности расположения частиц в кристаллической решётке по разным направлениям. На рисунке 47 показано, что расстояния между атомными плоскостями в кристалле неодинаковы 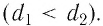 Поэтому, в частности, отличаться будут и силы, необходимые для его разрыва
Поэтому, в частности, отличаться будут и силы, необходимые для его разрыва 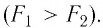 Например, кусок слюды достаточно легко расслоить в одном из направлений на тонкие пластинки, но для того, чтобы разорвать его в направлении, перпендикулярном пластинкам, потребуются гораздо большие усилия.
Например, кусок слюды достаточно легко расслоить в одном из направлений на тонкие пластинки, но для того, чтобы разорвать его в направлении, перпендикулярном пластинкам, потребуются гораздо большие усилия.
Интересно знать
Анизотропия свойственна некоторым материалам биологического происхождения. Например, костным и мышечным тканям человека и животных, древесине и листьям, траве и др.
Большинство кристаллических твёрдых тел являются поликристаллами.
Поликристаллы — твёрдые тела, состоящие из большого числа сросшихся между собой маленьких кристаллов.
В отличие от монокристаллов поликристаллы изотропны, т. е. их свойства одинаковы по всем направлениям. Это следствие того, что поликристалл состоит из большого количества беспорядочно ориентированных маленьких монокристаллов.
Вы сами можете в домашних условиях вырастить монокристаллы (рис. 48, а) и поликристаллы (рис. 48, б) медного купороса (сульфата меди(II) 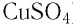 ).
).
Кристаллические тела имеют определённую температуру плавления 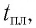 не изменяющуюся в процессе плавления при постоянном давлении. Зависимость температуры кристаллического тела от полученного им количества теплоты представлена на рисунке 49, график 1.
не изменяющуюся в процессе плавления при постоянном давлении. Зависимость температуры кристаллического тела от полученного им количества теплоты представлена на рисунке 49, график 1.
Аморфные тела. К аморфным (от греч. amorphous — бесформенный) телам относят опал, обсидиан, эбонит, сургуч (рис. 50), стекло, различные пластмассы, смолы (вар, канифоль, янтарь) и др.

Аморфное состояние — твёрдое некристаллическое состояние вещества, характеризующееся изотропией свойств и отсутствием определённой температуры плавления.
Зависимость температуры аморфного тела от полученного им количества теплоты представлена на рисунке 49, график 2. При повышении температуры аморфное вещество размягчается и постепенно переходит в жидкое состояние. В аморфном состоянии вещество не имеет строгого порядка в расположении атомов и молекул. Аморфное состояние — бесформенное состояние со слабо выраженной текучестью.
Аморфные тела называют переохлаждёнными жидкостями, так как у них, как и у жидкостей, существует только ближний порядок расположения частиц.
На рисунках 51 схематически представлено строение кристаллического кварца (рис. 51, а) и аморфного кварца (рис. 51, б).
Аморфные тела при определённых условиях могут кристаллизоваться. Сахар-песок является кристаллическим телом (рис. 52, а). Если его расплавить, то, застывая, он превращается в прозрачный стеклообразный леденец (рис. 52, б), который является аморфным телом. Через некоторый промежуток времени леденец «засахаривается», т. е. опять становится кристаллическим.

При скоростях охлаждения, превышающих миллион градусов в секунду, удалось получить аморфные металлические сплавы — стеклообразные металлы. Аморфный металл чрезвычайно твёрд и прочен. Его используют как режущий инструмент. Он обладает сильновыраженными магнитными свойствами, поэтому незаменим при изготовлении магнитных головок для звуко- и видеозаписи. Кроме того, аморфные металлы обладают высокой антикоррозийной стойкостью.
Интересно знать
Стекло обладает текучестью даже при нормальных условиях, хотя и течёт крайне медленно. В старинных зданиях, где окна не меняли достаточно долго, можно заметить постепенное утолщение стёкол книзу.
Строение и свойства твердых тел. Анизотропия кристаллов. Жидкие кристаллы
Большинство веществ на поверхности земли находятся в твердом состоянии. Парта, за которой вы работаете, карандаш, который держите в руке, кости вашей руки и т. д. — это все твердые тела. разговор о том, как расположены молекулы в твердых телах и какими свойствами обладают твердые тела в результате такого расположения.
Аморфные, — значит, не имеющие формы? Так ли это?
Вы уже знаете, что по структуре аморфные тела очень близки к жидкостям. Молекулы, атомы, ионы аморфных тел в целом расположены хаотично, и только внутри небольших локальных групп, содержащих всего несколько частиц, они расположены в определенном порядке (ближний порядок). Физические свойства аморфных тел (теплопроводность, электропроводность, прочность, оптические свойства и т. д.) одинаковы во всех направлениях — аморфные тела изотропны.
Изотропия (от греч. isos — равный и tropos — направление, свойство) — независимость физических свойств от направления, выбранного в теле.
Примерами аморфных тел могут быть стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Аморфные тела определенное время сохраняют свою форму, однако при продолжительном воздействии они текут. Если аморфное тело нагревать, то оно размягчается постепенно и его переход в жидкое состояние занимает значительный интервал температур.
Что такое полиморфизм
В кристаллических телах частицы вещества (атомы, молекулы, ионы) расположены в строго определенном порядке. Если соединить центры положений равновесия частиц кристаллического тела, то получится правильная пространственная решетка, которую называют кристаллической. Доказано, что существует 230 типов кристаллических решеток.
Например, в кристалле полония ионы Полония расположены в вершинах куба, образуя простую кубическую решетку (рис. 34.1, а). Ионы чистого Феррума при комнатной температуре размещены в вершинах куба, кроме того, один ион расположен в центре куба — это объемноцентрированная кубическая решетка (рис. 34.1, б).
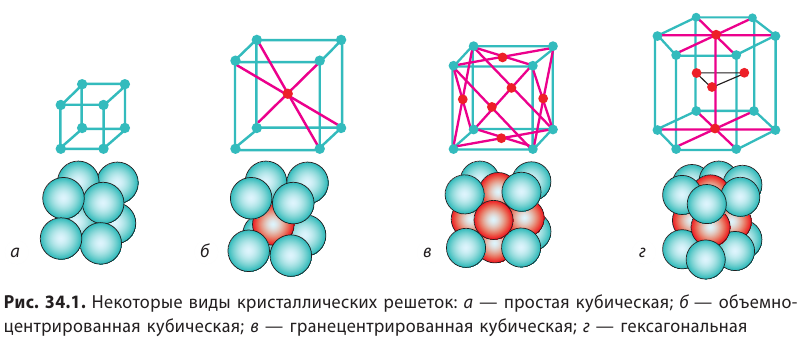
Если нагреть железо до 906 °С, то расположение ионов Феррума резко изменится — решетка перестроится. Центральные ионы сместятся, а в середине каждой грани куба появится дополнительный ион — это гранецентрированная кубическая решетка (рис. 34.1, в). В такой решетке частицы упакованы более плотно, чем в объемноцентрированной. Плотная упаковка наблюдается также в гексагональной решетке (рис. 34.1, г).
Обратите внимание! Частицы в кристаллах плотно упакованы, расстояния между их центрами примерно равны размеру частиц (электронные облака частиц соприкасаются), а вот в изображении кристаллических решеток часто указывают только положения равновесия частиц. Многие кристаллические вещества имеют одинаковый химический состав, однако из-за различной структуры кристаллической решетки отличаются своими физическими свойствами (рис. 34.2).
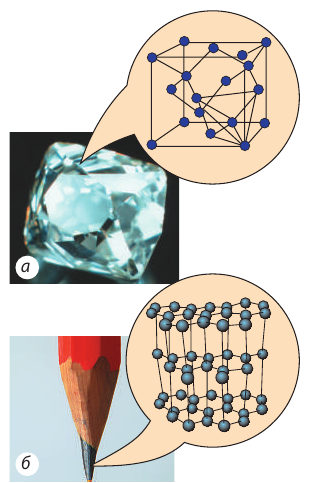
Рис. 34.2. Различные кристаллические состояния углерода: а — алмаз; б — графит
Такое явление называют полиморфизмом, а переход из одной кристаллической структуры в другую — полиморфным переходом.
Например, в производстве искусственных алмазов используют полиморфный переход графита в алмаз. Этот переход происходит при давлениях 60 тыс. — 100 тыс. атмосфер и при температурах 1800–2300 °С. И наоборот: в результате нагревания в вакууме до температуры около 1500 °С алмаз превращается в графит.
Почему монокристаллы анизотропны
Кристаллические тела могут быть монокристаллами и поликристаллами.
Монокристалл — твердое тело, частицы которого образуют единую кристаллическую решетку.
Упорядоченное расположение частиц в монокристалле является причиной того, что монокристаллы имеют плоские грани и постоянные углы между гранями (рис. 34.3); физические свойства монокристаллов зависят от выбранного в них направления.
Зависимость физических свойств кристалла от выбранного в нем направления называют анизотропией (от греч. anisos — неравный и tropos — направление, свойство).

Рис. 34.3. Природные кристаллы: а — лазурит; б — кварц
Так, механическая прочность многих кристаллов различна в разных направлениях: кусок слюды легко расслаивается на тонкие пластины в одном направлении, но его намного сложнее разломать перпендикулярно пластинам.
От направления, выбранного в кристалле, зависят его теплопроводность, электропроводность, прозрачность, линейное расширение и многие другие физические свойства. Анизотропия кристаллов обусловлена их кристаллической решеткой: в разных направлениях расстояния между частицами, образующими кристаллическую решетку, разные (рис. 34.4).
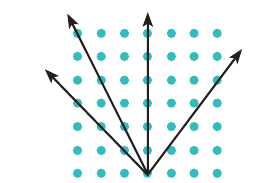
Рис. 34.4. В результате упорядоченного строения кристалла расстояния между его частицами в разных направлениях — разные
Большие монокристаллы встречаются редко. Чаще всего кристаллические твердые тела являются поликристаллическими.
Поликристаллические вещества — это вещества, состоящие из множества сросшихся хаотично ориентированных кристалликов (кристаллитов). В отличие от монокристаллов поликристаллические тела изотропны, то есть их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела легко увидеть с помощью микроскопа. Большинство металлов, используемых человеком, — поликристаллические.
Жидкие кристаллы
Жидкий кристалл — состояние вещества, сочетающее текучесть жидкости и анизотропию кристаллов.
В жидкости частицы в целом расположены хаотически и могут свободно вращаться и перемещаться в любых направлениях; в кристаллическом твердом теле существует трехмерный дальний порядок и частицы могут только колебаться около положений равновесия. В жидком кристалле имеется определенная упорядоченность в расположении молекул (рис. 34.5), однако допускается и некоторая свобода их перемещения. Наиболее часто жидкокристаллическое состояние наблюдается у органических веществ, молекулы которых имеют удлиненную или дискообразную форму.
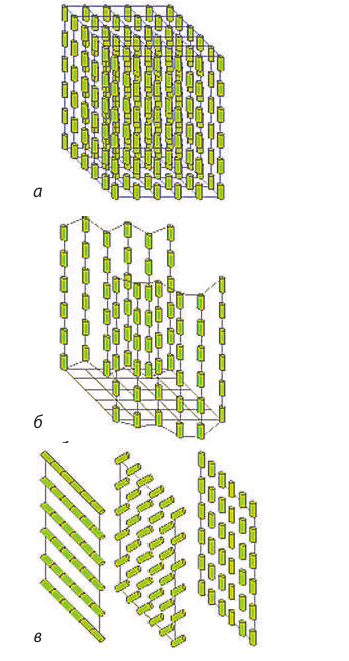
Рис. 34.5. некоторые типы жидких кристаллов: а — смектические (молекулы ориентированы параллельно друг другу и образуют тонкие слои); б — нематические (нитевидные молекулы направлены параллельно друг другу, но могут скользить вверх и вниз); в — холестерические (плоские длинные молекулы собраны в слои, повернутые относительно друг друга)
Зависимость оптических свойств жидких кристаллов от температуры и электрического поля обеспечила их широкое применение в дисплеях часов и калькуляторов, в персональных компьютерах, плоских телевизионных экранах; их используют в медицине (например, как индикаторы температуры) и пр. Так, угол поворота осей молекул в каждом слое холестерического жидкого кристалла зависит от температуры, а от угла поворота зависит окраска кристалла, поэтому если тонкую полимерную пленку с микрополостями, заполненными холестериком, наложить на тело, то получится цветное отображение распределения температуры.
Механические свойства твердых тел
— Нужен совет! Прогнулась балка межэтажного перекрытия...
— Вам, пожалуй, не советы и подсказки надо искать, а нормального техника-строителя, и срочно... (Из разговора в Интернете) Девушка пострадала, сорвавшись со жгута банджи-джампинга. Работа аттракциона приостановлена. (Из новостей) Разумеется, мы можем жить в доме, не имея представления о материалах, из которых он построен; можем прыгать с моста или самолета, не представляя, какова прочность жгута или строп парашюта. Но невозможно построить надежный дом, создать безопасный аттракцион без знаний механических свойств используемых материалов.
Какие существуют виды деформации
Напомним: деформация — это изменение формы и (или) размеров тела. Если после прекращения действия внешних сил тело полностью восстановило свои форму и размеры, то оно испытало упругую деформацию; если форма и размеры не восстановились, тело подверглось пластической деформации. Когда тело деформируется, отдельные его части смещаются друг относительно друга. По характеру смещения частей различают деформации растяжения (сжатия), изгиба, сдвига, кручения (см. таблицу).
| Виды деформаций | |
|---|---|
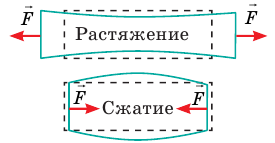 |
Силы, приложенные к телу, пытаются вытянуть или сжать тело, вследствие чего расстояние между слоями молекул увеличивается (деформация растяжения) или уменьшается (деформация сжатия). |
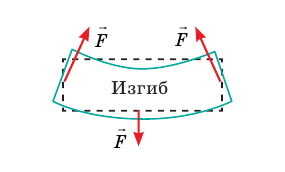 |
Силы, приложенные к телу, пытаются искривить (выгнуть) тело. Деформация изгиба — это одновременно деформация растяжения и деформации сжатия: выпуклая часть тела подвергается деформации растяжения (расстояние между слоями молекул увеличивается); вогнутая часть — деформации сжатия (расстояние между слоями молекул уменьшается). |
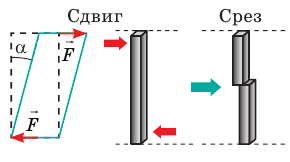 |
Силы, приложенные к телу, направлены противоположно друг другу и сдвигают слои тела друг относительно друга. Деформацию сдвига испытывают, например, гвозди и болты, скрепляющие части различных конструкций; ткань, которую разрезают ножницами. Сдвиг на большие углы a может привести к разрушению тела — срезу. |
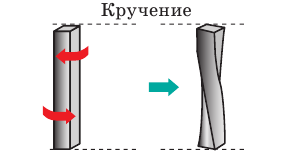 |
Силы, приложенные к телу, создают вращательный момент относительно продольной оси тела. Смещение слоев молекул происходит неодинаково — каждый слой поворачивается на определенный угол относительно другого слоя. Деформацию кручения испытывают валы всех машин, винты, ключи, отвертки и т. д. |
Что такое механическое напряжение
Когда тело деформируется, его состояние изменяется: в любом сечении тела возникают силы упругости, препятствующие разрушению; чем больше деформация, тем больше силы упругости. Состояние деформированного тела характеризуется механическим напряжением.
Механическое напряжение σ — физическая величина, которая характеризует деформированное тело и равна отношению модуля силы упругости 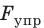 к площади S поперечного сечения тела:
к площади S поперечного сечения тела:
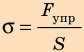
Единица механического напряжения в СИ — паскаль: [σ] = 1 Па = 1 Н/м2 (1 Pa = 1 N/m2).
Установлено, что механическое напряжение зависит от относительного удлинения тела.
Относительное удлинение ε тела — физическая величина, равная отношению удлинения ∆l к исходной длине 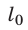 тела:
тела:
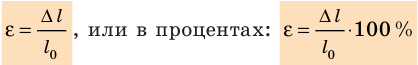
Анализируем диаграмму напряжений
Зависимость механического напряжения от относительного удлинения устанавливают экспериментально. Образец растягивают с помощью специальной машины, постепенно увеличивая нагрузку, и строят диаграмму напряжений — график зависимости механического напряжения от относительного удлинения образца (рис. 35.2).
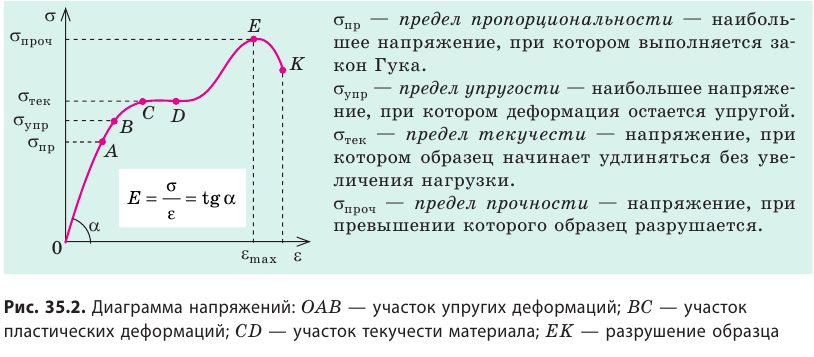
Опыты показывают, что при небольших деформациях (участок ОА графика) справедлив закон Гука:
При малых упругих деформациях растяжения и сжатия механическое напряжение σ прямо пропорционально относительному удлинению ε:
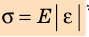
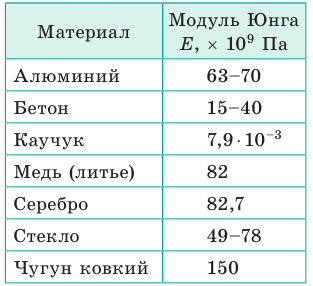
Коэффициент пропорциональности Е называют модулем Юнга или модулем упругости. Модуль Юнга характеризует упругие свойства материала, его определяют по диаграмме напряжений (см. рис. 35.2) и фиксируют в таблицах.
Единица модуля Юнга в СИ — паскаль: [E]=1 Па (Pa).
Модули Юнга для некоторых материалов
Изменится ли прочность
Когда стержень подвергается деформации изгиба, его средняя часть (часть около оси) не испытывает ни растяжения, ни сжатия. То есть, если ее удалить, то прочность конструкции на изгиб почти не изменится. Поэтому, например, раму велосипеда, которая преимущественно подвергается деформации изгиба, изготовляют из тонких полых металлических трубок, благодаря чему велосипед достаточно легок и остается при этом прочным. О подобной прочности «конструкций», легкости и экономии «материала» позаботилась и природа — она наделила человека и животных трубчатыми костями конечностей, а злаки — трубчатыми стеблями.


Вернемся к рис. 35.2. Как только нагрузка станет такой, что механическое напряжение в образце достигнет предела пропорциональности σпр , зависимость σ (ε) становится нелинейной (участок AB графика), однако если снять нагрузку, то образец восстановит свои форму и размеры, то есть участок ОАВ диаграммы напряжений — это участок упругих деформаций.
Если увеличивать нагрузку дальше, деформация начинает быстро возрастать и становится пластической (участок BC), а после достижения предела текучести 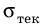 образец некоторое время удлиняется даже без увеличения нагрузки (участок CD). Если нагрузку снова увеличить, образец еще немного удлинится (участок DE), напряжение в нем достигнет предела прочности
образец некоторое время удлиняется даже без увеличения нагрузки (участок CD). Если нагрузку снова увеличить, образец еще немного удлинится (участок DE), напряжение в нем достигнет предела прочности 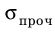 , после чего образец разорвется.
, после чего образец разорвется.
Упругость, пластичность, хрупкость
Согнем стальную линейку, а затем отпустим ее — линейка полностью восстановит свою форму. А вот свинцовая пластинка так и останется согнутой. Если же попробовать согнуть пластинку из стекла, то стекло сломается даже при незначительной деформации. В зависимости от «реакции» материала на деформацию различают упругие, пластические, хрупкие материалы.
| Упругие материалы | Пластические материалы | Хрупкие материалы |
|---|---|---|
| Материалы, проявляющие упругие свойства при сравнительно больших деформациях или достаточно длительном воздействии | Материалы, в которых упругая деформация переходит в пластическую при незначительных деформациях | Материалы, которые разрушаются при очень малых деформациях и почти не проявляют пластических свойств |
Деление материалов на упругие, пластические и хрупкие условно, ведь свойства материалов существенно зависят от влажности, температуры, скорости увеличения нагрузки и т. п. Так, свинец, являющийся пластическим при нормальных условиях, становится упругим при температуре –100 °С, упругая резина при низких температурах становится хрупкой. Глина является хрупкой в сухом состоянии и пластической — во влажном. Битум при медленном увеличении нагрузки обнаруживает пластические свойства, а при быстром увеличении нагрузки становится хрупким.
Пример №94
С вертолета, зависшего на некоторой высоте, спускают стальной трос. Какой может быть максимальная длина троса, чтобы он не оборвался под собственным весом? Предел прочности стали — 320 МПа.
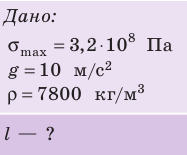
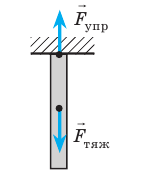
Анализ физической проблемы. Выполним пояснительный рисунок. Сила упругости в любом сечении троса уравновешивает силу тяжести, которая действует на часть троса, расположенную ниже этого сечения. Очевидно, что при отсутствии дефектов трос разорвется в самом верхнем сечении.
Решение:
Трос находится в состоянии покоя, поэтому 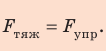

Итак, имеем: 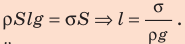
Плотность стали найдем в таблице плотностей. Проверим единицу, найдем значение искомой величины:
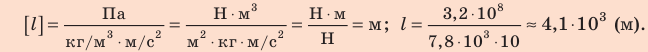
Анализ результата. Наибольшая возможная длина троса — 4,1 км. Поскольку реальные тросы имеют в десятки и сотни раз меньшую длину, они не смогут оборваться под действием собственного веса.
Ответ: l = 4 1, км.
Выводы:
- Деформация — изменение формы и (или) размеров тела. Деформация упругая, если после прекращения действия внешних сил тело восстанавливает свои форму и размеры; деформация пластическая, если форма и размеры тела не восстанавливаются. Различают также деформации сжатия (растяжения), сдвига, изгиба, кручения.
- Физическую величину, которая характеризует деформированное тело и равна отношению модуля силы упругости
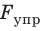 к площади S поперечного сечения тела, называют механическим напряжением σ:
к площади S поперечного сечения тела, называют механическим напряжением σ: 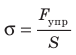 .
. - Закон Гука: для малых упругих деформаций растяжения и сжатия механическое напряжение прямо пропорционально относительному удлинению ε: σ = Eε, где Е — модуль Юнга (модуль упругости), который характеризует упругие свойства вещества. Наибольшее напряжение, при котором выполняется закон Гука, называют пределом пропорциональности
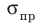 .
.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |