
Спирты в химии - свойства, формула, получение, номенклатура и определение с примерами
Содержание:
Спирты:
Углеводороды образуют различные функциональные производные при замещении в молекуле одного или нескольких атомов водорода на функциональную группу 
Спирты и фенолы относятся к монофункциональным гидроксилпроизвод-ным углеводородов.
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу —ОН.
Классификация спиртов
В зависимости от числа гидроксильных групп в молекуле спирты подразделяют на одноатомные, двухатомные, трехатомные, четырехатомные и т. д. (рис. 42). Например:
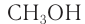
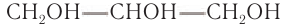 — трехатомный спирт.
— трехатомный спирт.
Спирты, содержащие несколько гидроксильных групп, объединяют общим названием многоатомные спирты.
В зависимости от строения углеродного скелета различают спирты насыщенные, ненасыщенные, ароматические (рис. 43).
Насыщенные спирты — производные алканов, например 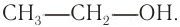 Ненасыщенные спирты — производные ненасыщенных углеводородов, в молекулах которых содержатся кратные (двойные и тройные) связи между атомами углерода, например
Ненасыщенные спирты — производные ненасыщенных углеводородов, в молекулах которых содержатся кратные (двойные и тройные) связи между атомами углерода, например 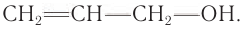
Некоторые одноатомные ненасыщенные спирты, содержащиеся в винограде, из которого производят вина, определяют характерный аромат ряда мускатных вин и рислингов. В процессе старения этих вин одноатомные спирты превращаются в двухатомные. По концентрации образовавшегося двухатомного спирта можно судить о степени старения вина.
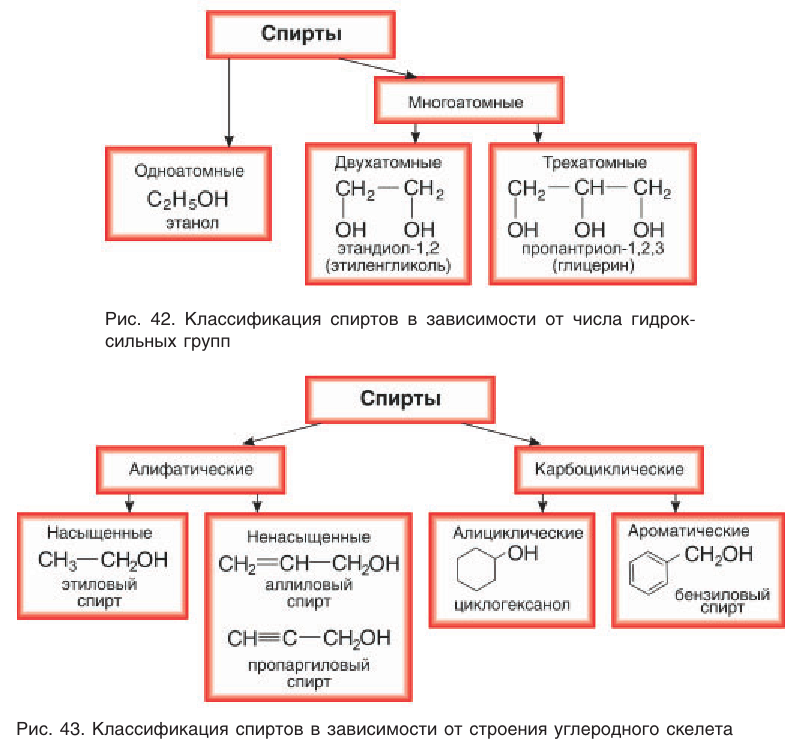
К ароматическим относят спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, которые связаны друг с другом через атом углерода, например:
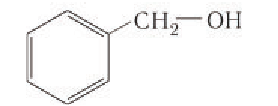
Если в молекулах органических соединений гидроксильные группы связаны непосредственно с атомом углерода бензольного кольца, например:
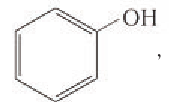
то такие соединения относят к другому классу органических соединений фенолам.
В лепестках розы (рис. 44) содержится ароматический фенилэтиловый спирт, формула которого 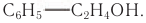 Он является одним из основных компонентов розового масла и применяется в парфюмерии.
Он является одним из основных компонентов розового масла и применяется в парфюмерии.

В зависимости от типа атома углерода, с которым связана гидроксильная группа, спирты классифицируют как первичные, вторичные, третичные.
Гидроксильная группа в молекулах первичных спиртов связана с первичным атомом углерода, в молекулах вторичных спиртов — с вторичным атомом углерода и в молекулах третичных спиртов — с третичным атомом углерода. Например:
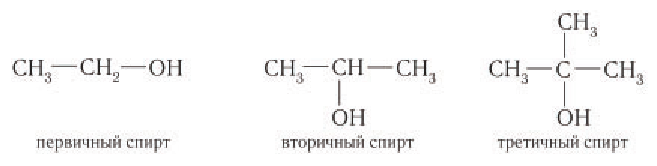
Спирты — производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу —ОН.
Спирты различают по числу гидроксильных групп (атомность спиртов), строению углеродного скелета, типу атома углерода, связанного с гидроксильной группой.
Насыщенные одноатомные спирты
Строение: Насыщенными одноатомными спиртами называют производные алканов, в молекулах которых один атом водорода замещен на гидроксильную группу и содержатся только  -связи.
-связи.
В органической химии известно большое число насыщенных одноатомных спиртов, химический состав и строение которых выражается общей формулой 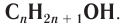 В общем виде формула насыщенных одноатомных спиртов записывается
В общем виде формула насыщенных одноатомных спиртов записывается 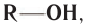 где R — алкильная группа.
где R — алкильная группа.
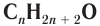 — общая формула, отражающая молекулярный состав насыщенных одноатомных спиртов.
— общая формула, отражающая молекулярный состав насыщенных одноатомных спиртов.
Простейшим представителем данного класса спиртов является метанол 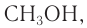 молекулярная, структурная и электронная формулы которого:
молекулярная, структурная и электронная формулы которого:
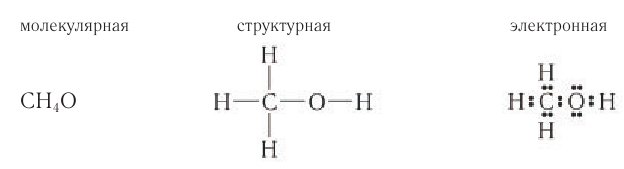
Шаростержневая и масштабная модели молекулы метанола представлены на рисунке 45.
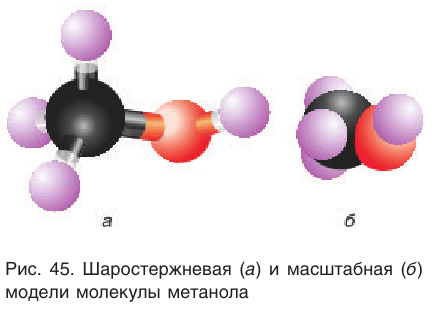
Так как электронное строение алканов и соответствующих им алкильных групп вами уже изучено, то при изучении спиртов — производных алканов — будет рассматриваться только электронное строение функциональной группы спиртов  Именно эта группа определяет важнейшие химические и физические свойства спиртов.
Именно эта группа определяет важнейшие химические и физические свойства спиртов.
В состав функциональной группы спиртов входит атом кислорода, который обладает большой электроотрицательностью и в силу этого оттягивает к себе электронную плотность  -связей связанных с ним атомов водорода и углерода:
-связей связанных с ним атомов водорода и углерода: 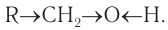 По этой причине атом кислорода приобретает частичный отрицательный заряд, а атомы водорода и углерода — частичные положительные заряды:
По этой причине атом кислорода приобретает частичный отрицательный заряд, а атомы водорода и углерода — частичные положительные заряды: 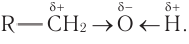 Связи
Связи 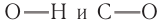 полярны. Валентный угол СОН близок к 110°.
полярны. Валентный угол СОН близок к 110°.
Номенклатура: По правилам номенклатуры ИЮПАК, названия насыщенных одноатомных спиртов образуются от названий соответствующих алканов с добавлением суффикса -ол. Например, 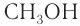 — метанол,
— метанол, 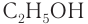 — этанол.
— этанол.
Систематическая номенклатура допускает употребление названий, связанных с названием алкильных групп, для низших членов ряда. Например,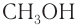 — метиловый спирт,
— метиловый спирт, 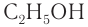 — этиловый спирт.
— этиловый спирт.
В таблице 22 приведены названия первых десяти представителей гомологического ряда спиртов, у которых функциональная группа —ОН находится у первичного атома углерода, по номенклатуре ИЮПАК и тривиальные.
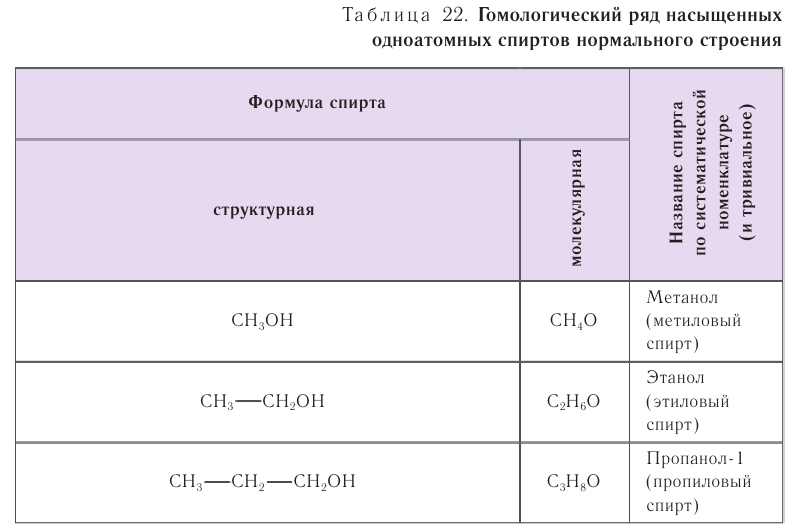
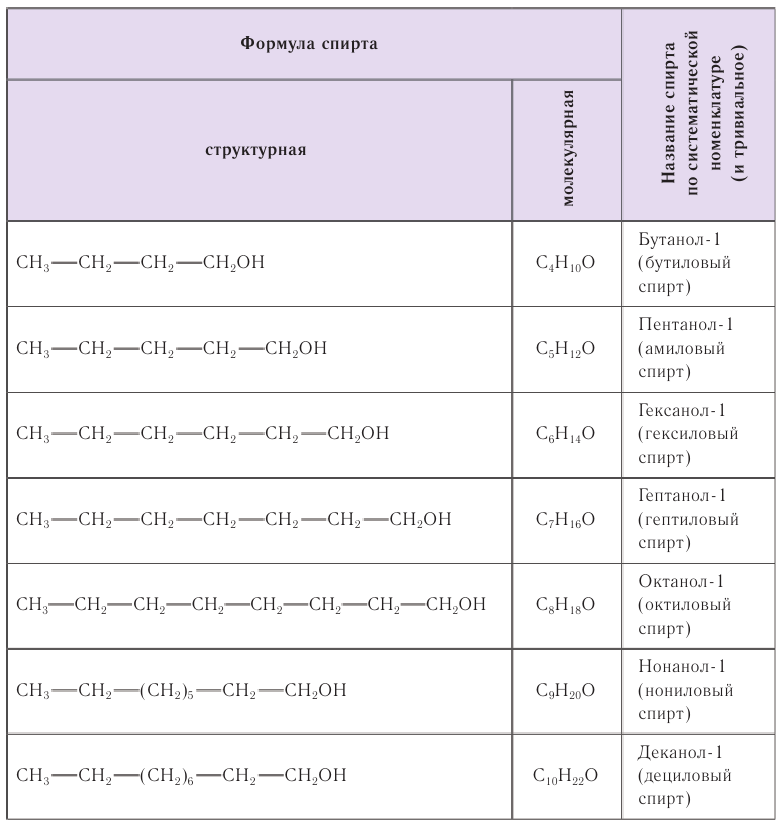
При названии спиртов с неразветвленной углеродной цепью, начиная с пропанола, цифрой указывается атом углерода, с которым связана гидроксильная группа. Нумерация углеродных атомов начинается с того конца, ближе к которому расположена гидроксильная группа. Названия спиртов образуют, добавляя суффикс -ол к названию соответствующего алкана, цифрой указывается положение гидроксильной группы в цепи. Например:
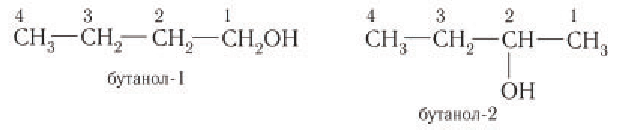
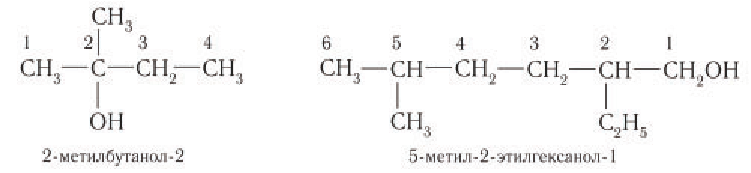
Для названий спиртов с разветвленной углеродной цепью выбирают самую длинную цепь, содержащую функциональную гидроксильную группу, и нумеруют с того конца, ближе к которому расположена гидроксильная группа. Названия спиртов образуют, добавляя суффикс -ол к назанию алкана, соответствующего самой длинной цепи, цифрой указываются атомы углерода, с которыми связана гидроксильная группа и заместители. Названия заместителей перечисляются в алфавитном порядке. Например:
Изомерия: Для насыщенных одноатомных спиртов характерна структурная изомерия. Структурная изомерия спиртов обусловлена изомерией углеродного скелета и изомерией положения гидроксильной группы. Первые два члена гомологического ряда — метанол 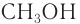 и этанол
и этанол 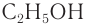 — не имеют изомеров спиртов. Начиная с пропанола, число структурных изомеров в гомологическом ряду спиртов быстро возрастает. Например, бутанолы существуют в виде четырех изомеров, гептанолы — восьми, а деканолы — пятисот семидесяти шести.
— не имеют изомеров спиртов. Начиная с пропанола, число структурных изомеров в гомологическом ряду спиртов быстро возрастает. Например, бутанолы существуют в виде четырех изомеров, гептанолы — восьми, а деканолы — пятисот семидесяти шести.
Рассмотрим примеры изомеров спиртов состава 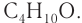 В зависимости от строения углеродного скелета изомерами будут два спирта — производные бутана и 2-метилпропана:
В зависимости от строения углеродного скелета изомерами будут два спирта — производные бутана и 2-метилпропана:
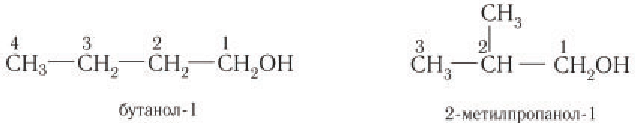
В зависимости от положения гидроксильной группы при том и другом углеродном скелете возможны еще два изомерных спирта:
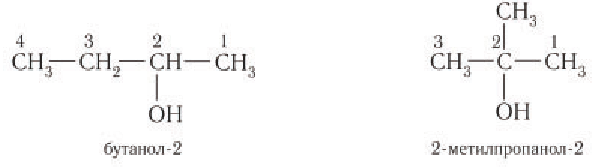
Общее число структурных изомеров спиртов состава 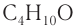 (за исключением стереоизомеров) равно четырем.
(за исключением стереоизомеров) равно четырем.
Физические свойства: Первые представители класса насыщенных одноатомных спиртов 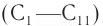 при комнатной температуре — жидкости. Высшие спирты (начиная с
при комнатной температуре — жидкости. Высшие спирты (начиная с 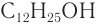 ) при комнатной температуре — твердые вещества. Следовательно, среди спиртов данного класса при нормальных условиях отсутствуют газообразные вещества.
) при комнатной температуре — твердые вещества. Следовательно, среди спиртов данного класса при нормальных условиях отсутствуют газообразные вещества.
Низшие спирты обладают характерным алкогольным запахом, запах спиртов, стоящих в середине гомологического ряда, сильный и часто неприятный, а высшие спирты (более 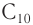 ) практически не имеют запаха.
) практически не имеют запаха.
Низшие спирты ( ) смешиваются с водой в любых соотношениях, средние — ограниченно. Следовательно, с увеличением относительной молекулярной массы растворимость спиртов в воде падает. В большинстве же органических растворителей все спирты растворимы.
) смешиваются с водой в любых соотношениях, средние — ограниченно. Следовательно, с увеличением относительной молекулярной массы растворимость спиртов в воде падает. В большинстве же органических растворителей все спирты растворимы.
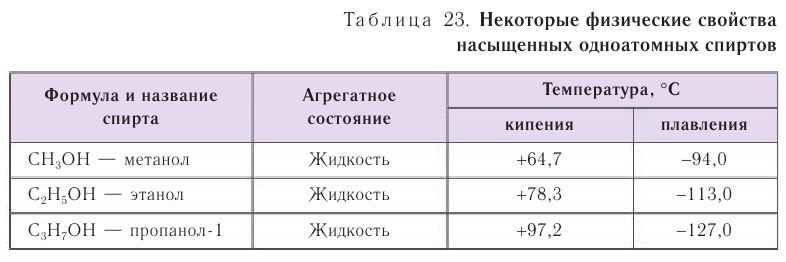
Спирты обладают аномально высокими температурами кипения по сравнению с представителями алканов с приблизительно такой же относительной молекулярной массой. Например, температура кипения этанола 78,3 °С, а пропана -42,2 °С. В таблице 23 приводятся температуры кипения, плавления и агрегатное состояние некоторых спиртов.
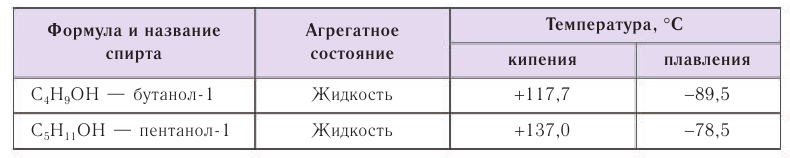
Причиной отсутствия газообразных спиртов при нормальных условиях, а также более высоких температур кипения спиртов по сравнению с алканами с одинаковой относительной молекулярной массой являются межмолекулярные водородные связи, характерные для спиртов. Как отмечалось, связь  в молекуле спирта сильно поляризована:
в молекуле спирта сильно поляризована: 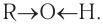 На атоме водорода возникает частичный положительный заряд. В силу этого такой атом водорода может притягиваться неподеленной парой электронов атома кислорода другой молекулы спирта. Между молекулами спирта возникает межмолекулярная водородная связь. Таким образом, молекулы спиртов находятся в ассоциированном состоянии, как бы с увеличенной относительной молекулярной массой. Несмотря на то что энергии межмолекулярных водородных связей спиртов невелики, водородные связи обусловливают значительную ассоциацию молекул спиртов, что и ведет к росту теплоты испарения, а следовательно, и температуры кипения. Графически водородную связь принято обозначать тремя точками. Схема образования водородной связи между молекулами спирта показана на рисунке 46, а.
На атоме водорода возникает частичный положительный заряд. В силу этого такой атом водорода может притягиваться неподеленной парой электронов атома кислорода другой молекулы спирта. Между молекулами спирта возникает межмолекулярная водородная связь. Таким образом, молекулы спиртов находятся в ассоциированном состоянии, как бы с увеличенной относительной молекулярной массой. Несмотря на то что энергии межмолекулярных водородных связей спиртов невелики, водородные связи обусловливают значительную ассоциацию молекул спиртов, что и ведет к росту теплоты испарения, а следовательно, и температуры кипения. Графически водородную связь принято обозначать тремя точками. Схема образования водородной связи между молекулами спирта показана на рисунке 46, а.
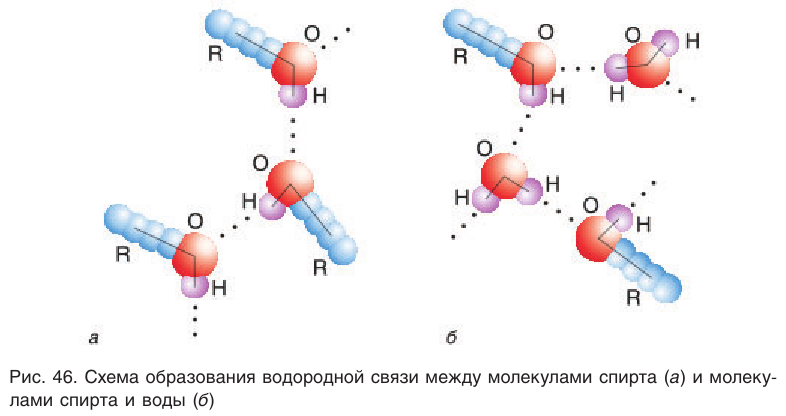
Образованием межмолекулярных водородных связей между молекулами спиртов и полярными молекулами воды (рис. 46, б) объясняется хорошая растворимость низших спиртов, в отличие от углеводородов, которые из-за малой полярности связей С—Н не образуют с водой водородных связей. С увеличением длины цепи алкильных групп растворимость спиртов понижается, и октанол уже не смешивается с водой.
Насыщенными одноатомными спиртами называют производные алканов, в молекулах которых один атом водорода замещен на гидроксильную группу.
Общая формула насыщенных одноатомных спиртов 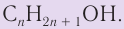
Структурная изомерия спиртов обусловлена строением углеродного скелета и различным положением гидроксильной группы при одинаковой углеродной цепи.
На физические свойства спиртов большое влияние оказывает водородная связь между молекулами спиртов или молекулами спиртов и воды в их растворах.
Химические свойства спиртов
Характерные реакции спиртов определяются наличием в составе их молекул гидроксильиой группы, атом кислорода которой смещает электронную плотность как от атома водорода, так и от атома углерода. Такая поляризация может способствовать разрыву связей 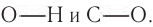 . Атом водорода в гидроксильной группе за счет сильной поляризации связи
. Атом водорода в гидроксильной группе за счет сильной поляризации связи 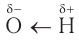 становится более подвижным, способным отщепляться в виде протона. В этом случае спирты проявляют кислотные свойства. В то же время наличие в молекуле спирта атома кислорода, имеющего две неподеленные пары электронов, обусловливает проявление спиртами свойств оснований. Следовательно, спирты можно рассматривать как амфотерные соединения, которые могут проявлять как свойства кислот, так и свойства оснований. Спирты являются слабыми кислотами и в то же время основаниями средней силы.
становится более подвижным, способным отщепляться в виде протона. В этом случае спирты проявляют кислотные свойства. В то же время наличие в молекуле спирта атома кислорода, имеющего две неподеленные пары электронов, обусловливает проявление спиртами свойств оснований. Следовательно, спирты можно рассматривать как амфотерные соединения, которые могут проявлять как свойства кислот, так и свойства оснований. Спирты являются слабыми кислотами и в то же время основаниями средней силы.

Рассмотрим важнейшие химические свойства спиртов на примере алифатических насыщенных одноатомных спиртов.
Взаимодействие со щелочными металлами: При взаимодействии щелочных металлов 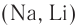 со спиртами (рис. 47) происходит разрыв
со спиртами (рис. 47) происходит разрыв  и замещение атомов водорода на атомы металла с образованием соединений алкоксидов (алкоголятов) и водорода:
и замещение атомов водорода на атомы металла с образованием соединений алкоксидов (алкоголятов) и водорода:
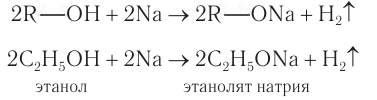
Спирты — очень слабые электролиты, слабее даже, чем вода. Поэтому алкокеиды (алкоголяты) легко разлагаются водой:
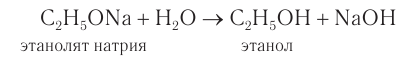
При взаимодействии с металлами у спиртов проявляются кислотные свойства, но к классу кислот спирты не относят, так как степень их диссоциации незначительна. Поэтому спирты с водными растворами щелочей взаимодействуют обратимо.
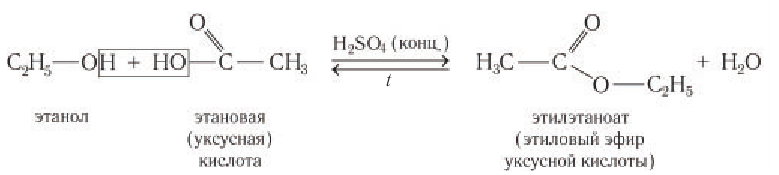
Взаимодействие с карбоновыми и кислородсодержащими минеральными кислотами с образованием сложных эфиров.
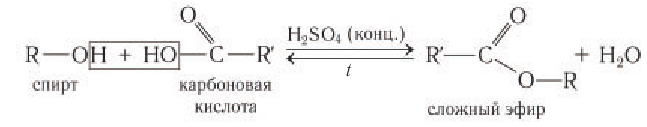
В реакции с карбоновыми кислотами от молекулы спирта отщепляется атом водорода, а от молекулы карбоновой кислоты — гидроксильная группа с образованием молекулы воды. Реакция обратима, но равновесие смещается вправо в присутствии концентрированной серной кислоты и при выводе воды из зоны реакции:
В реакциях с кислородсодержащими минеральными кислотами спирты образуют сложные эфиры этих кислот:
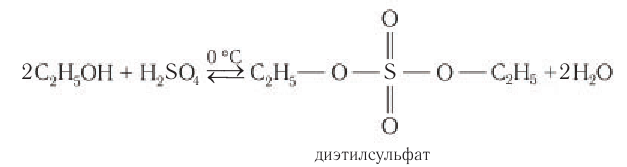
Взаимодействие с галогеноводородами с образованием галогеналканов
В реакции с галогеноводородами в молекуле спирта происходит разрыв связи 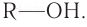 В результате реакции образуется галогеналкан. Уравнение реакции в общем виде выглядит так:
В результате реакции образуется галогеналкан. Уравнение реакции в общем виде выглядит так:
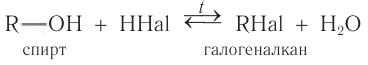
Данная реакция обратима. В этой реакции проявляются слабые основные свойства спирта.
При взаимодействии этанола с бромоводородом образуется бромэтан — тяжелая жидкость:
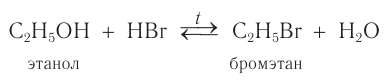
Внутримолекулярная дегидратация с образованием алкена
Первичные спирты дегидратируются под действием катализатора — концентрированной серной кислоты — при высоких температурах (выше 140 °С) с образованием алкена:
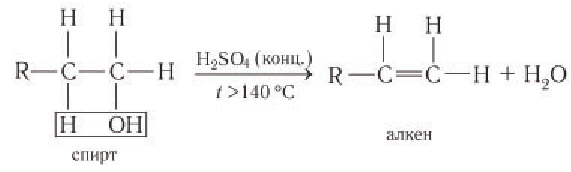
Реакция дегидратации обусловлена отщеплением водорода в виде протона и гидроксильной группы от соседних атомов углерода.
Например, в результате внутримолекулярного отщепления молекулы воды от молекулы этанола (под действием катализатора — концентрированной серной кислоты) образуется этен:
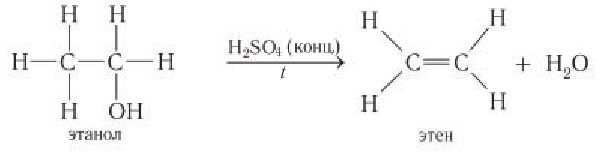
Реакции окисления
Спирты горят на воздухе или в кислороде некоптящим пламенем с выделением большого количества теплоты (рис. 48):
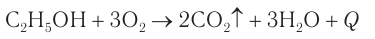

С более слабым, чем кислород, окислителем, например с оксидом меди(II), происходит частичное окисление спиртов, при этом первичные спирты окисляются до альдегидов.
Если в пробирку с этанолом опустить раскаленную скрученную в спираль медную проволоку, покрытую черным налетом оксида меди(II), то черный налет на проволоке исчезает. Спираль приобретает розово-красный цвет, при этом чувствуется неприятный запах образовавшегося альдегида:
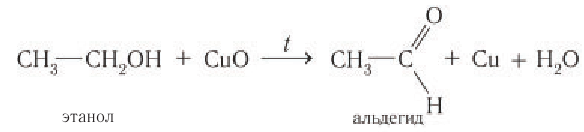
Под действием таких окислителей, как подкисленный раствор перманганата калия или дихромата калия, первичные спирты окисляются до карбоновых кислот.
Кислотно-основные свойства насыщенных одноатомных спиртов обусловлены наличием в их молекулах функциональной гидроксильной группы.
Спирты взаимодействуют со щелочными металлами, галогеноводородами, карбоновыми и минеральными кислотами; вступают в реакции дегидратации и окисления.
Получение и применение спиртов
Получение: Для промышленного получения спиртов используют ненасыщенные углеводороды, извлекаемые из нефтепродуктов, или галогеналканы.
Познакомимся с основными общими промышленными и лабораторными способами получения насыщенных одноатомных спиртов и специфическими способами получения этанола и метанола.
1) Одним из наиболее важных общих промышленных способов получения спиртов является гидратация алкенов.
Этанол получают гидратацией этена водяными парами при повышенной температуре (280—300 °С), повышенном давлении (7—8 мПа) и в присутствии катализатора 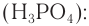
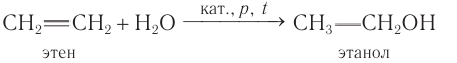
Спирт, полученный из этена, называют синтетическим.
2) В пищевой промышленности этанол получают характерным только для него способом при спиртовом брожении глюкозы под действием ферментов, выделяемых некоторыми видами дрожжевых грибков:
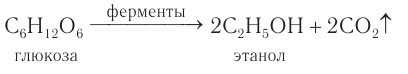
Брожению подвергают виноградный сок, содержащий глюкозу, а также картофельный крахмал, который превращается в глюкозу под действием особого фермента. Этанол, полученный при ферментативном расщеплении различных пищевых продуктов, используют в основном для изготовления спиртных напитков.
В промышленности этанол производят гидролизным способом из древесных опилок, отходов целлюлозно-бумажной промышленности и т. д. Содержащуюся в древесине целлюлозу подвергают гидролизу с образованием глюкозы, которую далее подвергают брожению, и получают этанол, называемый гидролизным спиртом.
3) В промышленности метанол получают характерным только для него способом при взаимодействии водорода с угарным газом (СО) при повышенном давлении и высокой температуре в присутствии катализатора:
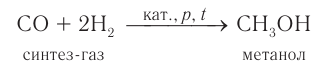
Смесь угарного газа и водорода, взятых в количественном соотношении 1 : 2, называют синтез-газом.
Историческое название метанола — древесный спирт. Оно указывает на старый способ получения спирта — сухую перегонку древесины твердых пород дерева (нагревание древесины без доступа воздуха).
Для получения спиртов в лаборатории используют галогеналканы.
При гидролизе моногалогеналканов с галогеном при первичном атоме углерода в водных растворах щелочей при нагревании образуются первичные спирты:
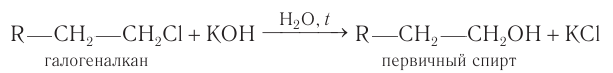
Гидролиз галогеналканов, проводимый в присутствии щелочи, является практически необратимым процессом и используется как общий метод получения первичных насыщенных спиртов в лаборатории.
Применение: Спирты находят широкое применение. В химической промышленности спирты — исходные вещества для разнообразных синтезов. Во многих производствах спирты применяют в качестве растворителей. Рассмотрим несколько примеров промышленного использования важнейших насыщенных одноатомных спиртов.
Метанол (метиловый спирт) 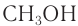 используется в промышленном органическом синтезе при получении формальдегида, применяемого в производстве пластмасс, для синтеза некоторых лекарственных веществ.
используется в промышленном органическом синтезе при получении формальдегида, применяемого в производстве пластмасс, для синтеза некоторых лекарственных веществ.
Метанол — прекрасный растворитель для многих органических и неорганических веществ.
Необходимо знать, что метанол — сильнейший яд. Употребление даже нескольких граммов метанола приводит к слепоте, а затем и смерти. Вот поэтому на банках, в которых хранится этот спирт, используемый для технических нужд, имеется надпись: «Метанол — яд». Это должно служить серьезным предостережением при работе с ним.
Этанол (этиловый спирт) 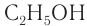 используется во многих отраслях промышленности: лакокрасочной, фармацевтической, взрывчатых веществ, бытовой химии, кондитерской и т. д. (рис. 49).
используется во многих отраслях промышленности: лакокрасочной, фармацевтической, взрывчатых веществ, бытовой химии, кондитерской и т. д. (рис. 49).
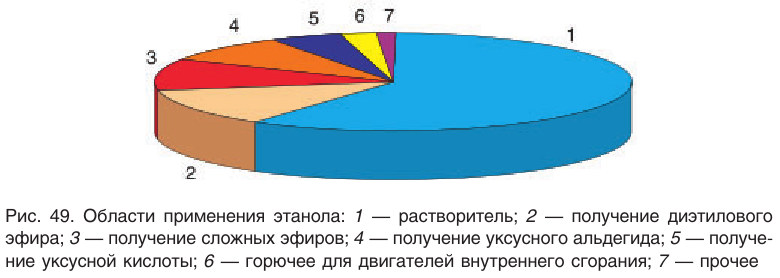
Этанол является исходным веществом в промышленном органическом синтезе (диэтиловый эфир, этилацетат и другие эфиры и т. д.), окислением этанола получают пищевую уксусную кислоту.
Спирт-ректификат, получаемый в промышленности, представляет собой смесь этанола (массовая доля 95,6 %) и воды (массовая доля 4,4 %). Безводный спирт называют абсолютным спиртом.
Следует помнить, что этанол — своего рода наркотик, возбуждающе действующий на организм человека. Даже небольшие дозы снижают остроту зрения, замедляют реакции и уменьшают способность здраво рассуждать. Длительное употребление спирта вызывает тяжелые заболевания нервной и сердечно-сосудистой систем, разрушение печени и приводит к преждевременной смерти.
В этанол, применяемый для технических целей, специально добавляют небольшие количества трудноотделяемых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатуратом. Употребление денатурата смертельно опасно.
Другие (низшие) спирты используются в качестве растворителей при изготовлении различных лаков и красок на предприятиях лакокрасочной промышленности, одним из которых является ОАО «Лакокраска» в Лиде.
Высшие спирты (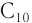 и более) используют во многих областях производства. Например, спирты состава
и более) используют во многих областях производства. Например, спирты состава 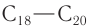 используются для изготовления медицинских препаратов,
используются для изготовления медицинских препаратов,  — парфюмерно-косметической продукции,
— парфюмерно-косметической продукции,  — антикоррозийной смазки.
— антикоррозийной смазки.
Ненасыщенный аллиловый спирт 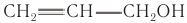 применяется в производстве глицерина, аллиловых эфиров, использующихся в фармацевтической и парфюмерной промышленности.
применяется в производстве глицерина, аллиловых эфиров, использующихся в фармацевтической и парфюмерной промышленности.
В промышленном масштабе этанол получают гидратацией этена, гидролизным способом, в процессе спиртового брожения глюкозы.
Метанол в промышленных масштабах в основном получают из синтез-газа.
В лаборатории первичные насыщенные одноатомные спирты получают в процессе щелочного гидролиза моногалогеналканов.
Спирты используют для синтеза многих органических веществ.
Решение расчетных задач
В параграфе рассмотрены образцы решения задач таких типов, как расчеты по химическим уравнениям, если одно из реагирующих веществ взято в избытке, и определение молекулярных формул органических веществ на основании качественного и количественного состава.
Пример 1.
Определите массу бромэтана, полученного в реакции, для которой был взят этанол массой 5,98 г и бромоводород объемом (н. у.) 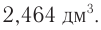
Решение
1. Общие формулы, используемые при расчетах:
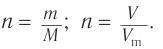
2. Значения молярных масс веществ, молярный объем:
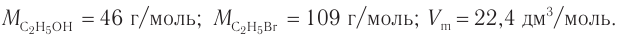
3. Определяем химические количества спирта и бромоводорода, взятых для реакции:
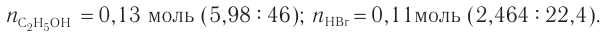
4. На основе анализа уравнения реакции определяем, какое из веществ взято в избытке, а затем рассчитываем химическое количество и массу продукта реакции:
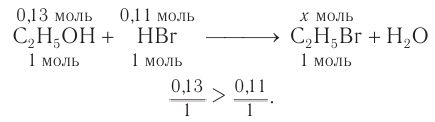
Следовательно, спирт взят в избытке. Расчеты продукта реакции проводятся исходя из данных о химическом количестве хлороводорода:
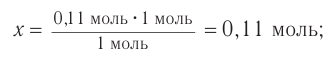
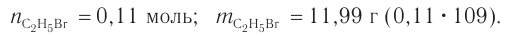
Ответ: 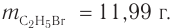
Пример 2.
Массовая доля углерода в насыщенном одноатомном спирте равна 0,6. Определите молекулярную формулу спирта. Составьте структурные формулы возможных изомеров и назовите их по номенклатуре ИЮПАК.
Решение
1. Для решения задачи используем общую формулу 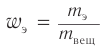 и общую формулу насыщенных одноатомных спиртов
и общую формулу насыщенных одноатомных спиртов 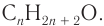 Расчеты проводим, исходя из массы углерода в спирте химическим количеством 1 моль и массы спирта химическим количеством 1 моль.
Расчеты проводим, исходя из массы углерода в спирте химическим количеством 1 моль и массы спирта химическим количеством 1 моль.
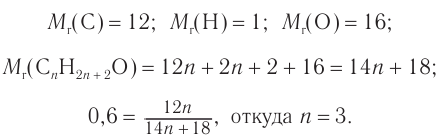
2. Определяем формулу искомого спирта.
Общая формула 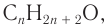 следовательно, при
следовательно, при 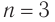 молекулярная формула спирта —
молекулярная формула спирта — 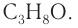
Изомеры:
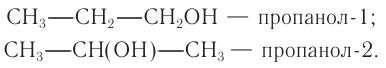
Ответ: 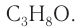
Пример 3.
В результате ряда последовательных реакций из алкана массой 69,6 г получен первичный насыщенный одноатомный спирт массой 88,8 г с тем же числом атомов углерода в молекуле, что и у алкана (алкан  галогеналкан
галогеналкан  насыщенный одноатомный спирт). Определите молекулярную формулу спирта и составьте формулы структурных изомеров.
насыщенный одноатомный спирт). Определите молекулярную формулу спирта и составьте формулы структурных изомеров.
Решение
1. Из алкана химическим количеством 1 моль получают спирт химическим количеством 1 моль:
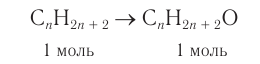
2. Разница масс взятого и полученного веществ равна 19,2 г (88,8 - 69,6). Разница молярных масс спирта и алкана равна 16, что хорошо видно при анализе общих формул алканов и насыщенных одноатомных спиртов:
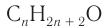 — общая формула насыщенных одноатомных спиртов;
— общая формула насыщенных одноатомных спиртов;
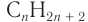 — общая формула алканов.
— общая формула алканов.
3. Используя общую формулу 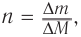 определяем химическое количество полученного спирта:
определяем химическое количество полученного спирта:
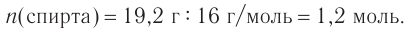
4. Зная химическое количество и массу спирта, определяем его молярную массу и молекулярную формулу:
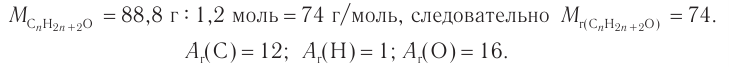
Решая уравнение 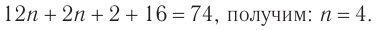
Следовательно, молекулярная формула спирта — 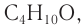 а структурные формулы возможных изомеров:
а структурные формулы возможных изомеров:
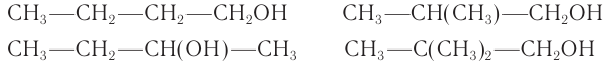
Ответ: 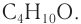
Пример 4.
При гидратации алкена массой 22,68 г получили вторичный насыщенный одноатомный спирт массой 32,40 г. Определите молекулярную формулу спирта, составьте структурную формулу и назовите спирт по номенклатуре ИЮПАК.
Решение
1. Анализ уравнения реакции гидратации, записанного в общем виде, показывает, что для гидратации алкена химическим количеством 1 моль требуется вода химическим количеством 1 моль. Следовательно, разница масс алкена и спирта и есть масса присоединенной воды:
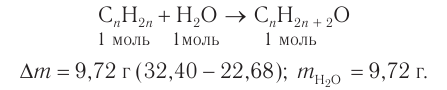
2. Определяем химическое количество воды и спирта, далее молярную массу и молекулярную формулу спирта:
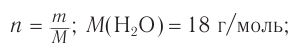
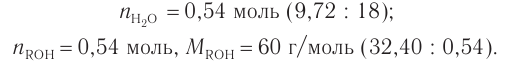
Следовательно, 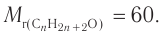
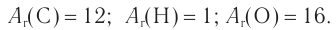
Решая уравнение 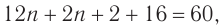 получим:
получим: 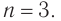
Молекулярная формула спирта — 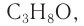 структурная формула —
структурная формула — 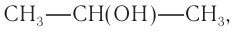 пропанол-2.
пропанол-2.
Ответ: 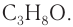
Пример 5.
Определите молекулярную формулу органического вещества, относительная плотность паров которого по гелию равна 22, если при сгорании его массой 19,36 г образовались углекислый газ объемом (н. у.) 2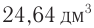 и вода массой 23,76 г.
и вода массой 23,76 г.
Решение
1. Определяем молярную массу неизвестного вещества, его химическое количество, а также химические количества образовавшихся оксида углерода (IV) и воды:
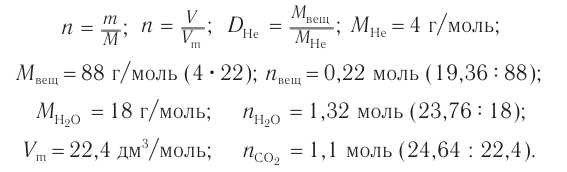
2. Проанализируем схему реакции горения вещества, предположив, что сожгли углеводород химическим количеством 1 моль. На основе данных о продуктах реакции рассчитаем количественный состав вещества:
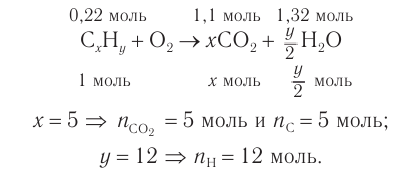
Формула вещества — 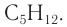
3. Молярная масса вещества 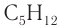 равна 72 г/моль, а молярная масса искомого вещества — 88 г/моль, разница молярных масс — 16 г/моль. Следовательно, в состав неизвестного вещества входил атомарный кислород химическим количеством 1 моль. Молекулярная формула вещества —
равна 72 г/моль, а молярная масса искомого вещества — 88 г/моль, разница молярных масс — 16 г/моль. Следовательно, в состав неизвестного вещества входил атомарный кислород химическим количеством 1 моль. Молекулярная формула вещества — 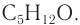
Ответ: 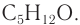
Многоатомные спирты
Строение: Производные углеводородов, в молекулах которых два и более атомов водорода у соседних атомов углерода замещены на гидроксильные группы, называют многоатомными спиртами.
Гидроксильные группы во всех устойчивых многоатомных спиртах связаны с соседними атомами углерода.
Простейшим представителем двухатомных спиртов (гликолей) является этиленгликоль, структурная формула которого:
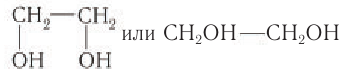
Шаростержневая модель молекулы этиленгликоля приведена на рисунке 50, а.
Простейшим представителем трехатомных спиртов (глицеринов) является глицерин (от греч. glykeros — сладкий), структурная формула которого:
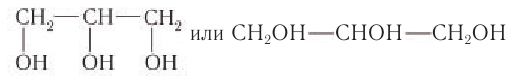
Шаростержневая модель молекулы глицерина приведена на рисунке 50, б.
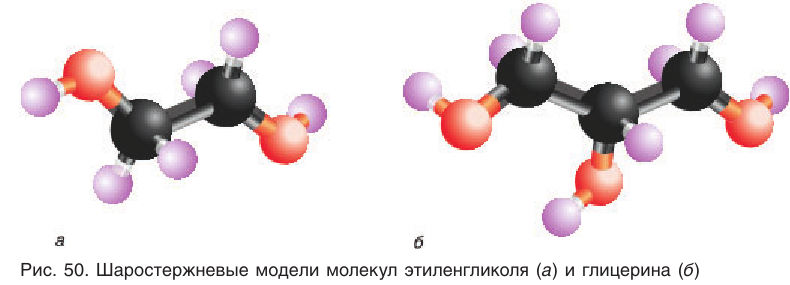
На примере этих двух спиртов вы познакомитесь с основными характеристиками многоатомных спиртов.
Номенклатура: По номенклатуре ИЮНАК двухатомный спирт  и трехатомный спирт
и трехатомный спирт 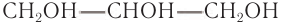 называют этанциол-1,2 и про-яянтриол-1,2,3. Правилами ИЮПАК допускаются названия этиленгликоль и глицерин.
называют этанциол-1,2 и про-яянтриол-1,2,3. Правилами ИЮПАК допускаются названия этиленгликоль и глицерин.
Физические свойства: Этиленгликоль и глицерин — бесцветные вязкие жидкости, тяжелее воды, неограниченно растворимы в воде, хорошо растворяются в этаноле. Эти свойства присущи и другим многоатомным спиртам.
Этиленгликоль ядовит, его водные растворы не кристаллизуются при низких температурах, что позволяет применять его как компонент незамерзающих жидкостей — антифризов. Глицерин имеет сладковатый вкус, гигроскопичен, нелетуч.
Впервые глицерин был получен из оливкового масла шведским химиком и фармацевтом К. Шееле в 1783 г.
Хорошая растворимость этиленгликоля и глицерина в воде объясняется наличием межмолекулярных водородных связей между молекулами спиртов и воды. Число таких связей больше, чем у одноатомных спиртов, из-за большего числа гидроксильных групп в молекулах.
Температуры кипения этих спиртов по сравнению с одноатомными спиртами с таким же числом атомов угелерода в молекуле намного выше:
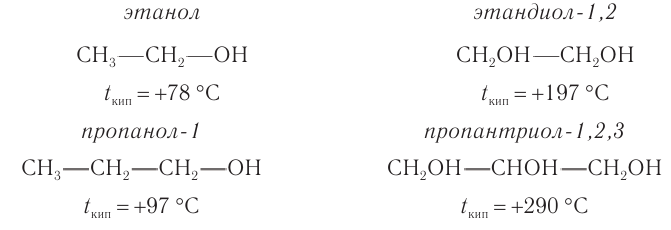
Причиной более высоких температур кипения многоатомных спиртов является большее число межмолекулярных водородных связей между молекулами спиртов за счет большего числа гидроксильных групп в составе молекул.
Химические свойства: Для этиленгликоля и глицерина характерны все реакции одноатомных спиртов, обусловленные наличием функциональной группы —ОН, и особые свойства, обусловленные одновременным присутствием в молекуле нескольких гидроксильных групп.
1) Взаимодействие со щелочными металлами. Многоатомные спирты реагируют с активными металлами с образованием соединений, которые по аналогии с алкоголятами называют гликолятами и глицератами. Названия «гликоляты» и «глицераты» допускаются в номенклатуре ИЮНАК.
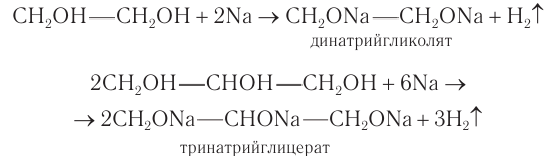
В реакциях могут участвовать одна или более гидроксильных групп. Многоатомные спирты, как и одноатомные, проявляют кислотные свойства в реакциях со щелочными металлами.
2) Взаимодействие с основаниями. В отличие от одноатомных спиртов, этиленгликоль и глицерин реагируют не только со щелочными металлами, но и с нерастворимыми гидроксидами тяжелых металлов. Такие реакции возможны для многоатомных спиртов, потому что из-за взаимного влияния гидроксильных групп в молекуле их кислотность выше, чем у одноатомных спиртов.

Если в стакан с раствором щелочи добавить несколько капель раствора сульфата меди(II) и к образовавшемуся гидроксиду меди(II) прилить многоатомный спирт, например глицерин, то образуется прозрачный раствор ярко-синего цвета (рис. 51). Цвет раствора обусловлен образованием комплексного соединения меди.
Реакция со свежеприготовленным гидроксидом меди(II) является качественной реакцией на многоатомные спирты с гидроксильными группами, находящимися у соседних атомов углерода. Из-за сложности строения образовавшегося глицерата меди уравнение реакции не приводится.
3) Образование сложных эфиров. Для многоатомных спиртов, как и для одноатомных, характерно образование сложных эфиров при взаимодействии с кислородсодержащими минеральными кислотами и карбоновыми кислотами. В частности, в реакции глицерина с избытком азотной кислоты в присутствии каталитических количеств серной кислоты образуется глицеринтринитрат, известный под названием нитроглицерин:
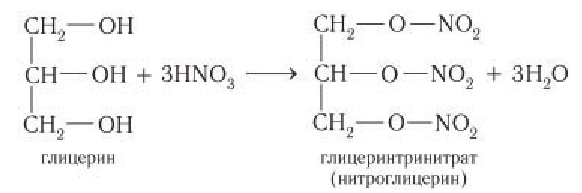
Название «нитроглицерин» относится к тривиальным названиям, оно не отражает строение вещества. Известно, что в химии к нитросоединениям относят вещества, в которых группа — непосредственно связана с атомом углерода.
непосредственно связана с атомом углерода.
Реакцию глицерина с карбоновыми кислотами е образованием сложных эфиров вы будете рассматривать при изучении темы «Жиры».
Получение: Двухатомные и трехатомные спирты можно получать теми же способами, что и одноатомные спирты. В качестве исходных веществ используются алкены и галогеналканы.
Лабораторные способы: Общим способом получения гликолей является окисление алкенов раствором перманганата калия в слабощелочной или нейтральной среде:
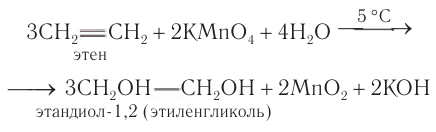
Этиленмиколь также получают гидролизом соответствующего дигалогеналкана:
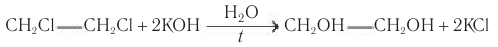
Промышленные способы. Глицерин получают в процессе гидролиза жиров и синтетическим способом из пропена, образующегося при крекинге нефтепродуктов.
Этиленгликоль в промышленных масштабах получают гидратацией эпоксида 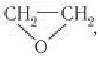 который получают при окислении этилена в присутствии катализатора — серебра:
который получают при окислении этилена в присутствии катализатора — серебра:
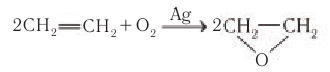
Применение: Этиленгликоль используют для синтеза полимерных материалов, синтетических волокон, например лавсана; в качестве антифризов (от анти — против и англ. freeze — морозить, замерзать) — жидкостей, добавляемых в воду, чтобы понизить температуру замерзания. Антифризы заливаются в системы охлаждения, в частности автомобильных двигателей. Температура замерзания антифриза с объемной долей этиленгликоля 52,5 % равна -40 °С. Этиленгликоль применяют для получения пластификаторов (смягчителей), используемых в лакокрасочной промышленности.
Применение глицерина основано на его гигроскопичности. Его используют для приготовления мазей, в кожевенном производстве — для предохранения кож от высыхания, в текстильной промышленности — для отделки тканей с целью придания им мягкости и эластичности и др. Глицерин применяют при изготовлении косметики, где он играет роль смягчающего и успокаивающего средства; как добавку к зубной пасте, клеям, чтобы предохранить их от быстрого высыхания; для приготовления антифризов.
Незамерзание клеточной жидкости иногда объясняют усиленной выработкой глицерина в растительных клетках.
Большое количество глицерина идет на получение нитроглицерина, который служит сырьем при производстве бездымных порохов и динамита.
Нитроглицерин токсичен, но в малых дозах используется как лечебное средство, так как расширяет кровеносные сосуды сердечной мышцы и тем самым улучшает кровоснабжение сердца.
Многоатомными спиртами называют производные углеводородов, в молекулах которых содержится несколько гидроксильных групп, связанных с соседними атомами углерода.
Многоатомные спирты взаимодействуют с активными металлами, щелочами, гидроксидами тяжелых металлов, кислородсодержащими неорганическими кислотами и карбоновыми кислотами.
Реакция с гидроксидом меди(II) используется для качественного обнаружения многоатомных спиртов.
Этиленгликоль применяют для получения синтетического волокна лавсан, в качестве антифриза; глицерин используется во многих отраслях промышленности.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |