
Состав и строение веществ в химии - формулы и определения с примерами
Содержание:
Состав и строение веществ:
Из предыдущих тем мы узнали, что все существующие в природе живые существа и неживые предметы, т.е. физические тела, состоят из веществ. В таком случае, давайте подумаем. Если тела состоят из веществ, то из чего же состоят сами вещества?

Обратите внимание на картинки. Как вы думаете, из атомов какого химического элемента состоят золотое кольцо и уголь?
Еще примерно 2500 лет назад до н.э. учёными были выдвинуты различные идеи о составе веществ. Как считал древнегреческий учёный Демокрит, тела состоят из невидимых глазу мельчайших частиц - «атомов».
Атом и молекула
Атом - это мельчайшая, химически неделимая частица вещества.
Молекула - это мельчайшая частица, сохраняющая в себе химические свойства и состав вещества.
В середине XVIII века русским учёным М.В. Ломоносовым и, спустя 50 лет, в 1803-ем году английским ученым Джоном Дальтоном была составлена первая таблица относительных атомных масс ряда химических элементов. Их идеи сыграли огромную роль в развитии атомно-молекулярного учения. Ими были выдвинуты более убедительные, веские идеи об образовании веществ из молекул и атомов, свойствах этих частиц.
Впервые термин «атом» был выдвинут Демокритом. Данное слово означает «неделимый».

По имени английского ученого Дальтона проблема, связанная со зрением,была названа дальтонизмом. В 1 794-ом году он описал эту болезнь, от которой страдал и сам ученый.

Древнегреческий философ Демокрит является одним из ученых-основоположников атомной теории.
В 1860-ом году была заложена основа «Атомно-молекулярного учения». Основными положениями атомно-молекулярного учения являются следующие:
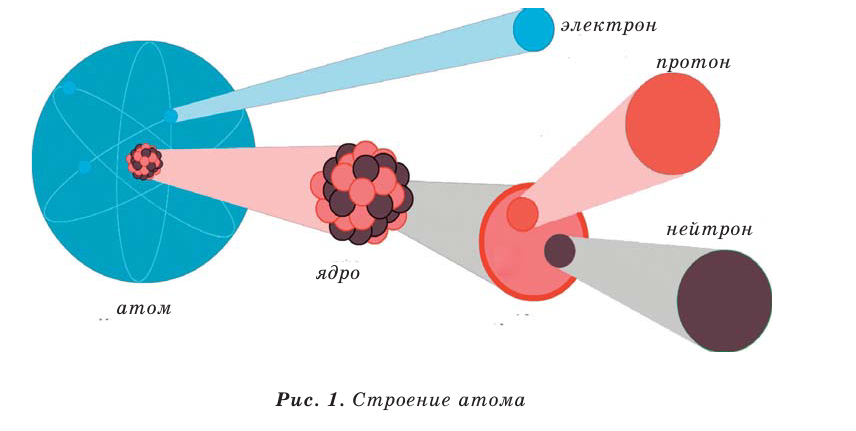
Вещества состоят из молекул, а молекулы - из более мелких частиц - атомов (рис. 1).
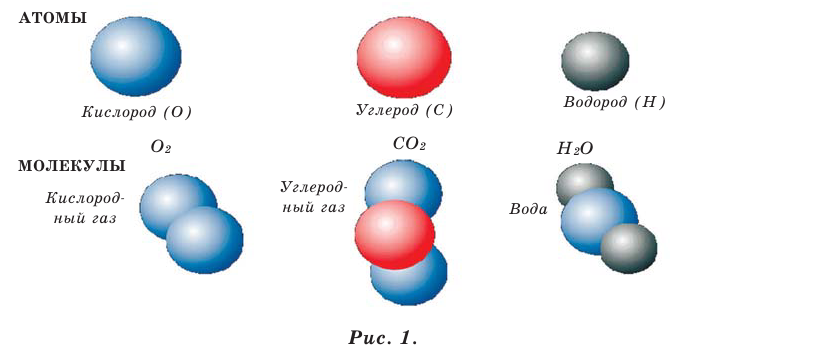
- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния и температуры вещества (рис. 2).

- Молекулы находятся в непрерывном движении, скорость движения молекул прямо пропорциональна температуре. То есть с повышением температуры увеличивается и скорость движения молекул.
- Между молекулами существуют силы взаимного притяжения и отталкивания.
- Молекулы состоят из атомов; атомы тоже, как и молекулы, находятся в непрерывном движении.
- Один вид атома отличается от другого вида атома своими массой и свойствами.
- При физических явлениях молекулы остаются в неизменном виде, однако при химических превращениях они распадаются, а атомы не распадаются.
Молекулы являются мельчайшими частицами многих веществ, их состав и химические свойства аналогичны самим веществам.
Самые большие вакуумы бывают между молекулами газа. Это объясняется их лёгкой сжимаемостью. Жидкости сжимаются с трудом. Между их молекулами расстояние сравнительно малое. Меньше всего расстояния между молекулами твёрдых веществ, вот почему они не сжимаются.
Только ли из молекул и атомов состоят вещества? Последующие научные поиски показали, что вещества могут состоять не только из молекул и атомов, являющихся незаряженными и нейтральными частицами, но также из положительно и отрицательно заряженных частиц - ионов. Например, поваренная соль, сода, известняк и др. являются такими веществами (более подробные сведения об этом вы получите в VIII классе). Вещества, состоящие из молекул, называются веществами молекулярного строения
(рис. 3 а), а из атомов и ионов - условно относят к веществам немолекулярного строения (рис. 3 б, в, г).
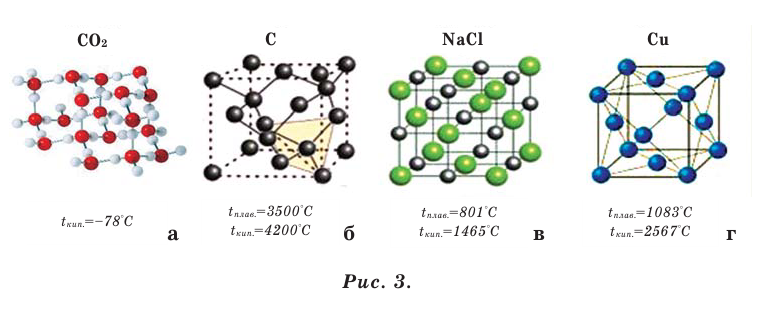
Вещества молекулярного и немолекулярного строения отличаются друг от друга по своим свойствам. Вещества молекулярного строения в обычных условиях — это газы (кислород, азот, водород, углекислый газ и др.) или жидкости (вода, спирт, ацетон и др.), а также легкоплавкие твёрдые вещества (кристаллическая сера, белый фосфор, сахар, иод и др.). Все же вещества немолекулярного строения - это тугоплавкие твёрдые вещества (алмаз, графит, песок, поваренная соль, сода и др.).
Состав атома
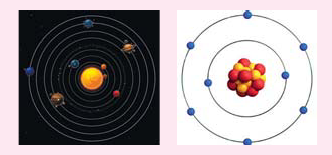
Сравните рисунки. Каковы схожие и отличительные черты между движением электронов вокруг ядра и движением планет вокруг Солнца? Из каких частиц состоит атом?
Начиная от существующих во вселенной гигантских звёзд до веществ в составе клетки, все они состоят из мельчайших частиц - атомов.
Вплоть до конца XIX века атом считался мельчайшей (микро) неделимой частицей вещества. Насколько мельчайшими частицами являются атомы, можно представить себе посредством следующего сравнения. Если увеличить яблоко до размеров земного шара, то увеличенный во столько же раз атом станет величиной с яблоко. Диаметр атомов составляет 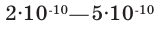 м. Это означает, что в толщине каждой страницы книги могут уместиться сотни тысяч атомов.
м. Это означает, что в толщине каждой страницы книги могут уместиться сотни тысяч атомов.
Научные открытия конца XIX и начала XX веков показали, что сам атом тоже является сложной частицей. Каждый атом состоит из положительно заряженного ядра и движущихся с большой скоростью вокруг него отрицательно заряженных частиц - электронов (рис. 1). Ядро составляет основную массу атома и расположено в его центре. Диаметр ядра в 50-100 тысяч раз меньше диаметра атома.
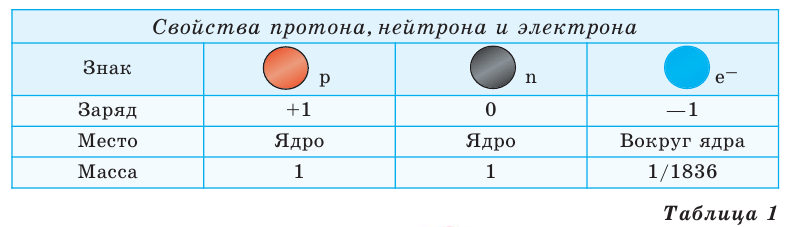
Атомная масса указывается в левом верхнем углу химического элемента, а количество протонов (порядковый номер) -в левом нижнем углу: 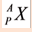
Из курса физики известно, что ядро имеет свой вес. Оно состоит из частиц - протонов и нейтронов.
Заряд протона +1, а масса его примерно равна массе атома водорода, или же 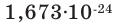 г. Величина положительного заряда ядра определяется числом протонов. Например, вследствие наличия 1 протона у атома водорода и 8 протонов у атома кислорода, заряд их ядер соответственно равен +1 и +8. Протон изображается буквой p или как
г. Величина положительного заряда ядра определяется числом протонов. Например, вследствие наличия 1 протона у атома водорода и 8 протонов у атома кислорода, заряд их ядер соответственно равен +1 и +8. Протон изображается буквой p или как 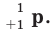 Нейтрон - это незаряженная частица. Его масса
Нейтрон - это незаряженная частица. Его масса 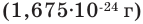 примерно равна массе протона. Нейтрон обозначается буквой n или как
примерно равна массе протона. Нейтрон обозначается буквой n или как 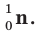 Электрон имеет очень малую массу. Его масса в 1836 раз меньше массы протона
Электрон имеет очень малую массу. Его масса в 1836 раз меньше массы протона 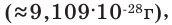 а заряд равен заряду протона с противоположным знаком (-1). Электрон обозначают знаком
а заряд равен заряду протона с противоположным знаком (-1). Электрон обозначают знаком 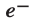 (таблица 1)
(таблица 1)
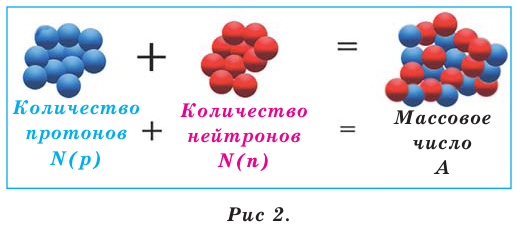
Масса атома определяется количеством его протонов и нейтронов. Это называется массовым числом (А). Следовательно, атомы - это нейтральные частицы, обладающие определённой массой (рис. 2).
Зная это, можно дать новое определение атома. Атомом называют электронейтральную частицу, состоящую из положительно заряженного ядра и отрицательно заряженных электронов.
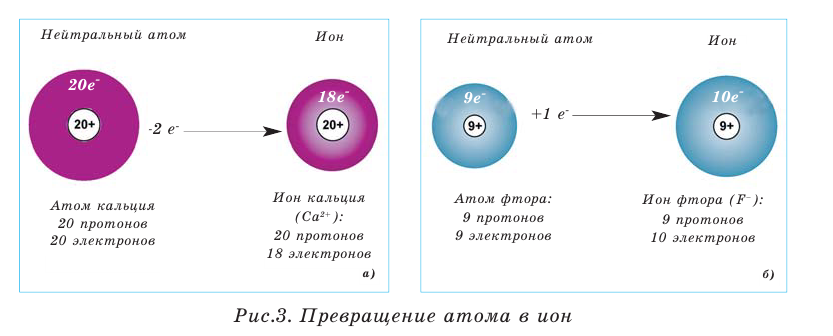
Атомы обладают способностью отдавать и принимать электроны. В этом случае полученная частица называется «ионом».
Когда атом отдаёт электрон, то в полученной частице электронов по количеству бывает меньше, чем протонов, и она превращается в положительно « + » заряженный ион (рис. 3, а), а когда принимает электрон, количество электронов в полученной частице превышает количество протонов, и в таком случае она становится отрицательно «-» заряженным ионом (рис. 3, б).
Химический элемент и изотопы
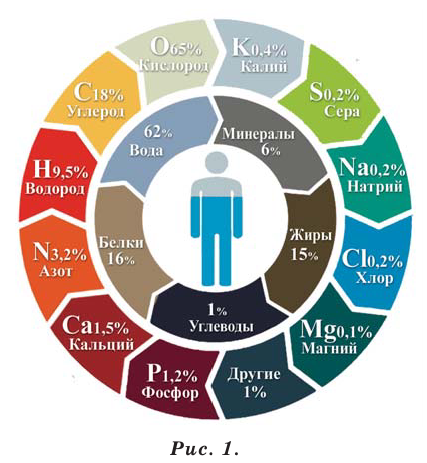
Обратите внимание на атомы химических элементов. Чем отличается один атом от другого? Какие химические элементы вы знаете? Как вы думаете, какие химические элементы встречаются в человеческом организме и сколько процентов они составляют?
Каждый вид атома отличается от других видов по заряду ядра. Под выражением «заряд ядра» подразумевается количество протонов, содержащихся в атоме. Вид атомов с одинаковым зарядом ядра (или количеством протонов) называется химическим элементом. Химические элементы подразделяются на 2 части: металлы и неметаллы.
Из существующих в природе 90 химических элементов примерно 70 содержатся в человеческом организме. Каждый из этих элементов имеет важное значение для человеческого организма. Из них примерно 25 элементов представляют для человеческой жизнедеятельности особую важность. Эти элементы называют биоэлементами. Они тоже делятся на две группы: макроэлементы
(С, Н, О, S, Р, Са, Mg, Na, К, С1) и микроэлементы (Си, Mn, Fe, Zn, Mo, F, J, Se, Cr, Ni, V, Sn, As, Si).
Человеку в течение дня необходимо 10 мг макроэлементов (рис. 1).
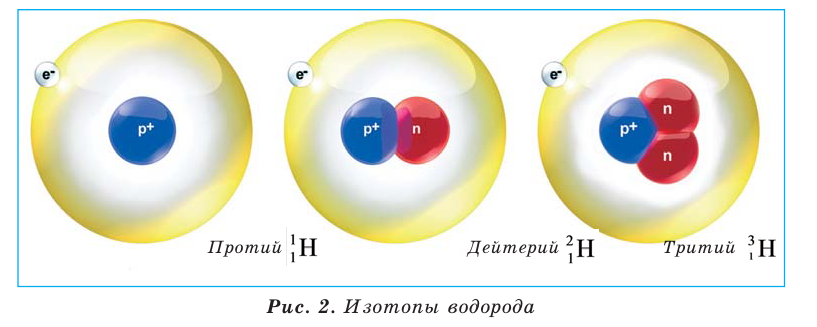
Знания о химических свойствах элементов и их соединений помогают человеку получать новые вещества, вести борьбу с болезнями, охранять природу. Некоторые элементы образуют различные атомы с одинаковыми химическими свойствами. Разновидности атомов одного и того же химического элемента, обладающие одинаковым зарядом ядра (количеством протонов), но разной массой (суммой протонов и нейтронов), называют изотопами. Например, в природе существует 3 изотопа водорода (рис. 2).
В настоящее время в природе существует свыше 20 миллионов веществ. Для обозначения состава этих веществ пользуются знаками химических элементов.
Слово «изотоп» означает «занимающий одно и то же место».
Химический знак элемента определяет его качественную (какой это элемент) и количественную (один атом данного химического элемента) характеристику.
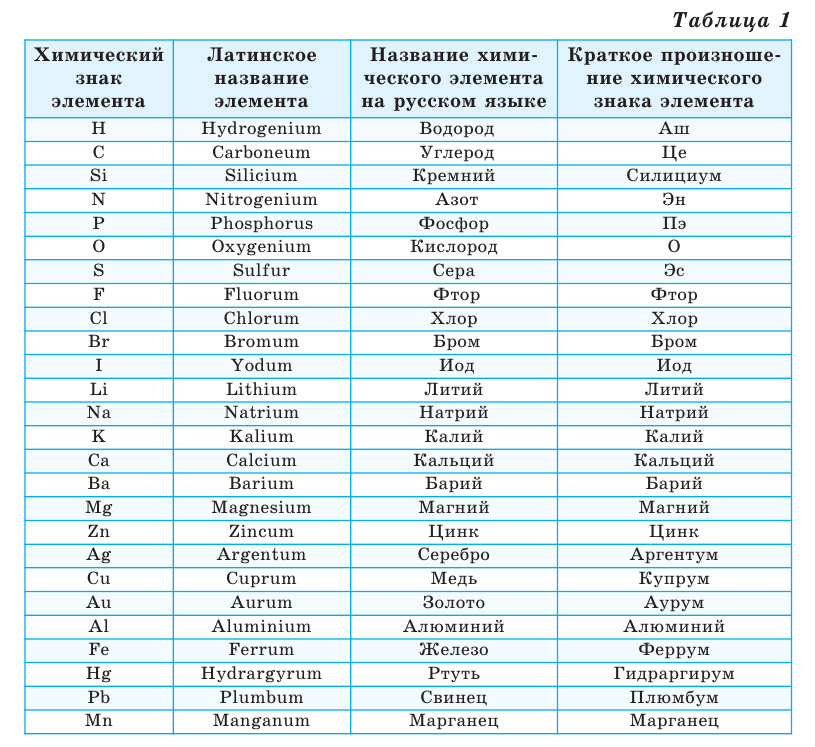
В 1814 году известный шведский химик Й.Я.Берцелиус предложил обозначить химические элементы начальными буквами их латинского названия. Например, водород (Hydrogenium) был обозначен латинской буквой Н, кислород (Oxygenium) - О, азот (Nitrogenium) - N, сера (Sulfur) - S. В случае совпадения начальных букв нескольких элементов, к начальной букве приписывалась одна из последующих за нею букв латинского названия элемента. Например, азот (Nitrogenium), никель (Nikelium) и натрий (Natrium) обозначаются, соответственно, знаками N, Ni и Na.
В нижеприведённой таблице даются латинские и русские названия некоторых химических элементов, а также их химические знаки (таблица 1).

Шведский химик. В 1814 году ввел в науку современное обозначение химических элементов. В 1807—1818 гг. определил атомные массы 45 химических элементов. Является автором ряда других научных открытий.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |