
Автор Анна Евкова
Преподаватель который помогает студентам и школьникам в учёбе.
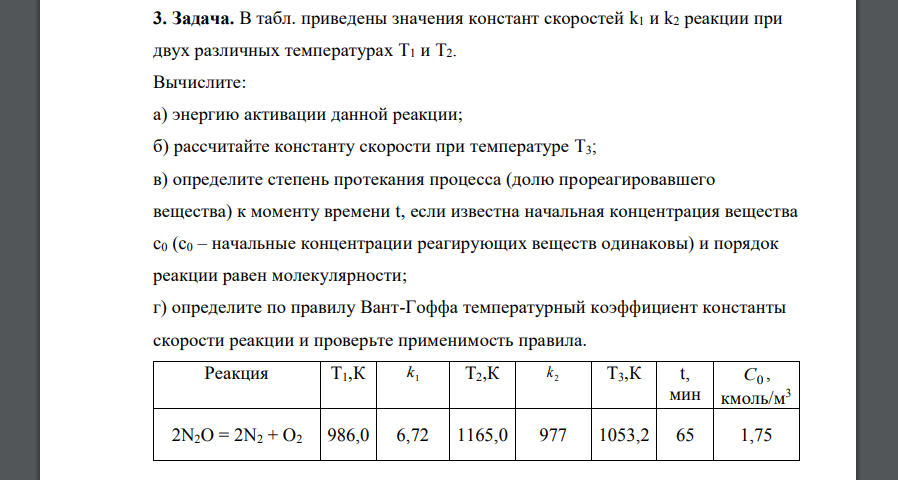
В табл. приведены значения констант скоростей k1 и k2 реакции при двух различных температурах T1 и T2. Вычислите
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16800 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Описание заказа и 38% решения ( + фото):
В табл. приведены значения констант скоростей k1 и k2 реакции при двух различных температурах T1 и T2. Вычислите: а) энергию активации данной реакции; б) рассчитайте константу скорости при температуре T3; в) определите степень протекания процесса (долю прореагировавшего вещества) к моменту времени t, если известна начальная концентрация вещества c0 (c0 – начальные концентрации реагирующих веществ одинаковы) и порядок реакции равен молекулярности; г) определите по правилу Вант-Гоффа температурный коэффициент константы скорости реакции и проверьте применимость правила. Реакция Т1,К 1 k Т2,К 2 k Т3,К t, мин С0 , кмоль/м3 2N2O = 2N2 + O2 986,0 6,72 1165,0 977 1053,2 65 1,75
Решение.
для нахождения энергии активации воспользуемся интегральной формой уравнения Аррениуса: для нахождения k3 при Т3 воспользуемся той же формулой уравнения Аррениуса: в) Константа скорости реакции второго порядка описывается выражением Степень протекания реакции равна г) Для определения температурного коэффициента скорости воспользуемся математическим выражением правило Вант – Гоффа: Проверим применимость правила Вант-Гоффа. Рассчитаем Получили близкое значение к рассчитанному по уравнению Аррениуса, поэтому правило Вант-Гоффа применимо к данной реакции в заданных условиях
Решение.
для нахождения энергии активации воспользуемся интегральной формой уравнения Аррениуса: для нахождения k3 при Т3 воспользуемся той же формулой уравнения Аррениуса: в) Константа скорости реакции второго порядка описывается выражением Степень протекания реакции равна г) Для определения температурного коэффициента скорости воспользуемся математическим выражением правило Вант – Гоффа: Проверим применимость правила Вант-Гоффа. Рассчитаем Получили близкое значение к рассчитанному по уравнению Аррениуса, поэтому правило Вант-Гоффа применимо к данной реакции в заданных условиях

- Во сколько раз отличаются вероятности заполнения электронами состояний с энергией на выше и ниже значения химического потенциала
- Исходя из одномерного распределения Максвелла по скоростям получить выражение распределения частиц по проекциям импульса Найти среднее
- Какой объем 0,001 М раствора BaCl2 надо добавить к 0,02 л 0,0007 М раствора Al2(SO4)3, чтобы получить положительно заряженные
- В цепи, изображенной на рисунке, найти токи в каждой ветви и разность потенциалов между узлами схемы, если ЭДС источников тока равны

