
Для кинетического анализа была составлена стехиометрическая газовая смесь из NO и О2. В ходе реакции 2NO + O2 = 2NO2
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16787 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Для кинетического анализа была составлена стехиометрическая газовая смесь из NO и О2. В ходе реакции 2NO + O2 = 2NO2 при Т = 298 К наблюдалось следующее изменение периода полураспада газовой смеси в зависимости от начального давления.
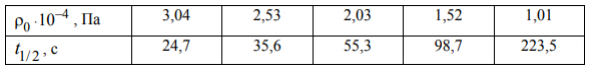
Определите порядок данной реакции и рассчитайте среднюю константу скорости.
Решение:
Для реакции первого порядка период полупревращения определяется по формуле Видим, что период полупревращения реакций первого порядка не зависит от исходного давления, поэтому рассматриваемая реакция не является реакцией первого порядка. Предположим, что реакция имеет второй порядок. Период полупревращения реакции второго порядка определяется по формуле 0 Рассчитаем значения константы скорости при разных значениях начального давления по формуле Результаты расчетов представим в виде таблицы. Видим, что получены неблизкие значения констант скорости, поэтому реакция имеет не второй порядок. Предположим, что реакция имеет третий порядок. Период полупревращения реакции третьего порядка определяется по формуле


- Химическая реакция протекает в условиях, указанных в табл. Определите с помощью теории столкновения кинетическую характеристику
- Реакция взаимодействия этанола с соляной кислотой HCl + C2H5OH = C2H5Cl + H2O
- Конденсатор емкости С = 1 мкФ и катушку индуктивности с активным сопротивлением R = 0,1 Ом и индуктивностью L = 1мГн и подключили источнику
- Изучена зависимость скорости распада н-бромистого пропила Н-C3H7Br k C3H6 + HBr при 709 К от степени превращения (α) исходного вещества при

