
Сера в химии - классификация, получение, свойства, формулы и определения с примерами
Содержание:
Сера — химический элемент и простое вещество:
Сера, так же как и кислород, является элементом VIA-группы периодической системы, она находится в третьем периоде. Рассмотрим свойства этого химического элемента и образуемых им простых веществ.
Сера в природе

Массовая доля серы в земной коре составляет около 0,05 %, она является распространенным элементом. В природе сера встречается как в виде самородной серы (рис. 49), так и в составе различных минералов и горных пород (рис. 50): сульфидов 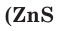

Строение атома серы
В атоме серы 16 электронов (рис. 51), из них 6 электронов — на внешнем электронном слое:
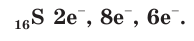
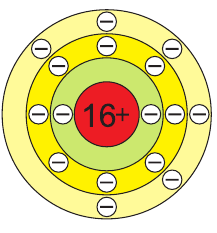

В соединениях с металлами и водородом сера обычно проявляет степень окисления, равную –2, например 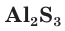 — сульфид алюминия. В соединениях с более электроотрицательными элементами (F, O, N, Cl, Br) атомы серы проявляют положительные степени окисления, чаще +4 и +6, например
— сульфид алюминия. В соединениях с более электроотрицательными элементами (F, O, N, Cl, Br) атомы серы проявляют положительные степени окисления, чаще +4 и +6, например 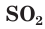 — оксид серы(IV),
— оксид серы(IV), 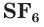 — фторид серы(VI).
— фторид серы(VI).
Строение и физические свойства простых веществ
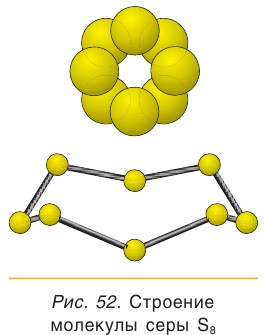
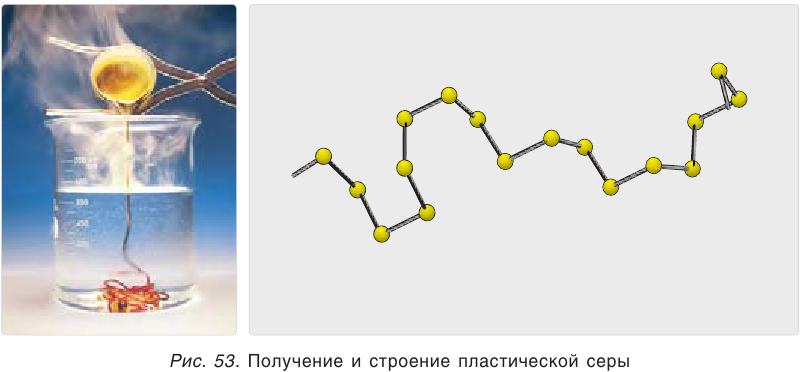
Простое вещество сера существует в виде нескольких аллотропных модификаций, отличающихся составом и строением. Кристаллическая сера — твердое, легкоплавкое вещество желтого цвета. Кристаллическая сера имеет молекулярное строение — состоит из циклических молекул 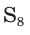 (рис. 52). Если расплавленную серу вылить в холодную воду, то она застынет в виде светложелтой, прозрачной массы, похожей на резину (рис. 53). Это аморфная модификация — пластическая сера, состоящая из длинных цепей атомов серы S.
(рис. 52). Если расплавленную серу вылить в холодную воду, то она застынет в виде светложелтой, прозрачной массы, похожей на резину (рис. 53). Это аморфная модификация — пластическая сера, состоящая из длинных цепей атомов серы S.


Сера в воде не растворяется и даже не смачивается ею. Если бросить в воду немного порошка серы, то частички серы не осядут на дно, а будут плавать на поверхности воды, образуя желтую пленку (рис. 54).
Химические свойства серы
Сера взаимодействует со многими простыми и сложными веществами, хотя ее реакционная способность ниже, чем у кислорода.
Сера реагирует со многими металлами, кроме золота и платины, проявляя при этом окислительные свойства, например (рис. 55):

Продуктами такого взаимодействия являются сульфиды металлов.
Реакция с серой является основой способа удаления и обезвреживания разлитой ртути, например, из разбитого термометра. Ртуть, которая попала в щели и другие труднодоступные места, засыпают порошком серы. Такой процесс называют демеркуризацией.
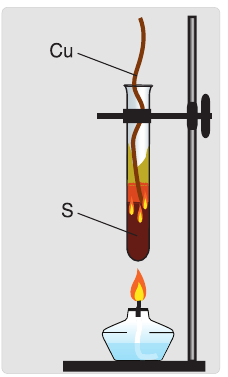

Окислительные свойства серы проявляются и в реакциях с некоторыми неметаллами. Сера взаимодействует с водородом при нагревании, образуя летучее соединение — сероводород 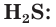
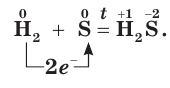
Сероводород — бесцветный газ с резким запахом тухлых яиц. Правильнее сказать, что это тухлые яйца пахнут сероводородом, так как этот газ образуется при гниении растительных и животных остатков. Сероводород ядовит. Поэтому его вдыхание может привести к тяжелому отравлению. Однако в небольших количествах сероводород оказывает целебное действие. Он содержится в водах некоторых минеральных источников.
Сера окисляется кислородом, проявляя при этом восстановительные свойства (рис. 56):
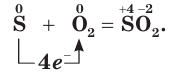
Применение серы
Больше половины добытой серы расходуется для получения серной кислоты, одного из самых важных химических продуктов. Нагреванием серы с каучуком получают резину. Как горючее вещество сера входит в состав черного пороха, спичечных головок. Широко применяется сера в сельском хозяйстве для борьбы с вредителями растений. В медицине серу используют для лечения кожных заболеваний.
Сера в соединениях с металлами и менее электроотрицательными элементами проявляет степень окисления –2, а в соединениях с более электроотрицательными элементами — +4 и +6.
Простое вещество сера существует в виде нескольких аллотропных модификаций.
Сера при взаимодействии с металлами, водородом и некоторыми неметаллами ведет себя как окислитель.
В реакции с кислородом сера является восстановителем.
Оксид серы(IV) и оксид серы(VI)
Сера образует с кислородом два оксида: оксид серы(IV), или сернистый газ, 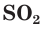 и оксид серы(VI)
и оксид серы(VI) 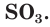
Оксид серы(IV)
Оксид серы(IV) — это бесцветный газ с характерным запахом. Графическая формула его молекулы:
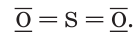
Оксид серы(IV) является кислотным оксидом, проявляя все соответствующие химические свойства: взаимодействует с водой, щелочами и осно Ђвными оксидами.
При растворении оксида серы(IV) в воде образуется слабая двухосновная сернистая кислота:
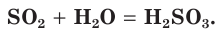
В этом легко убедиться по изменению окраски лакмуса с фиолетовой на красную в водном растворе оксида серы(IV). Сернистая кислота неустойчива и существует только в растворе. Соли этой кислоты называются сульфитами.
Сернистый газ обладает бактерицидным действием. Поэтому его широко используют для обработки овощехранилищ, плодов и фруктов, чтобы предотвратить их загнивание. Сернистый газ, как и соли сернистой кислоты, применяют для отбеливания соломы, шерсти, бумаги, тканей.
В оксиде серы(IV) сера находится в промежуточной степени окисления +4. Поэтому сернистый газ может проявлять как окислительные свойства, реагируя с восстановителями:
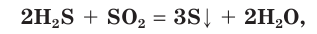
так и восстановительные свойства, взаимодействуя с сильными окислителями:
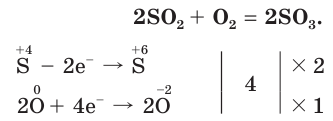
Реакция взаимодействия сернистого газа с сероводородом — один из важных процессов, протекающих в природе. При извержении вулканов выделяются SO2 и H2S, а при их взаимодействии образуется сера в виде кристаллов. На рисунке вы видите извержение вулкана Килауэа.

Оксид серы(VI)
Оксид серы(VI) SO3 представляет собой бесцветную жидкость, которая при температуре ниже 17 °С превращается в белое твердое вещество. Графическая формула его молекулы представлена на рисунке 58.
Это типичный кислотный оксид. Он реагирует с водой с выделением теплоты, образуя серную кислоту:
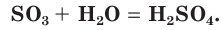
Оксид серы(VI) реагирует с основными оксидами:
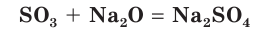
и щелочами:
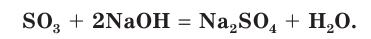
Оксид серы(VI) применяется для промышленного получения серной кислоты.
Попадание оксидов серы в атмосферу при сжигании топлива приводит к образованию в облаках кислот и выпадению кислотных дождей. Они губительно действуют на все живое: разрушается почва, изменяется состав почвенных организмов, гибнут ценные виды рыб, исчезает растительность (см. рис.).

Оксид серы(IV) и оксид серы(VI) представляют собой типичные кислотные оксиды.
При взаимодействии с водой оксид серы(IV) и оксид серы(VI) образуют соответственно сернистую и серную кислоты.
Серная кислота
Серная кислота 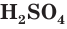 является важнейшим кислородсодержащим соединением серы. Она была получена алхимиками еще в XIII в. и называлась тогда «купоросное масло». С помощью серной кислоты удалось получить и другие минеральные (неорганические) кислоты — соляную, азотную.
является важнейшим кислородсодержащим соединением серы. Она была получена алхимиками еще в XIII в. и называлась тогда «купоросное масло». С помощью серной кислоты удалось получить и другие минеральные (неорганические) кислоты — соляную, азотную.
Строение молекулы серной кислоты
Модель молекулы серной кислоты представлена на рисунке 59. В молекуле 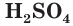 атом серы соединен с четырьмя атомами кислорода за счет образования двух двойных связей S=O и двух одинарных S=OH.
атом серы соединен с четырьмя атомами кислорода за счет образования двух двойных связей S=O и двух одинарных S=OH.
Связи  в молекуле серной кислоты являются сильно полярными, поэтому у
в молекуле серной кислоты являются сильно полярными, поэтому у 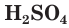 ярко выражены кислотные свойства. Серная кислота — сильный электролит, в разбавленных водных растворах диссоциирует на ионы полностью:
ярко выражены кислотные свойства. Серная кислота — сильный электролит, в разбавленных водных растворах диссоциирует на ионы полностью:
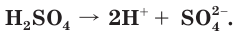
Физические свойства серной кислоты
Чистая серная кислота — бесцветная маслянистая нелетучая жидкость без запаха, примерно в 2 раза тяжелее воды. Она смешивается с водой в любых соотношениях. При приготовлении водных растворов серной кислоты выделяется большое количество теплоты, происходит разогревание смеси, которое может сопровождаться ее разбрызгиванием.

Помните!
Кислоту осторожно тонкой струйкой вливают в воду при непрерывном перемешивании раствора.
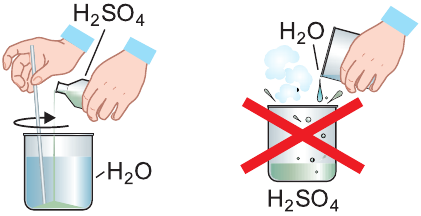

Обычно водный раствор серной кислоты с массовой долей 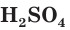 более 70 % называют концентрированной серной кислотой, а менее 70 % — разбавленной серной кислотой.
более 70 % называют концентрированной серной кислотой, а менее 70 % — разбавленной серной кислотой.
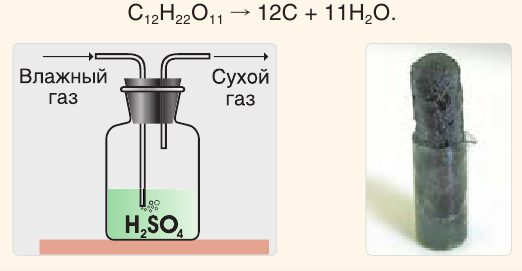
Концентрированная серная кислота используется как водоотнимающий агент, например для осушения газов (см. рис. слева).
Она способна отнимать воду и у сложных веществ, в состав которых входят водород и кислород. Так, под действием концентрированной серной кислоты сахар обугливается и реакционная масса чернеет и вспучивается (см. рис. справа):
Химические свойства серной кислоты
Разбавленная серная кислота, как и соляная, проявляет все характерные для кислот свойства. Она изменяет окраску индикаторов: лакмус и метилоранж в растворе 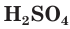 становятся красными. Разбавленная
становятся красными. Разбавленная 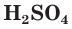 взаимодействует с металлами, стоящими в ряду активности до водорода, с выделением водорода:
взаимодействует с металлами, стоящими в ряду активности до водорода, с выделением водорода:
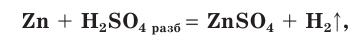
являясь окислителем за счет ионов водорода Н+ .
Разбавленная серная кислота реагирует также с оксидами металлов:
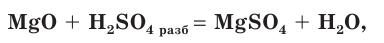
с основаниями:
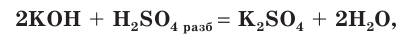
с солями:
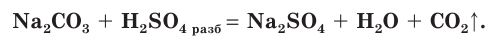

Концентрированная серная кислота по своим свойствам отличается от разбавленной. Она является более сильным окислителем за счет атомов серы, имеющих степень окисления +6. Концентрированная 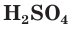 способна взаимодействовать с металлами, стоящими в ряду активности не только до, но и после водорода (кроме золота и платины).
способна взаимодействовать с металлами, стоящими в ряду активности не только до, но и после водорода (кроме золота и платины).
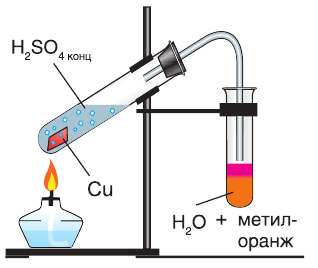
Продемонстрируем действие концентрированной серной кислоты на медь. При приливании концентрированной серной кислоты в пробирку с медью и нагревании смеси раствор окрашивается в серовато-синий цвет и наблюдается выделение газа 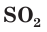 (рис. 60):
(рис. 60):
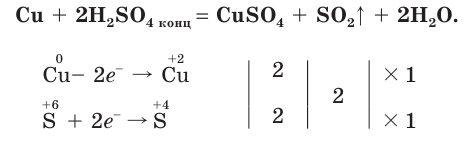
Железо, алюминий и некоторые другие металлы при обычных условиях не реагируют с концентрированной серной кислотой из-за образования защитной пленки на поверхности металла. Поэтому концентрированную серную кислоту можно хранить и перевозить в стальных цистернах (рис. 61).
Концентрированная серная кислота способна взаимодействовать с простыми веществами — неметаллами, а также со многими сложными, в том числе органическими соединениями. Серная кислота обугливает бумагу и древесину, разрушает одежду и кожу — это очень опасное вещество, способное вызывать труднозаживающие химические ожоги.


- Серная кислота — бесцветная, маслянистая жидкость. В водных растворах является сильным электролитом.
- Разбавленная серная кислота проявляет все характерные для кислот свойства: взаимодействует с металлами, стоящими в ряду активности до водорода, с выделением водорода; с оксидами металлов; с основаниями; с солями.
- При взаимодействии концентрированной серной кислоты с медью выделяется оксид серы(IV).
Сульфаты — соли серной кислоты

Серная кислота — один из главных продуктов химической промышленности. Об этом говорят и масштабы мирового производства, достигающие 200 млн т в год.
Соли серной кислоты
Как вы уже знаете из предыдущего параграфа, соли серной кислоты — сульфаты могут образовываться при ее взаимодействии с металлами, оксидами металлов, основаниями и солями.
Большинство сульфатов хорошо растворимы в воде. Растворимые сульфаты, главным образом сульфат магния, содержатся в морской воде и обуславливают ее горький вкус.
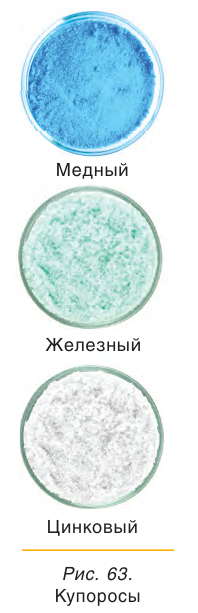
Многие сульфаты способны связывать воду, образуя кристаллогидраты. Кристаллогидраты солей серной кислоты часто называют купоросами, например: 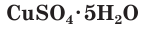 — медный купорос,
— медный купорос, 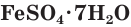 — железный купорос,
— железный купорос,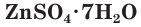 — цинковый купорос (рис. 63). При нагревании они легко выделяют содержащуюся в них воду.
— цинковый купорос (рис. 63). При нагревании они легко выделяют содержащуюся в них воду.
Плохо растворимы сульфаты металлов IIА-группы (кроме сульфатов бериллия и магния), меньше других растворим сульфат бария. При добавлении раствора соли бария, например хлорида бария 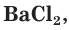 к водным растворам серной кислоты или сульфатов образуется осадок сульфата бария белого цвета:
к водным растворам серной кислоты или сульфатов образуется осадок сульфата бария белого цвета:
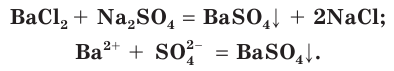
Поэтому для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
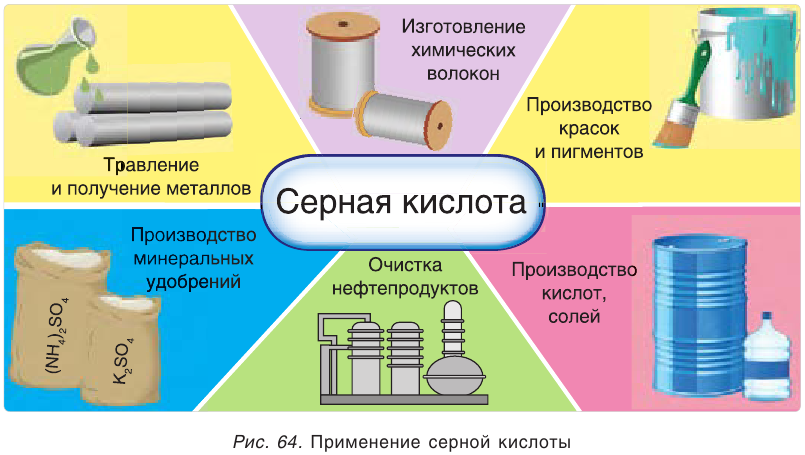
Применение серной кислоты и сульфатов
Серная кислота — один из важнейших продуктов, широко используемых в различных областях промышленности (рис. 64). Основными ее потребителями являются производства минеральных удобрений, соляной, уксусной и других кислот, моющих средств, взрывчатых веществ, красителей, лекарств. Серная кислота применяется также в металлургии, для очистки нефтепродуктов, в качестве электролита в кислотных аккумуляторах и т. д.
Соли серной кислоты используются в качестве минеральных удобрений, в строительстве, в медицине, для борьбы с вредителями растений, в производстве соды и стекла. Например, кристаллогидраты сульфата меди(II) 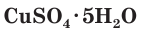 (медный купорос) и сульфата железа(II)
(медный купорос) и сульфата железа(II) 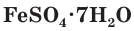 (железный купорос) используются в сельском хозяйстве для борьбы с вредителями растений, как антисептическое средство для обработки древесины, в производстве красителей. Гидратированный сульфат магния
(железный купорос) используются в сельском хозяйстве для борьбы с вредителями растений, как антисептическое средство для обработки древесины, в производстве красителей. Гидратированный сульфат магния 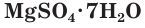 (горькая, или английская, соль) широко применяется в медицине, в том числе как сильное слабительное средство.
(горькая, или английская, соль) широко применяется в медицине, в том числе как сильное слабительное средство.
Природный гипс 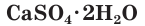 служит для улучшения почвы, алебастр
служит для улучшения почвы, алебастр 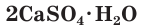 нашел широкое применение в строительном деле, для формовки всевозможных изделий, при изготовлении гипсовых скульптур и т. п.
нашел широкое применение в строительном деле, для формовки всевозможных изделий, при изготовлении гипсовых скульптур и т. п.
- Серная кислота — один из главных продуктов химической промышленности.
- Большинство сульфатов хорошо растворимы в воде.
- Для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |