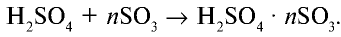Подгруппа кислорода в химии - формулы и определения с примерами
Содержание:
Характеристика элементов подгруппы кислорода:
В основной подгруппе шестой группы периодической таблицы (подгруппе кислорода) расположены кислород, сера, селен, теллур и полоний (ввиду того, что полоний — радиоактивный элемент, его свойства подробно изучаются в радиохимии).
Строение атомов элементов подгруппы кислорода
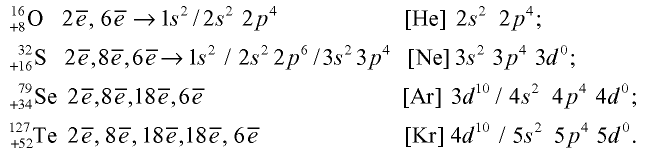
На внешнем энергетическом уровне атомов этих элементов имеется шесть электронов:
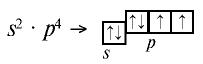
Поэтому эти элементы для завершения внешнего энергетического уровня, то есть пополнения восемью электронами, присоединяют два электрона и проявляют в соединениях степень окисления —2. В соединении с фтором 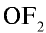 кислород проявляет степень окисления +2, в соединении с водородом
кислород проявляет степень окисления +2, в соединении с водородом 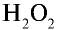 —1. Во всех других соединениях степень окисления кислорода равна —2.
—1. Во всех других соединениях степень окисления кислорода равна —2.
На внешнем энергетическом уровне атомов серы, селена и теллура имеются свободные d-орбитали, на которые могут переходить спаренные р- и s-электроны внешнего уровня.
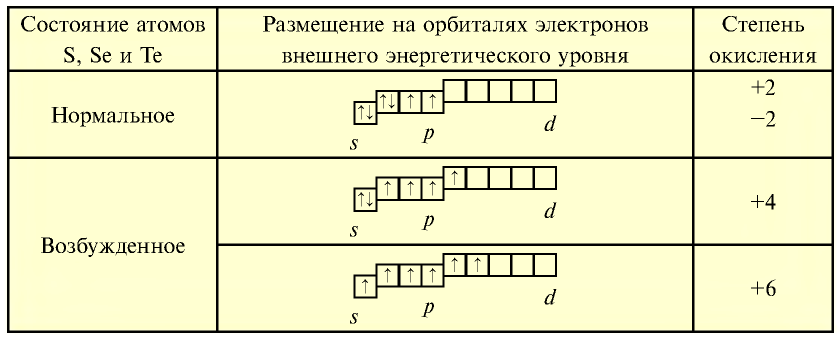
Присоединяя электроны, S, Se и Те проявляют степени окисления —2, отдавая электроны, проявляют степени окисления +4, +6:
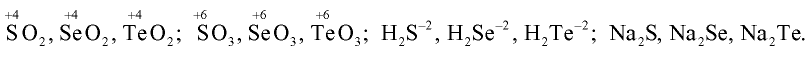
Кислород — элемент второго периода, на внешнем энергетическом уровне его атома нет d-орбиталей, поэтому он не может проявлять степени окисления +4, +6.
Сера
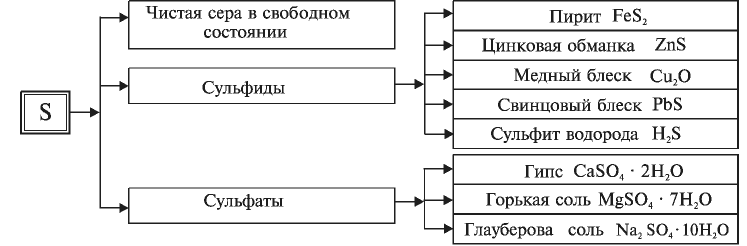
Распространение в природе: Сера широко распространена в природе как в свободном состоянии, так и в соединениях
.
( ГЛАВА VII ) подгруппа кислорода
На территории Узбекистана имеются природные залежи серы.
В настоящее время на действующих в нашей стране предприятиях по переработке газа и газового конденсата налажено получение серы и ее соединений. В частности, в медных рудах, добываемых в Узбекистане, присутствуют сера, селен и теллур.
Селен и теллур используются в качестве сырья при производстве полупроводников, солнечных батарей, терморегуляторов, при создании особых сортов стали и стекла.
Физические свойства: Сера имеет три аллотропические модификации: ромбическая сера 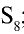 ; моноклиническая сера
; моноклиническая сера 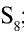 ; пластическая сера
; пластическая сера 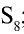 .
.
В природе встречается ромбическая сера, она представляет собой твердое кристаллическое вещество желтого цвета, не растворимое в воде. Несмотря на то, что плотность серы равна 2 г/см3, серный порошок всплывает на поверхность воды, так как частицы серы не смачиваются водой.
Всплывание твердых веществ на поверхность воды называется флотацией. Метод флотации широко используется при очистке серных руд от "инородных" тел.
Сера растворяется в сульфиде углерода (IV) 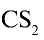 и органических растворителях. Она плохо проводит электрический ток и тепло. Сера плавится при температуре 112,8°С, кипит при 444,5 °С. При резком охлаждении расплавленной серы в холодной воде она превращается в пластическую серу, которая представляет собой тягучее вещество.
и органических растворителях. Она плохо проводит электрический ток и тепло. Сера плавится при температуре 112,8°С, кипит при 444,5 °С. При резком охлаждении расплавленной серы в холодной воде она превращается в пластическую серу, которая представляет собой тягучее вещество.
Химические свойства: В химических реакциях сера участвует как окислитель, а при взаимодействии с кислородом — как восстановитель.
Сера окислитель:
1. Вступая в реакцию с водородом, сера образует сульфид водорода:
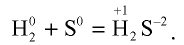
2. Взаимодействуя с металлами, сера образует сульфиды:
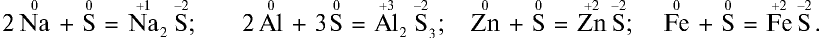
Сера восстановитель: Вступая в реакцию с кислородом, хлором и фтором, сера отдает электрон:
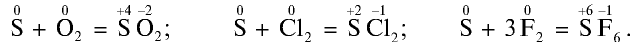
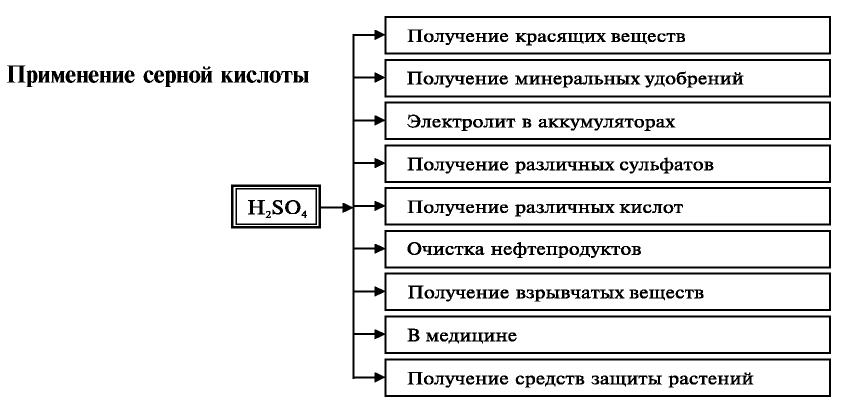
Применение: Сера используется в народном хозяйстве в различных целях.

Водородные соединения серы
Почему водный раствор сульфида водорода проявляет кислотное свойство?
Молекулярная формула сульфида водорода (сероводорода) 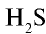 ; структурная формула H-S-H;
; структурная формула H-S-H;
электронная формула: 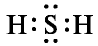
Получение: Сульфид водорода получают действием соляной кислоты на соли сероводородной кислоты, то есть сульфиды:
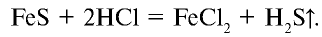
Сульфид водорода получают также воздействием водорода на расплавленную (при 200—350°С) серу: 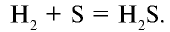
Физические свойства: Сульфид водорода — газ с острым запахом (запах протухшего яйца), ядовит. Плавится при температуре —60°С, кипит при —61,8°С . В 1 л воды растворяется 3,85 г сульфида водорода (в одном объеме воды 2,5 объема 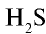 ).
).
Водный раствор сульфида водорода называется сероводородной кислотой.
Химические свойства: Сульфид водорода — горючий газ, он горит в присутствии кислорода.
Если кислорода достаточно, то получаются сернистый газ и вода:
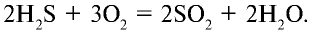
Если кислорода недостаточно, то образуются сера и вода:
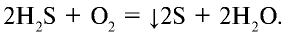
Сульфид водорода и сероводородная кислота — сильные восстановители:
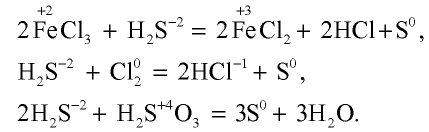
Как и другие кислоты, сероводородная кислота вступает в химические реакции, общие для всех кислот:
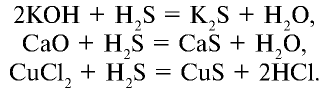
Для сульфида водорода, сероводородной кислоты и водорастворимых сульфидов реактивом является 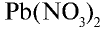 :
:
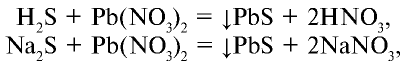
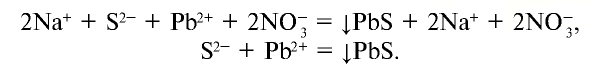
Кислородные соединения серы
Оксиды серы: Сера образует два оксида, имеющих практическое значение: оксид серы (IV)-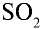 (сернистый ангидрид) и оксид серы (VI)-
(сернистый ангидрид) и оксид серы (VI)-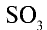 (серный ангидрид).
(серный ангидрид).
Оксид серы(1V) 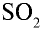 в природе встречается в составе вулканических газов и газов, образованных в результате горения природного угля.
в природе встречается в составе вулканических газов и газов, образованных в результате горения природного угля. 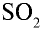 — газ с полярной ковалентной связью. В лабораторных условиях
— газ с полярной ковалентной связью. В лабораторных условиях 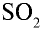 получают путем воздействия на соли сернистой кислоты соляной и серной кислотами:
получают путем воздействия на соли сернистой кислоты соляной и серной кислотами:
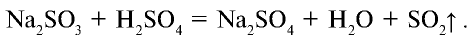
Оксид серы (IV) получают также путем воздействия на медную стружку концентрированной серной кислотой:
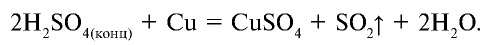
В промышленности оксид серы (IV) получают путем обжига на воздухе сульфидов металлов:
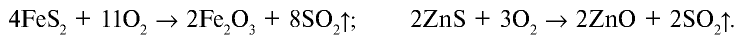
Оксид серы (IV) — бесцветный газ с резким удушливым запахом, который при — 10°С переходит в жидкое, а при —73°С — в твердое состояние. Будучи кислотным оксидом, растворяясь в воде, образует сернистую кислоту:
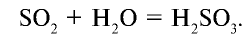
Взаимодействуя с основными оксидами и щелочами, оксид серы (IV) образует сульфиты:
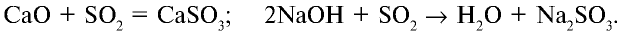
Оксид серы (IV) окисляется в присутствии катализатора и образует оксид серы (VI):
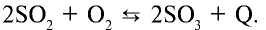
Оксид серы (IV) окисляет сульфид водорода, в результате сам восстанавливается до серы:
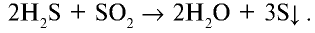
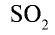 обесцвечивает органические красители, убивает микроорганизмы, используется при изготовлении сухофруктов (кураги), выращивании ягод. Жидкий
обесцвечивает органические красители, убивает микроорганизмы, используется при изготовлении сухофруктов (кураги), выращивании ягод. Жидкий 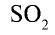 используется при очистке нефти.
используется при очистке нефти.
Оксид серы (VI) 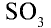 — высший оксид серы, бесцветная жидкость, кипящая при 45°С, а при 17°С превращающаяся в белую кристаллическую массу. Оксид серы (VI) проявляет свойства, присущие кислотным оксидам. Легко вступает в реакцию с водой и образует серную кислоту:
— высший оксид серы, бесцветная жидкость, кипящая при 45°С, а при 17°С превращающаяся в белую кристаллическую массу. Оксид серы (VI) проявляет свойства, присущие кислотным оксидам. Легко вступает в реакцию с водой и образует серную кислоту:
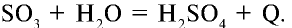
Сам оксид серы (VI) также хорошо растворяется в концентрированной серной кислоте, при этом образуется олеум: 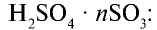
В промышленности оксид серы (VI) получают путем окисления оксида серы (IV) в присутствии катализатора. Оксид серы (VI) применяется в основном в производстве серной кислоты.
Серная кислота
На какие металлы не воздействует концентрированная серная кислота?
Молекулярная формула серной кислоты 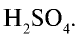 Электронная и структурная формулы:
Электронная и структурная формулы:
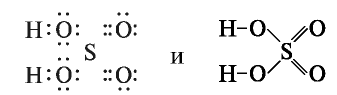
Получение серной кислоты осуществляется с помощью химических реакций, протекающих по следующей схеме:
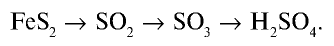
Физические свойства: Серная кислота — тяжелая бесцветная маслянистая жидкость без запаха. Плотность 96% -ной концентрированной кислоты равна 1,84 г/см3. При растворении в воде она выделяет большое количество теплоты, поэтому при ее разбавлении следует соблюдать осторожность, приливая серную кислоту к воде небольшими частями. Ни в коем случае нельзя воду приливать к кислоте! Химические свойства. Концентрированная и разбавленная серные кислоты отличаются друг от друга по химическим свойствам. Разбавленная серная кислота проявляет все свойства, присущие кислотам.
1. Взаимодействует со всеми металлами, стоящими в ряду активности перед водородом, при этом образуются соли и вытесняется водород:
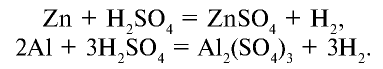
2. Взаимодействует с основными и амфотерными оксидами и образует соли и воду:
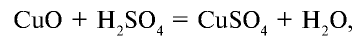
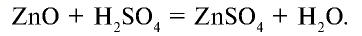
3. Взаимодействует с основаниями и образует соли и воду:
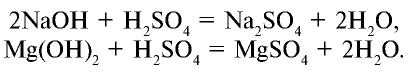
4. Взаимодействует с солями слабых и летучих кислот и образует новые соли и новые кислоты:
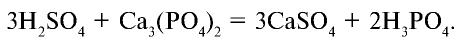
Концентрированная серная кислота является очень сильным окислителем, поэтому она реагирует почти со всеми металлами, кроме серебра Ag, золота Аu и платины Pt, а также железа Fe при 100% -ной концентрации.
При этом в зависимости от активности металлов, концентрации серной кислоты и условий реакции выделяются газы 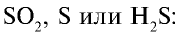

При кипячении концентрированная серная кислота взаимодействует также с неметаллами:
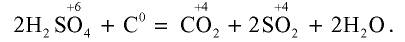
Концентрированная серная кислота обугливает такие вещества, как сахар, бумага, дерево и ткани, вытягивая воду из содержащейся в них целлюлозы:
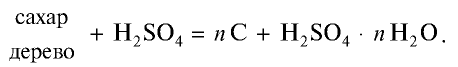
Для определения серной кислоты и сульфатов на них воздействуют растворимой солью бария (хлорид бария). В результате реакции выпадает осадок белого цвета, не растворимый ни в воде, ни в азотной кислоте:
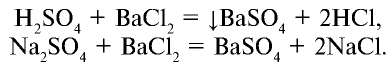
Сульфаты. Сульфат натрия 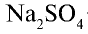 . Безводный сульфат натрия используется при производстве стекла и соды, при изготовлении различных лекарств в медицине. Соединение
. Безводный сульфат натрия используется при производстве стекла и соды, при изготовлении различных лекарств в медицине. Соединение 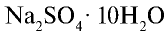 называется глауберовой солью
называется глауберовой солью
Сульфат кальция 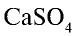 .
. 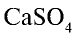 в природе встречается в виде гипса
в природе встречается в виде гипса 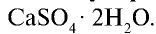 При нагревании природного гипса при 150— 170°С он теряет 3/4 воды и превращается в алебастр
При нагревании природного гипса при 150— 170°С он теряет 3/4 воды и превращается в алебастр 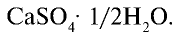
Алебастр — важный строительный материал, часто используемый при строительстве объектов. В медицине гипс используется для наложения всевозможных гипсовых повязок.
Сульфат меди(Н) 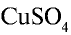 . В соединении с водой сульфат меди (II) образует медный купорос — кристаллогидрат
. В соединении с водой сульфат меди (II) образует медный купорос — кристаллогидрат 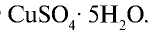 Медный купорос используется для облицовки поверхности металлов медным покрытием, а также для борьбы с вредителями сельскохозяйственных растений.
Медный купорос используется для облицовки поверхности металлов медным покрытием, а также для борьбы с вредителями сельскохозяйственных растений.
Железный купорос 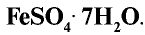 Кристалл темно-зеленого цвета, используется для борьбы с вредителями сельскохозяйственных растений, а также для изготовления различных красок.
Кристалл темно-зеленого цвета, используется для борьбы с вредителями сельскохозяйственных растений, а также для изготовления различных красок.
Скорость химических реакций
Можно ли ускорить протекание химических реакций?
Химические реакции протекают с различной скоростью. Некоторые реакции протекают за доли секунды, а другие могут длиться в течение нескольких дней, то есть идут очень медленно. Есть и такие реакции, для завершения которых требуются даже годы.
Если в химическом производстве некоторые реакции требуют ускорения, то некоторые необходимо замедлить. Например, процесс ржавления железных изделий требует замедления.
— Изменение концентраций веществ, участвующих в химической реакции, за единицу времени называется скоростью химической реакции.
Например, начальная концентрация вещества, вступающего в реакцию, равна 1 моль/л. Через 10 с, в течение которых продолжалась реакция, концентрация этого вещества составила 0,4 моль/л. Скорость совершившейся реакции определяется путем выполнения следующих действий.
Скорость химической реакции — v. В течение реакции концентрация вещества уменьшилась на 0,6 моль/л: (1 моль/л — 0,4 моль/л = 0,6 моль/л). Продолжительность реакции — 10 секунд.
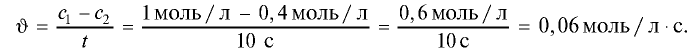 '
'
Следовательно, скорость этой реакции равна 0,06 моль/л с.
Факторы, влияющие на скорость химической реакции
1. Влияние концентрации реагирующих веществ на скорость химических реакций.
При изучении химических свойств кислорода в курсе химии 7 класса вы узнали, что на воздухе сера горит очень медленно, а в присутствии чистого кислорода быстро сгорает ярким пламенем.
При горении серы в присутствии чистого кислорода количество молекул кислорода, ударяющихся о поверхность серы, намного больше, чем в воздухе. Это связано с тем, что кислород занимает 21% объема воздуха.
Скорость химических реакций равна произведению концентраций веществ, участвующих в реакции. Например, для реакции А+В=С v = к [А] • [В], где [А] и [В] — молярные концентрации веществ А и В, к — коэффициент пропорциональности.
2. Влияние температуры на скорость химических реакций.
При повышении температуры скорость реакции увеличивается в 2—4 раза:
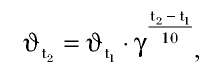
где 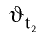 — скорость реакции при температуре
— скорость реакции при температуре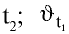 — скорость реакции при температуре
— скорость реакции при температуре 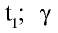 — температурный коэффициент скорости химической реакции.
— температурный коэффициент скорости химической реакции.
Например, при температурном коэффициенте скорости реакции 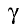 = 2 и повышении температуры среды до 40°С скорость данной реакции увеличивается в 16 раз; до 50°С — в 32 раза, до 70°С — в 128 раз. Такое резкое увеличение скорости реакции можно объяснить ускорением движения молекул и увеличением частоты их столкновений, а также возрастанием количества активных молекул. Скорость химических реакций зависит также от природы реагирующих веществ, поверхности твердых веществ и катализатора (вспомните понятие о катализаторах из курса химии 7 класса).
= 2 и повышении температуры среды до 40°С скорость данной реакции увеличивается в 16 раз; до 50°С — в 32 раза, до 70°С — в 128 раз. Такое резкое увеличение скорости реакции можно объяснить ускорением движения молекул и увеличением частоты их столкновений, а также возрастанием количества активных молекул. Скорость химических реакций зависит также от природы реагирующих веществ, поверхности твердых веществ и катализатора (вспомните понятие о катализаторах из курса химии 7 класса).
3. Влияние природы веществ на скорость химической реакции.
- а) реакция
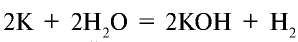 протекает настолько быстро, что выделяющийся водород сгорает. Реакция сопровождается горением;
протекает настолько быстро, что выделяющийся водород сгорает. Реакция сопровождается горением; - б) реакция
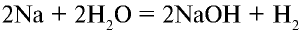 протекает быстро, но медленнее, чем реакция воды с калием;
протекает быстро, но медленнее, чем реакция воды с калием; - в) взаимодействие железа с водой происходит при участии атмосферного кислорода в течение длительного времени;
- г) медь не взаимодействует с водой.
4. Для твердых веществ скорость реакции прямо пропорциональна поверхности веществ, вступающих в реакцию.
Рассмотрим эту зависимость на примере реакции соединения железа с серой.
Реакция Fe + S = FeS протекает быстрее до строго определенной степени измельчения частиц железа. При увеличении степени измельчения частиц до порошкообразного состояния скорость реакции ослабевает, так как происходит спекание, которое снижает взаимное столкновение молекул.
5. Влияние катализатора на скорость химической реакции.
Реакция расщепления пероксида водорода ускоряется в присутствии
МпОг Процесс получения оксида серы (VI) ускоряется в присутствии катализатора оксида ванадия (V).
— Вещества, которые ускоряют химические реакции, но сами остаются без изменений, называются катализаторами.
Ингибиторы — это вещества, которые снижают возможность веществ вступать в химическую реакцию.
Элементы знаний, умений и навыков: скорость химической реакции, концентрация, температура, температурный коэффициент скорости, столкновение молекул, катализатор, ингибитор.
Химическое равновесие
Почему реакция расщепления известняка считается необратимой?
Химические реакции подразделяются на обратимые и необратимые. Необратимые реакции протекают только в сторону образования продуктов реакции. Например,
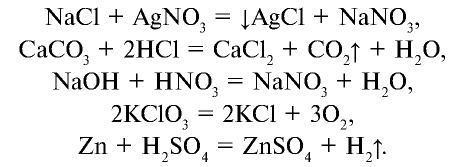
В обратимых же реакциях химический процесс протекает в противоположные стороны. То есть сначала образуются продукты реакции, которые одновременно могут превращаться в исходные вещества. Например, оксид серы (IV), взаимодействуя с водой, образует сернистую кислоту: 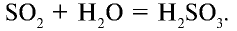
С увеличением количества сернистой кислоты в растворе начинает протекать обратная реакция: 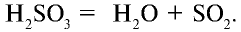
- — Реакции, протекающие при одних и тех же условиях в противоположные стороны, называются обратимыми:
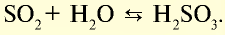
- — Реакция, идущая с образованием новых продуктов, т.е. слева направо, называется прямой, а идущая с образованием исходных продуктов, то есть справа налево, — обратной реакцией.
В обратимых химических реакциях по мере расходования исходных веществ их концентрации в растворе уменьшаются. В результате снижается скорость прямой реакции. И наоборот, за счет увеличения концентрации продуктов, образующихся в течение реакции, увеличивается скорость обратной реакции. Иначе говоря, сколько молекул продукта реакции будет образовываться за единицу времени, столько молекул будет расщепляться.
- — Состояние, когда скорость прямой реакции сравняется со скоростью обратной реакции, называется химическим равновесием. Скорость прямой реакции выражается буквой —
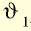 , скорость обратной реакции буквой —
, скорость обратной реакции буквой — 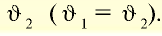
Химическое равновесие может быть нарушено при изменении давления, температуры и концентрации веществ. Катализатор не только не сдвигает химическое равновесие, а наоборот, способствует его быстрейшему установлению. Повышение температуры ускоряет реакции, протекающие с поглощением тепла.
Реакция окисления оксида серы (IV) является обратимой экзотермической реакцией: 
Повышение температуры этой реакции ускоряет обратную реакцию, а понижение температуры ускоряет прямую реакцию.
Увеличение давления сдвигает химическое равновесие в сторону реакции, приводящей к уменьшению объема продукта:
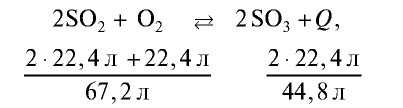
Из расчетов, выполненных на основе уравнения реакции, видно, что в прямой реакции происходит уменьшение объема. Значит, увеличение давления ускоряет прямую реакцию.
Увеличение концентрации одного из веществ в реакции, находящейся в состоянии химического равновесия, приводит к сдвигу химического равновесия в сторону расходования этого вещества. Например, в реакционной среде 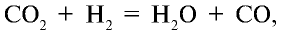 находящейся в состоянии химического равновесия, с увеличением концентрации С02 химическое равновесие сдвигается в сторону прямой реакции, а при повышении концентрации
находящейся в состоянии химического равновесия, с увеличением концентрации С02 химическое равновесие сдвигается в сторону прямой реакции, а при повышении концентрации 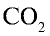 — в сторону обратной реакции.
— в сторону обратной реакции.
Элементы знаний, умений и навыков: обратимая реакция, прямая реакция, обратная реакция, химическое равновесие, сдвиг равновесия, факторы, обусловливающие сдвиг равновесия.
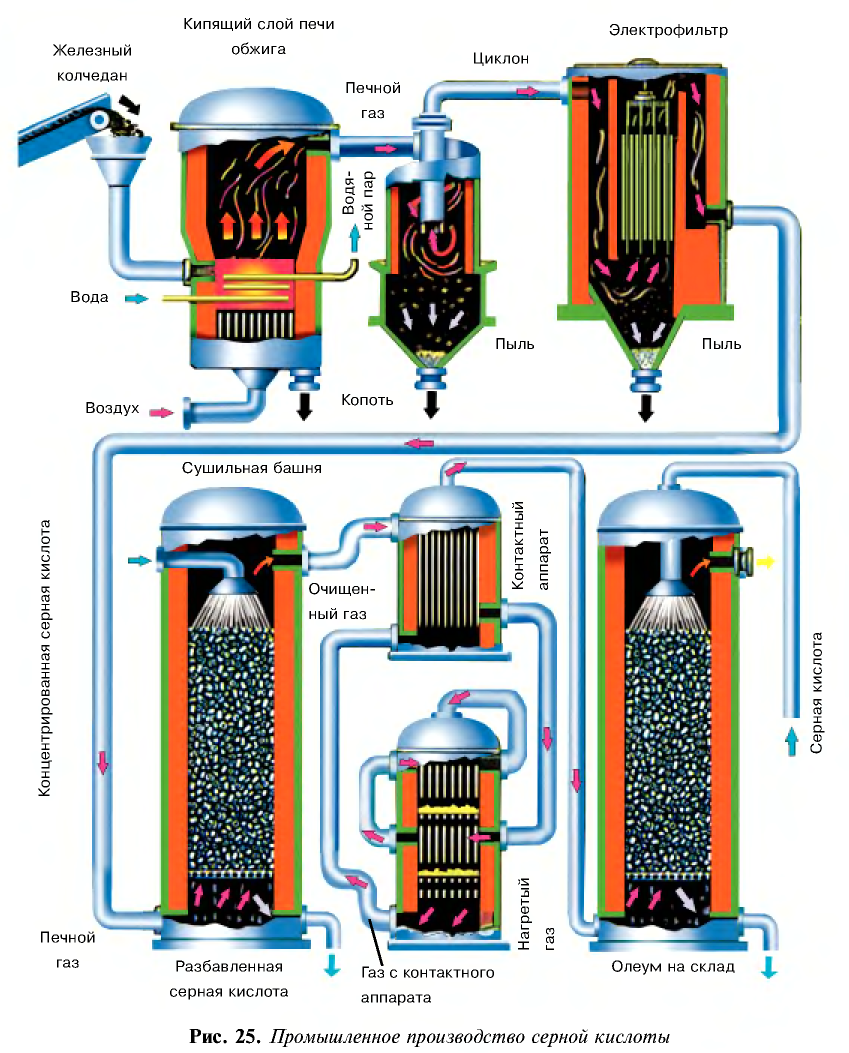
Промышленное производство серной кислоты
Какие катализаторы используются при производстве серной кислоты?
Серная кислота — одно из важнейших неорганических соединений в химической промышленности. Сырьем для промышленного производства серной кислоты служат: чистая сера S, железный колчедан (пирит) 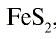 , сульфиды цветных металлов CuS, ZnS, PbS, сульфид водорода
, сульфиды цветных металлов CuS, ZnS, PbS, сульфид водорода 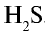 .
.
Процессы промышленного производства серной кислоты, начиная с подготовки сырья и кончая получением готового продукта, подразделяются на несколько этапов.
1. Получение оксида серы (IV). 2. Очистка оксида серы (IV). 3. Окисление оксида серы (IV) и получение оксида серы (VI).
1. Получение оксида серы (IV).
Для получения оксида серы (IV) из имеющегося сырья необходимо осуществить следующие химические реакции:
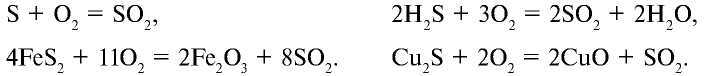
В промышленности для производства 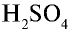 используется пирит. Для обеспечения высокой продуктивности реакции обжига (окисления) пирита необходимо:
используется пирит. Для обеспечения высокой продуктивности реакции обжига (окисления) пирита необходимо:
1) реакции обжига проводить при участии чистого кислорода вместо воздуха. Это позволяет увеличить концентрацию одного из реагирующих веществ — кислорода, а следовательно, и скорость реакции;
2) измельчать частицы пирита, при этом увеличивается поверхность столкновения частиц пирита с кислородом, в результате чего реакция ускоряется. Однако чрезмерное измельчение пирита замедляет реакцию, так как пирит спекается и кислород не может проникнуть в уплотненные слои. Но использование чрезмерно измельченного пирита по принципу противотока также дает хорошие результаты. Пирит засыпается в печь для обжига колчедана (окисление 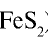 ,) сверху в виде порошка, а воздух подается снизу. Смесь мелких частиц пирита и воздуха называется кипящим слоем. В таких условиях пирит окисляется за очень короткий срок.
,) сверху в виде порошка, а воздух подается снизу. Смесь мелких частиц пирита и воздуха называется кипящим слоем. В таких условиях пирит окисляется за очень короткий срок.
2. Очистка оксида серы (IV). Процесс получения оксида серы (IV) является каталитическим, в качестве катализатора используется оксид ванадия (V)—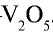 Оксид серы (IV) содержит в своем составе различные примеси и пыль, которые снижают каталитические свойства катализатора. Поэтому
Оксид серы (IV) содержит в своем составе различные примеси и пыль, которые снижают каталитические свойства катализатора. Поэтому 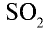 сначала подвергается очистке, затем подается в контактный аппарат. Очистка осуществляется путем пропускания через такие аппараты, как циклон или электрофильтр, затем оксид серы (IV) поступает в сушильную башню для осушки. Для осушки используется концентрированная серная кислота.
сначала подвергается очистке, затем подается в контактный аппарат. Очистка осуществляется путем пропускания через такие аппараты, как циклон или электрофильтр, затем оксид серы (IV) поступает в сушильную башню для осушки. Для осушки используется концентрированная серная кислота.
3. Окисление оксида серы (IV) и получение оксида серы (VI).
Для получения оксида серы (VI) из оксида серы (IV) последний окисляется в присутствии катализатора:
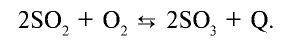
Реакция является экзотермической, и при 400°С выход оксида серы (VI) составляет 99,2%. С повышением температуры выход продукта уменьшается, например, при 600°С он составляет лишь 73%.
Теплота, выделяющаяся в ходе реакции, расходуется на нагревание 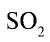 в теплообменнике.
в теплообменнике.
Для выбора оптимальных условий окисления оксида серы (IV) необходимо подобрать факторы, позволяющие сдвинуть равновесие обратимой реакции вправо.
1. Температура. Для увеличения выхода оксида серы (VI) температуру реакции следует постепенно понижать с 600°С до 400—450°С .
2. Катализатор. Катализатором могут служить оксиды железа, платины и ванадия. К катализаторам предъявляются следующие требования: а) низкая цена; б) устойчивость к каталитическим донорам; в) долговечность. В настоящее время в качестве катализатора используется оксид ванадия (V).
3. Оксид серы (IV), поступающий в контактный аппарат, должен быть осушен от водяных паров и очищен от различных твердых частиц и пыли, повреждающих катализатор. Оксид серы (IV), осушенный от водяного пара и очищенный от пыли и различных примесей, в смеси с воздухом поступает в теплообменник, где он нагревается до определенной температуры, а оттуда в контактный аппарат, где он окисляется до 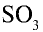 .
.
Образовавшийся в контактном аппарате и охлажденный в теплообменнике оксид серы (VI) подается в поглотительную башню.
Гидратация оксида серы (VI), то есть получение серной кислоты.
В поглотительной башне из оксида серы (VI) получается серная кислота, для чего 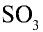 вступает во взаимодействие с водой. В результате этого взаимодействия серная кислота образуется в виде мельчайших капель, которые затуманивают поглотительную башню. Этот сернокислотный туман трудно конденсируется, поэтому в поглотительной башне
вступает во взаимодействие с водой. В результате этого взаимодействия серная кислота образуется в виде мельчайших капель, которые затуманивают поглотительную башню. Этот сернокислотный туман трудно конденсируется, поэтому в поглотительной башне 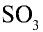 поглощается с помощью серной кислоты 98 %-ной концентрации. Вода, содержащаяся в концентрированной
поглощается с помощью серной кислоты 98 %-ной концентрации. Вода, содержащаяся в концентрированной 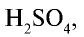 , гидратирует
, гидратирует 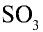 :
:
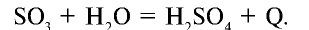
Затем обезвоженная 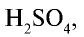 поглощает
поглощает 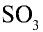 и образует соединение, называемое олеумом:
и образует соединение, называемое олеумом:
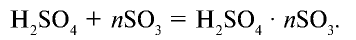
Процесс промышленного производства серной кислоты является непрерывным (рис. 25).
Элементы знаний, умений и навыков: сырье, обжиг пирита, кипящий слой, контактный аппарат, теплообменник, олеум.
Пример:
Во сколько раз увеличится скорость реакции, если коэффициент скорости равен 3, а температура повышена с 50°С до 70°С? При первоначальной температуре (50°С) реакция завершается за 2 мин 15 с, за какое время она завершится при 70°С?
Решение:
1) увеличение скорости реакции (при переходе от 50°С к 70°С) найдем согласно правилу Вант-Гоффа:
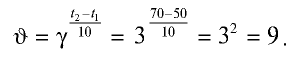
Скорость химической реакции увеличится в 9 раз;
2) при начальной температуре 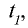 то есть при 50°С реакция завершается за 2 мин 15 с (135 секунд), при температуре
то есть при 50°С реакция завершается за 2 мин 15 с (135 секунд), при температуре 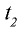 — за время, большее в 9 раз.
— за время, большее в 9 раз.
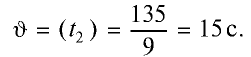
Ответ. 15 с.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |