
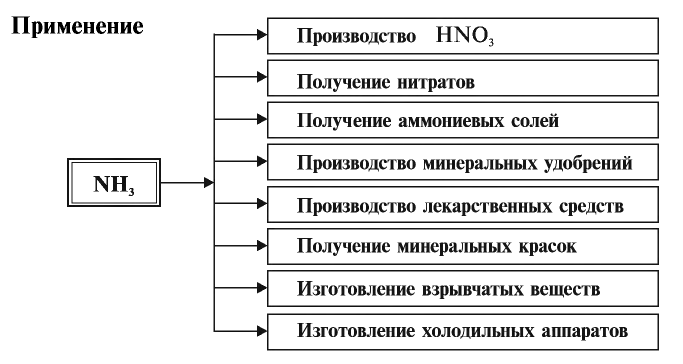
Подгруппа азота в химии - формулы и определения с примерами
Содержание:
Характеристика элементов подгруппы азота:
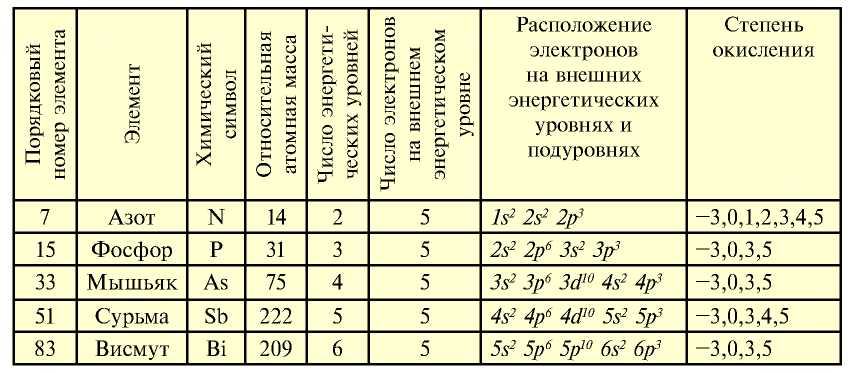
К подгруппе азота относятся элементы основной подгруппы пятой группы периодической таблицы — азот N, фосфор Р, мышьяк As, сурьма Sb и висмут Bi (табл. 24). На внешнем энергетическом уровне атомов этих элементов имеется пять электронов, расположенных на энергетических подуровнях следующим образом — 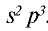
Электроны внешнего энергетического уровня в возбужденном состоянии (кроме азота) имеют вид 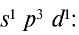
При возбужденном состоянии электронов на внешнем энергетическом уровне атомы этих элементов отдают пять электронов атомам элементов с большей электроотрицательностью и проявляют степень окисления +5.
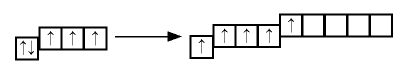
В связи с отсутствием на внешнем электронном слое атома азота d-орбитали электроны внешнего энергетического уровня находятся в состоянии 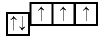 . Электронная конфигурация имеет вид
. Электронная конфигурация имеет вид 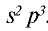 Такое строение внешнего электронного слоя атома азота позволяет получать соединения с особым типом связи.
Такое строение внешнего электронного слоя атома азота позволяет получать соединения с особым типом связи.
Таблица:
Свойства элементов подгруппы азота
Азот
Почему азот и кислород, входящие в состав воздуха, не реагируют между собой?
Строение молекулы азота. Молекула азота состоит из двух атомов, связанных между собой неполярной ковалентной связью.
Молекулярная формула: 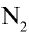 , структурная формула:
, структурная формула: 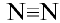 , электронная формула:
, электронная формула: 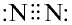 (рис. 26).
(рис. 26).
Распространение в природе: В природе азот встречается как в свободном состоянии, так и в виде соединений. В свободном состоянии он составляет основную часть воздуха. Объемная доля азота в воздухе равна 78%, массовая доля 75,5%.
В виде соединений, в частности в виде 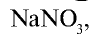 , встречается на территории Чили. Поэтому соединение
, встречается на территории Чили. Поэтому соединение 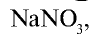 называется еще чилийской селитрой. Азот входит в состав почвы в виде различных нитратов.
называется еще чилийской селитрой. Азот входит в состав почвы в виде различных нитратов.
Белки — жизненно важные для всех живых организмов вещества, также являются природными соединениями азота.
Получение: В лабораторных условиях азот получают путем пропускания аммиака над нагретым оксидом меди (II):
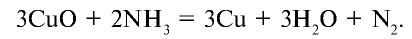
В промышленности основным сырьем для получения азота является воздух. Воздух сжижают путем охлаждения и постепенно испаряют. При этом первым выделяется азот, так как его температура кипения (196°С) выше, чем температура кипения кислорода (183°С). После выделения азота из сжиженного воздуха, остается кислород. Следовательно, в этом технологическом процессе можно получать и азот, и кислород.
Физические свойства: Азот — газ без цвета, запаха и вкуса, мало растворимый в воде. В одном объеме воды растворяется 0,0154 объема азота. Температура плавления азота —210°С, температура кипения —196°С.
Химические свойства: В молекуле азота два атома, связанных друг с другом за счет трех пар электронов неполярной ковалентной связью. Поэтому азот считается химически инертным (неактивным) веществом.
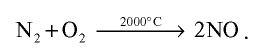
При высокой температуре, например, при температуре образования электрической дуги, азот реагирует с кислородом и образует оксид азота (II):
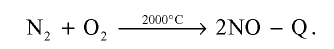
Атмосферный азот, окисляясь под влиянием электрического разряда, возникающего во время грозы, также образует оксид азота (II).
В присутствии катализатора под влиянием высокого давления и температуры азот реагирует с водородом:

При нормальных условиях азот взаимодействует только с литием:
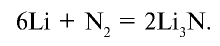
Со всеми другими металлами в нормальных условиях азот не реагирует. Например, он взаимодействует с магнием при нагревании:
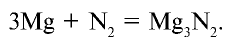
Соединения азота с металлами называются нитридами, например, 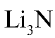 — нитрид лития,
— нитрид лития, 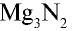 — нитрид магния.
— нитрид магния.
Водородные соединения азота
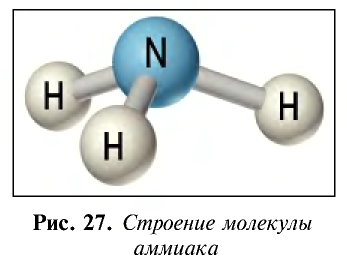
Строение молекулы: Азот образует с водородом ряд соединений. Самым важным с практической точки зрения водородным соединением азота является аммиак. Его молекулярная формула  , структурная формула:
, структурная формула: 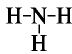 , электронная формула:
, электронная формула: 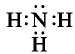 .
.
Ввиду электроотрицательности азота относительно водорода молекула аммиака является полярной (рис. 27).
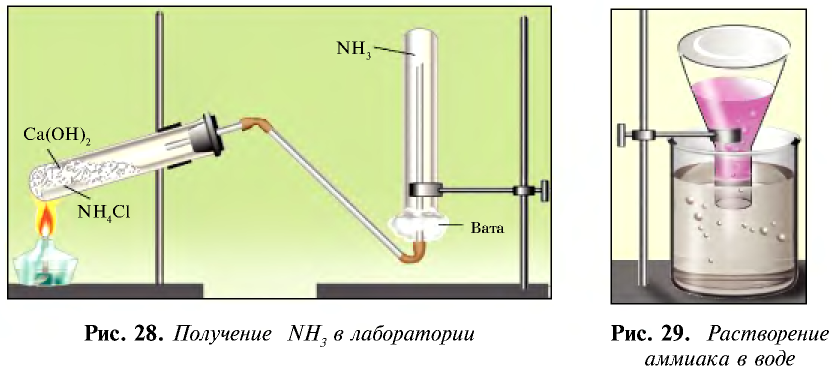
Получение: 1. В лабораторных условиях аммиак получают путем воздействия щелочью на соли аммония (рис. 28):
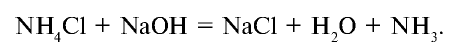
Кроме того, аммиак можно получить также с помощью накаливания смеси соли хлорида аммония и гашеной извести:
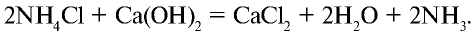
2. В промышленности аммиак получают в результате взаимодействия азота, аммиака выделенного из атмосферного воздуха, с водородом, полученным путем электролиза воды:
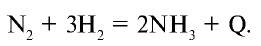
В нормальных условиях азот и водород в смеси не вступают в реакцию. Реакция взаимодействия азота с водородом является обратимой, поэтому чтобы сдвинуть химическое равновесие вправо (в сторону образования  ) необходимо:
) необходимо:
- увеличить давление;
- понизить температуру до определенного значения, так как при низкой температуре может уменьшиться продуктивность реакции;
- использовать катализаторы. Для данной реакции в качестве катализатора могут быть взяты
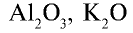 и железная смесь.
и железная смесь.
Физические свойства: Аммиак — бесцветный газ с резким запахом, в 1,7 раз легче воздуха. Аммиак очень хорошо растворим в воде (рис. 29). В одном объеме воды растворяется 700 объемов аммиака.
Химические свойства: При растворении аммиака в воде образуется гидроксид аммония (нашатырный спирт): 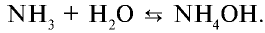
В этой реакции аммиак присоединяет ион Н+ молекулы воды (протон) и образует ион аммония  . Молекула воды, утратившая ион Н+, превращается в ион гидроксида ОН¯. В результате среда раствора становится щелочной:
. Молекула воды, утратившая ион Н+, превращается в ион гидроксида ОН¯. В результате среда раствора становится щелочной:
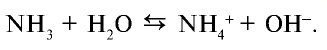
Образование иона аммония основано на механизме донорно-акцепторной связи. В молекуле аммиака имеется свободная электронная пара, а ион водорода имеет свободную орбиталь. При столкновении молекулы аммиака с ионом водорода свободная электронная пара азота становится общей для атомов азота и водорода:
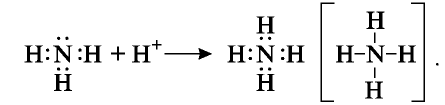
В ионе аммония азот становится четырехвалентным, степень окисления остается неизменной, то есть —3.
Аммиак взаимодействует и с кислотами, образуя соли. Эти реакции также протекают по донорно-акцепторному механизму. Ионы водорода, отделившиеся от молекул кислот, образуют ковалентную связь за счет свободных электронных пар в молекуле аммиака и превращаются в ионы аммония:
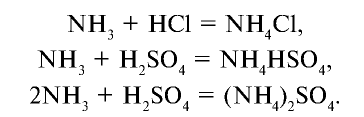
При высокой температуре аммиак распадается на азот и водород:
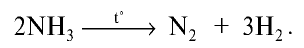
При горении аммиака в кислороде образуются азот и вода (рис.30):
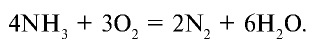
Если реакция горения протекает в присутствии платинового катализатора, то образуется оксид азота (II) (рис. 31):
Соли аммония: Сложные вещества, образованные из ионов аммония и кислотного остатка, называются солями аммония.
Все соли аммония — хорошо растворимые в воде вещества, обладающие следующими свойствами.
1. Распадаются при сильном нагревании:
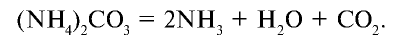
2. Выделяют аммиак под воздействием щелочей:
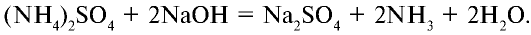
Эта реакция специфична для солей аммония.
Кислородные соединения азота
Почему оксид азота (II) считается инертным, а оксид азота (IV) — кислотным?
В нормальных условиях азот не взаимодействует с кислородом. Существует ряд его оксидов, полученных косвенными путями:
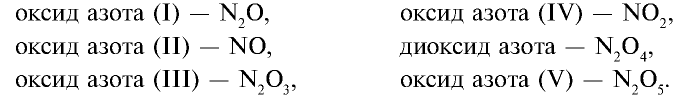
Оксид азота (II) — NO — газ без цвета и запаха, мало растворимый в воде. При 0°С в одном объеме воды растворяется 0,7 объема N0. Температура плавления —163,6°С, температура кипения —154,8°С. В природе оксид азота (II) образуется при электрических и грозовых разрядах, поэтому соединения азота, хотя и в незначительных количествах, встречаются в составе дождевых вод, выпадающих в весенние месяцы:
Оксид азота (II) инертен, не образует солей. В промышленности получается путем каталитического окисления аммиака. В лабораторных условиях этот оксид получается путем воздействия на медь разбавленной азотной кислотой:
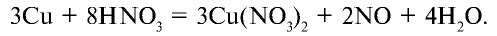
При нормальных условиях оксид азота (II) вступает во взаимодействие с кислородом воздуха и образует оксид азота (IV) 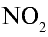 :
:
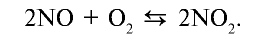
Оксид азота (IV) — 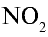 — удушливый газ красновато-бурого цвета с резким запахом, ядовит. Он хорошо растворяется в воде. Температура кипения —21,3°С, при —9,3°С образует бесцветные кристаллы. В лабораторных условиях оксид азота (IV) получают путем воздействия на медь концентрированной азотной кислотой:
— удушливый газ красновато-бурого цвета с резким запахом, ядовит. Он хорошо растворяется в воде. Температура кипения —21,3°С, при —9,3°С образует бесцветные кристаллы. В лабораторных условиях оксид азота (IV) получают путем воздействия на медь концентрированной азотной кислотой:
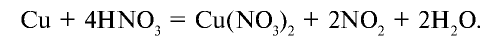
В промышленности 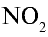 получают с помощью окисления оксида азота (II). Оксид азота (IV) является кислотным и, растворяясь в воде, образует азотную и азотистую кислоты:
получают с помощью окисления оксида азота (II). Оксид азота (IV) является кислотным и, растворяясь в воде, образует азотную и азотистую кислоты:
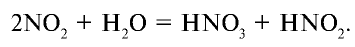
Азотная кислота
Молекулярная формула азотной кислоты —  . На втором энергетическом уровне атома азота (внешний энергетический уровень) не имеется d-энергетического подуровня. Электронная пара
. На втором энергетическом уровне атома азота (внешний энергетический уровень) не имеется d-энергетического подуровня. Электронная пара 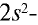 энергетического подуровня не возбуждается. Хотя азот находится в пятой группе, он не может быть пятивалентным. Высшая валентность азота — 4. Исходя из этого структурную формулу азотной кислоты можно представить в следующем виде:
энергетического подуровня не возбуждается. Хотя азот находится в пятой группе, он не может быть пятивалентным. Высшая валентность азота — 4. Исходя из этого структурную формулу азотной кислоты можно представить в следующем виде:
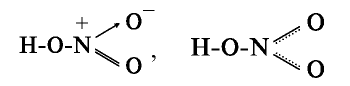
Таким образом, в азотной кислоте азот четырехвалентен, степень его окисления равна +5.
Получение. До начала XX в. азотную кислоту получали путем воздействия на чилийскую селитру (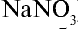 ) концентрированной серной кислотой. В настоящее время этот способ используется для получения азотной кислоты в лабораторных условиях:
) концентрированной серной кислотой. В настоящее время этот способ используется для получения азотной кислоты в лабораторных условиях:
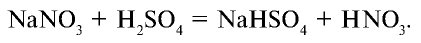
В промышленности азотная кислота получается из аммиака. Данный процесс осуществляется в три этапа (рис. 32).
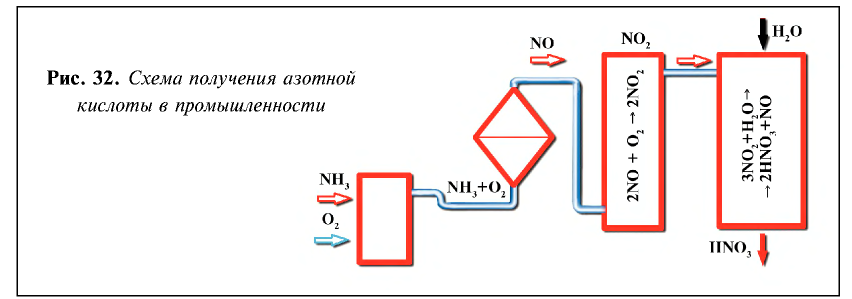
1. Окисление аммиака в присутствии катализатора 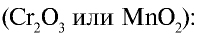
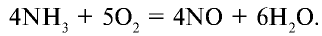
2. Окисление оксида азота (II) и получение оксида азота (IV):
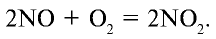
3. Поглощение оксида азота (IV) водой при участии кислорода:
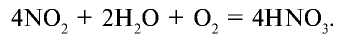
Физические свойства: Чистая азотная кислота — бесцветная жидкость с резким запахом, плотность ее 1,5 г/см3. Кристаллизуется при —41°С. Хорошо растворяется в воде.
Химические свойства: Азотная кислота — одноосновная сильная кислота, полностью диссоциирующая в разбавленных растворах:
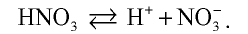
Азотная кислота неустойчивая, может расщепляться под воздействием света и тепла:
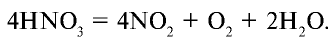
Как и другие кислоты, азотная кислота вступает во взаимодействие с оксидами, солями и металлами:
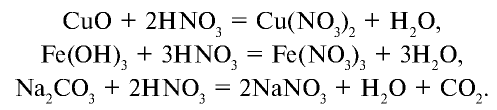
Влияние азотной кислоты на металлы отличается от влияния других кислот. В зависимости от концентрации азотной кислоты и активности металла она восстанавливается до следующих веществ:
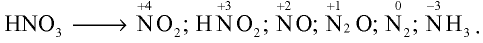
1. При взаимодействии с пассивными металлами, например Сu и Рb (а и б), концентрированная азотная кислота образует газ 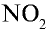 , а разбавленная азотная кислота — N0 (в).
, а разбавленная азотная кислота — N0 (в).
2. С активными металлами, например, Mg, Zn и Fe (r) концентрированная азотная кислота реагирует по-разному:
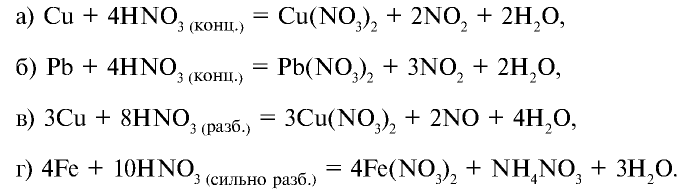
Смесь, состоящая из 1 моля азотной кислоты и 3 молей соляной кислоты, называется "царской водкой". Царская водка является окислителем и может растворить даже очень пассивные металлы — золото и платину:
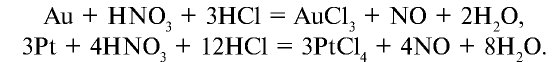
Древесная стружка и органические вещества (скипидар) в азотной кислоте возгораются и горят ярким пламенем (рис. 33).
При работе с концентрированной азотной кислотой следует соблюдать большую осторожность, так как, попадая на кожу человека, она образует язвы.
Соли азотной кислоты
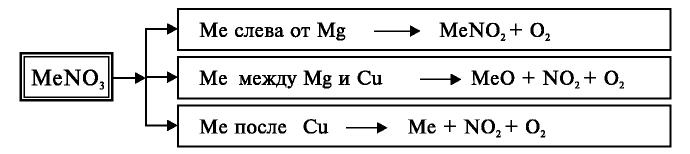
Соли азотной кислоты называются нитратами. Нитраты получают в основном при взаимодействии азотной кислоты с металлами, оксидами металлов, карбонатами щелочных и щелочноземельных металлов. Нитрат аммония получают при взаимодействии аммиака и азотной кислоты:
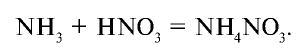
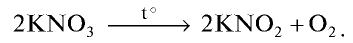
Все нитраты — хорошо растворимые в воде вещества. При нагревании нитраты расщепляются. Нитраты металлов, расположенных в ряду активности левее магния, расщепляются с образованием нитритов и кислорода:
Нитраты металлов, расположенных в ряду активности между магнием и медью, расщепляются с образованием оксидов металлов, оксида азота (IV) и кислорода:
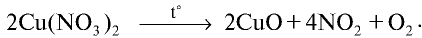
Нитраты металлов, расположенных в ряду активности после меди, расщепляются с образованием металла, оксида азота (IV) и кислорода:
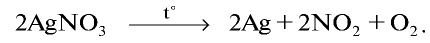
Расщепление нитратов можно выразить следующей общей схемой:
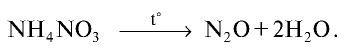
При расщеплении нитрата аммония образуется оксид азота (I):
Для определения солей азотной кислоты необходимо установить наличие нитрат-иона 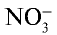 в ее составе. С этой целью соль нитрата нагревают с концентрированной серной кислотой и затем добавляют медь. Образование в результате реакции газа бурого цвета —
в ее составе. С этой целью соль нитрата нагревают с концентрированной серной кислотой и затем добавляют медь. Образование в результате реакции газа бурого цвета — 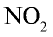 указывает на то, что определяемая соль — нитрат:
указывает на то, что определяемая соль — нитрат:
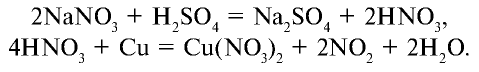
Нитраты применяются в основном в сельском хозяйстве в качестве минеральных удобрений.
Пример:
Какое количество нитрата аммония образуется и какое вещество полностью расходуется при пропускании 156,8 м3 аммиака через 1 т 44,982%-ного раствора азотной кислоты?
Решение:
1) найдем количество вещества в 156,8 м3 (156800 л) аммиака:
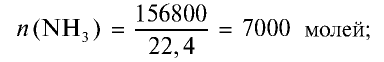
2) найдем массу азотной кислоты и количество вещества в 1 т 44,982%-ного раствора:

3) при взаимодействии 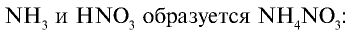
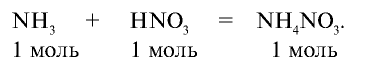
Из уравнения реакции видно, что при взаимодействии 1 моля 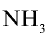 с 1 молем
с 1 молем 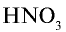 образуется 1 моль
образуется 1 моль 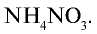
Из условия задачи видно, что 1 моль аммиака, взаимодействуя с 1 молем азотной кислоты, образует 1 моль нитрата аммония. 7000 молей 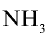 взаимодействуют с 7000 молей азотной кислоты (7140—7000=140 молей). 140 молей
взаимодействуют с 7000 молей азотной кислоты (7140—7000=140 молей). 140 молей 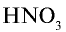 остаются в излишке и образуются 7000 молей
остаются в излишке и образуются 7000 молей 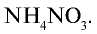 ;
;
4) найдем массу 7000 молей 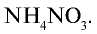 :
:
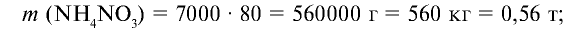
5) найдем массу оставшегося 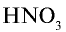 :
:
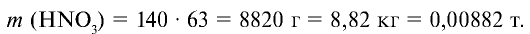
Ответ: образуется 560 кг (0,56 т) нитрата аммония и 8,82 кг (0,00882 т) азотной кислоты остается в избытке.
Пример:
Сколько тонн аммиака потребуется для производства 5 т 60%-ной азотной кислоты, учитывая то, что в производстве 2,8% аммиака растрачиваются без пользы?
Решение:
1) вычислим массу 5 т 60%-ной азотной кислоты:
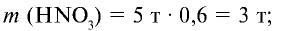
2) определим, какое количество аммиака теоретически потребуется для получения 3 т азотной кислоты. Азотная кислота получается из аммиака по следующем реакциям:
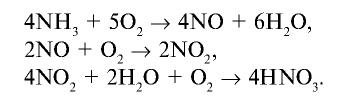
Запишем все три реакции в виде схемы:
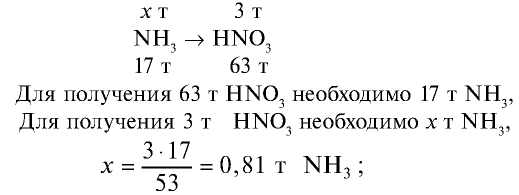
3) какое количество аммиака надо взять с учетом того, что 2,8% аммиака расходуются впустую? Значит, для получения 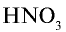 , потребуется 97,2% аммиака.
, потребуется 97,2% аммиака.
100 т аммиака расходуются на получение 97,2 т 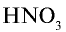 ,
,
х т аммиака на получение 0,81 т 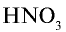
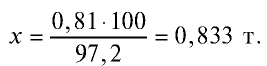
Ответ: потребуется 0,833 т аммиака.
Фосфор
Фосфор, как и азот, находится в основной подгруппе пятой группы периодической таблицы химических элементов. Его валентные электроны расположены на 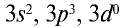 энергетических подуровнях внешнего энергетического уровня:
энергетических подуровнях внешнего энергетического уровня:
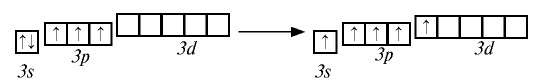
Фосфор проявляет степени окисления —3, 0, +3, +5. В природе встречаются в основном соединения фосфора со степенью окисления +5.
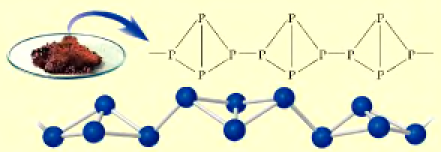
Распространение в природе: В силу своей химической активности фосфор встречается в природе только в виде соединений.
Фосфориты и апатиты — природные соединения фосфора, в состав которых входит 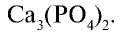
Фосфор содержится также в составе живых организмов и очень важен для жизни.
Белки и нуклеиновые кислоты являются органическими фосфорными соединениями. Неорганический составной компонент костной ткани человека и животных представлен в основном фосфатом кальция 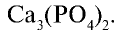
Получение: Фосфор получают в электрических печах из фосфорита или апатита путем их нагревания без доступа воздуха в присутствии оксида кремния (IV) и кокса:
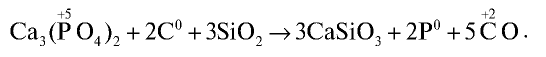
Полученные в реакции пары фосфора конденсируются водой в специальной камере. По составу собранное вещество представляет собой белый фосфор с химической формулой 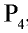 , светящийся в темноте.
, светящийся в темноте.
Физические свойства: В свободном состоянии фосфор образует несколько аллотропических модификаций, например, белый и красный фосфор. Различия в физических свойствах белого и красного фосфора (табл. 25) обусловлены порядком связи атомов в их молекулах.
Таблица 25
Физические свойства белого и красного фосфора
| Свойство | Белый фосфор | Красный фосфор |
| Молекулярное строение | 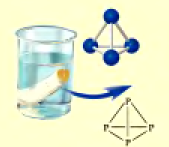 |
 |
| Агрегатное состояние | Кристаллическое | Порошкообразное |
| Цвет | Бесцветный | Темно-красный |
| Запах | Чесночный | Без запаха |
| Растворимость в воде | Нерастворим | Нерастворим |
Растворимость в  |
Хорошая растворимость | Нерастворим |
| Плотность, г/см3 | 1,8 | 2,3 |
| Температура плавления,°С | 44 | Превращается в белый фосфор не расплавляясь |
| Свечение | Светится в темноте | Не светится |
| Воздействие на организм | Ядовит | Не ядовит |
| Кристаллическая решетка | Молекулярная | Атомная |
Под воздействием света и температуры белый фосфор переходит в красный. А красный фосфор без доступа воздуха образует пары белого фосфора. Конденсируясь, пары превращаются в белый фосфор.
Химические свойства: Белый фосфор — химически активное вещество, способное непосредственно соединяться с кислородом, галогенами, серой и некоторыми металлами:
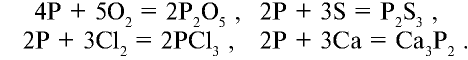
Взаимодействуя с водородом, белый фосфор образует фосфин 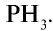 Фосфин, хотя и похож на аммиак, но является неустойчивым соединением:
Фосфин, хотя и похож на аммиак, но является неустойчивым соединением:
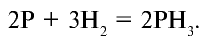
Применение: Красный фосфор служит основным сырьем в производстве спичек.
Красный фосфор, нанесенный на боковое ребро спичечного коробка, мгновенно возгорается, вступая в реакцию с бертолетовой солью, нанесенной на спичечную головку:
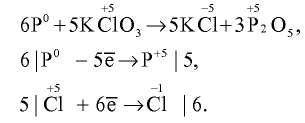
Кислородные соединения фосфора
При сгорании фосфора в присутствии достаточного количества кислорода образуется оксид фосфора (V) состава 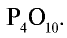 . Упрощенно его можно записать
. Упрощенно его можно записать 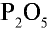 :
:
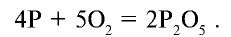
Оксид фосфора (V) — белое гигроскопическое (впитывающее воду) вещество, хорошо растворимое в воде. В нормальных условиях при растворении 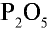 . в воде образуется метафосфорная кислота:
. в воде образуется метафосфорная кислота:
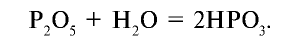
При проведении реакции под воздействием температуры образуется ортофосфорная кислота:
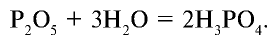
Иначе говоря, метафосфорная кислота, образовавшаяся в первой реакции, взаимодействуя с водой под воздействием температуры, образует ортофосфорную кислоту:
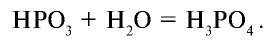
При медленном нагревании ортофосфорной кислоты образуется пирофосфатная кислота:
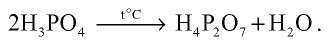
Среди кислот ортофосфорная кислота является самой важной с практической точки зрения.
В лабораторных условиях ортофосфорную (фосфорную) кислоту получают при взаимодействии ортофосфата кальция с концентрированной серной кислотой:
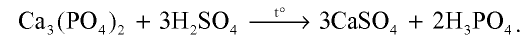
Эту кислоту можно получить также путем сжигания фосфора в достаточном количестве кислорода, нагревания образовавшегося 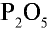 и последующего воздействия на него водой:
и последующего воздействия на него водой:
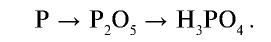
Ортофосфорная кислота — 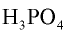 —бесцветное кристаллическое вещество, хорошо растворимое в воде. Плавится при 42,3°С . Поскольку ортофосфорная кислота трехосновная, она диссоциирует в три этапа:
—бесцветное кристаллическое вещество, хорошо растворимое в воде. Плавится при 42,3°С . Поскольку ортофосфорная кислота трехосновная, она диссоциирует в три этапа:
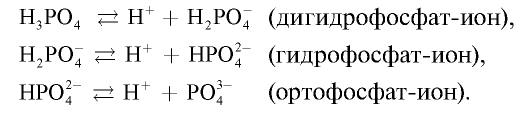
Так как при ее диссоциации образуются три вида ионов, она образует три ряда солей.
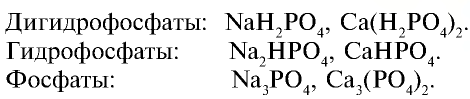
Ортофосфорная кислота вступает в реакции, присущие всем кислотам:
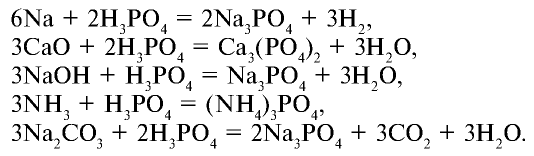
При взаимодействии с нитратом серебра образуется специфический желтый осадок:
Соли ортофосфорной кислоты
Таблица 26
Соли ортофосфорной кислоты
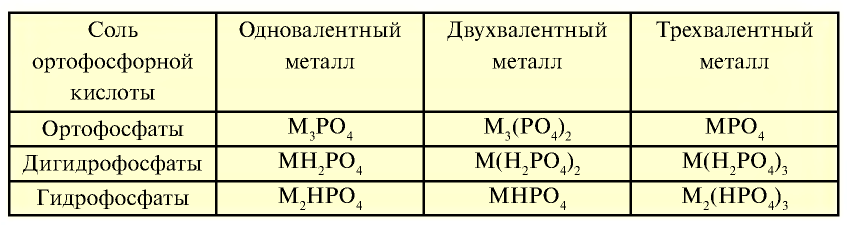
Вместо металла в соединении может быть ион аммония

Фосфаты щелочных металлов и фосфиты аммония также растворяются в воде. Фосфат кальция не растворяется в воде, но растворяется в сильных кислотах:
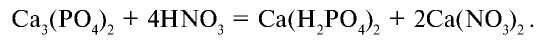
Биологическое значение фосфора и его соединений: Академик А.Ю.Ферсман называл фосфор "элементом жизни и мышления". Действительно, фосфор, как и азот, углерод, водород и другие элементы, составляет основу всех живых организмов. Так, неорганический компонент костной ткани человека и животных представлен фосфатом кальция 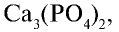 , который обеспечивает прочность и твердость костей.
, который обеспечивает прочность и твердость костей.
С помощью соединения фосфора аденозинтрифосфата (АТФ) осуществляется энергетический обмен в живых организмах. Суточная потребность человека в фосфоре составляет примерно 2 г.
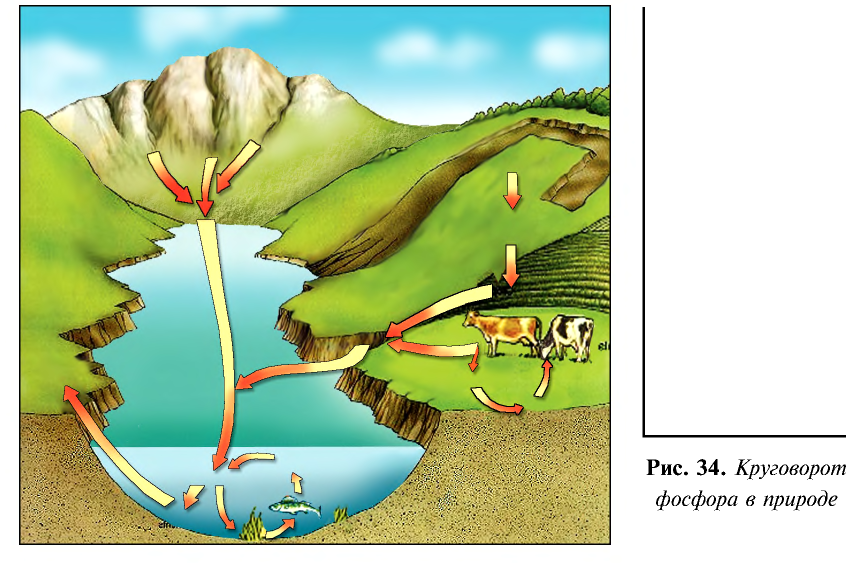
Потребность человека в фосфоре удовлетворяется за счет растений, продуктов животноводства и птицеводства. Растения в свою очередь получают фосфор из фосфорных удобрений почвы.
Круговорот фосфора в природе представлен на рис. 34.
Минеральные удобрения
Значение минеральных удобрений в сельском хозяйстве. В получении высоких урожаев сельскохозяйственных растений велика роль минеральных удобрений. Для нормальной жизнедеятельности растений необходимы такие элементы, как углерод, водород, кислород, азот, фосфор, калий, кальций, магний, железо, особенно важно среди них значение азота, фосфора и калия. Установлено, что в химический состав растений входит около 70 элементов периодической таблицы. Одни из них необходимы растениям в большем количестве, другие — в меньшем.
Элементы, необходимые для растений в большем количестве, называются макроэлементами, а необходимые в меньшем количестве — микроэлементами.
- Макроэлементы: С, О, Н, N, Р, S, Mg, К, Са.
- Микроэлементы: Fe, Мn, В, Сu, Zn, Mo, Co.
Учитывая, что удобрения, включающие азот, фосфор и калий, необходимы для растений в больших количествах, их следует в основном выпускать в виде, легко усвояемом растениями.
При недостатке в почве азота задерживается рост и развитие растений. Листья растений приобретают светло-зеленый, даже желтый оттенок, что свидетельствует о нарушении процесса фотосинтеза. Это в свою очередь приводит к резкому снижению урожайности растений. Фосфор входит в состав веществ, участвующих в окислительно-восстановительных процессах, и способствует росту и развитию растений.
Калий ускоряет процесс фотосинтеза в растениях, усиливает накопление углеводов, например, сахара в сахарной свекле, крахмала в картофеле, целлюлозы в хлопковом волокне хлопчатника. Калий укрепляет стебли растений.

Немецкий ученый, заложивший основы науки агрохимии, предложивший теорию минеральной подкормки растений, а также рекомендации по повышению урожайности сельскохозяйственных растений путем внесения в почву минеральных удобрений.
Железо ускоряет процессы усвоения растениями азота, фосфора и калия. Медь, цинк и марганец интенсифицируют окислительно-восстановительные процессы. Растения усваивают макро- и микроэлементы в виде ионов.
Вещества, способные расщепляться на ионы 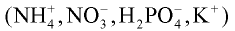 в почвенных растворах, называются минеральными удобрениями. От правильного использования минеральных удобрений зависит повышение урожайности сельскохозяйственных растений. Необходимо точно знать, когда, как и в каком количестве следует вносить удобрения, так как их избыточные количества накапливаются в организме растений. Урожай, полученный от таких растений, непригоден к употреблению. В зависимости от питательных элементов, входящих в состав минеральных удобрений
в почвенных растворах, называются минеральными удобрениями. От правильного использования минеральных удобрений зависит повышение урожайности сельскохозяйственных растений. Необходимо точно знать, когда, как и в каком количестве следует вносить удобрения, так как их избыточные количества накапливаются в организме растений. Урожай, полученный от таких растений, непригоден к употреблению. В зависимости от питательных элементов, входящих в состав минеральных удобрений 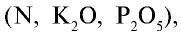 они подразделяются на простые и комплексные (табл. 27).
они подразделяются на простые и комплексные (табл. 27).

Академик Академии наук Республики Узбекистан, проводивший крупные исследования в области химии и технологии удобрений. Под его руководством получены новые комплексные удобрения путем обработки фосфоритов а зотной кислотой. Им бьпи изучены источники сырья для производства фосфорных и калийных удобрений в Узбекистане, разработана технология производства суперфосфата на основе фосфатов, проводились исследования с целью получения и производства малотоксичных дефолиантов. М.Н.Набиев — лауреат Государственной премии имени Абу Райхана Беруни.
Таблица 21
Минеральные удобрения:
| Удобрение | Химический состав | Количество питательного элемента, % | Агрегатное состояние |
| Азотные удобрения (питательный элемент N) | |||
| Азотные удобрения (питательный элемент N) | 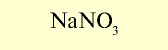 |
15-16 | Гигроскопическое вещество белого и серого цвета, хорошо растворимое в воде |
| Нитрат натрия (натриевая селитра) | 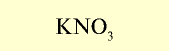 |
12-13 | Кристаллическое вещество белого цвета, хорошо растворимое в воде |
| Нитрат аммония (аммиачная селитра) | 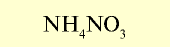 |
30-35 | Кристаллы белого цвета. Сильно гигроскопическое вещество |
| Сульфат аммония | 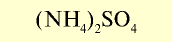 |
20-21 | Порошок серого или светло-зеленого цвета. Гигроскопическое вещество |
| Карбамид (мочевина) | 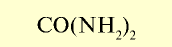 |
46 | Гранулы белого цвета. Гигроскопическое вещество |
Фосфорные удобрения (питательный элемент 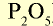 ) ) |
|||
| Простой суперфосфат | 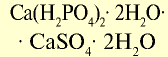 |
20 | Мелкий гранулированный порошок серого цвета |
| Двойной суперфосфат | 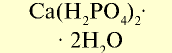 |
40 | Мелкий гранулированный порошок серого цвета |
Калийные удобрения (питательный элемент 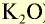 ) ) |
|||
| Хлорид калия | KCl | 52-60 | Мелкое кристаллическое вещество белого цвета |
| Сложные удобрения | |||
| Дигидрофосфат аммония | 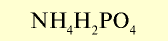 |
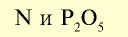 |
Кристаллическое вещество белого цвета |
| Гидрофосфат аммония | 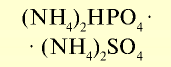 |
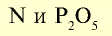 |
Кристаллическое вещество белого цвета (в смесях становится серым) |
В состав простых минеральных удобрений входит только один питательный элемент 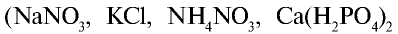 и др.), в состав комплексных — два или три питательных элемента (
и др.), в состав комплексных — два или три питательных элемента ( и др.).
и др.).
- — "Agro" в переводе с греческого означает "поле", слово "агрохимия" означает буквально "полевая химия ". (ф— В 1840 г. немецкий химик Ю.Либих в своей книге о внедрении химии в земледелие разъяснял необходимость для питания растений веществ, содержащих N, Р, К и другие элементы,
- — Агрохимики — это специалисты, изучающие химический состав почвы. Почва — это постоянно изменяющаяся структура, имеющая сложный состав.
Основные минеральные удобрения
Азотные минеральные удобрения: Растения усваивают азот в связанном виде. Запасы азота в почве постоянно пополняются за счет азотных соединений, образующихся в результате гниения органических остатков в почве, усвоения азота воздуха почвенными бактериями, окисления азота воздуха во время грозы. Однако значительное количество азота уходит из почвы во время уборки сельскохозяйственных посевов. Недостаток азота в почве оказывает отрицательное влияние на рост и развитие растений, поэтому почву удобряют рядом азотсодержающих удобрений. Среди них самые ценные 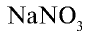 — натриевая селитра,
— натриевая селитра, 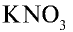 — калиевая селитра,
— калиевая селитра, 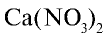 — кальциевая селитра,
— кальциевая селитра, 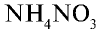 — аммиачная селитра,
— аммиачная селитра, 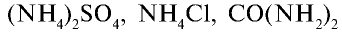 — мочевина, жидкий аммиак и аммиачная вода (табл. 28).
— мочевина, жидкий аммиак и аммиачная вода (табл. 28).
Таблица 28
Питательные элементы в некоторых минеральных удобрениях
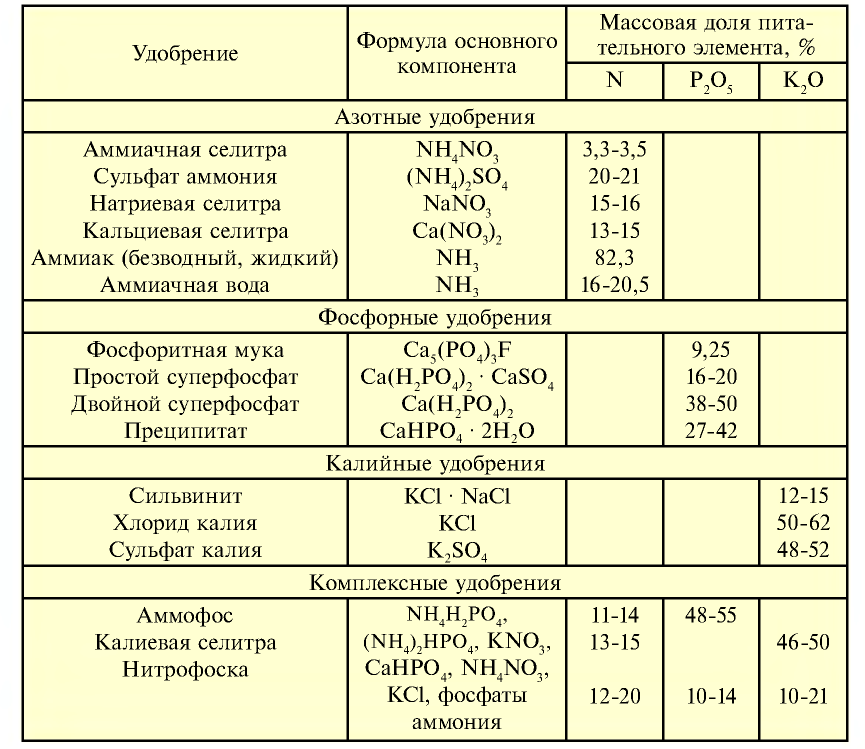
Природные запасы нитратов весьма незначительны, самые большие запасы соединений азота в виде нитрата натрия имеются в Южной Америке на территории Чили. Основная часть азотных удобрений производится на химических заводах. Например, на Чирчикском электрохимическом комбинате, на предприятиях "Азот" в Фергане и "Навоиазот" в Навои выпускаются минеральные удобрения, в частности нитраты, которые используются для повышения урожайности сельскохозяйственных культур. Питательный элемент в составе азотных удобрений определяется массовой долей азота, содержащегося в них.
Пример: Определите количество питательного элемента в составе натриевой селитры.
Решение:
1) запишем формулу нитрата натрия и определим его молекулярную массу.
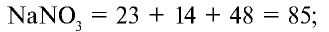
2) вычислим процентное количество азота:
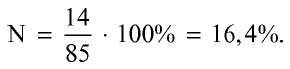
Ответ: 16,4 % N, т.е. питательного элемента.
На сегодняшний день актуальной является задача превращения азота воздуха в азотные удобрения с помощью азотфиксирующих бактерий и растений.
Фосфорные удобрения: Рассмотрим вкратце фосфорные удобрения, используемые в сельском хозяйстве.
1. Фосфоритная мука  — обогащенный порошок фосфорита —природного соединения фосфора. Фосфоритная мука плохо растворяется в воде, поэтому ее вносят в почвы с кислотной средой. Как самое дешевое фосфорное удобрение фосфоритная мука используется для удобрения целинных и торфяных почв.
— обогащенный порошок фосфорита —природного соединения фосфора. Фосфоритная мука плохо растворяется в воде, поэтому ее вносят в почвы с кислотной средой. Как самое дешевое фосфорное удобрение фосфоритная мука используется для удобрения целинных и торфяных почв.
2. Простой суперфосфат  — получается при взаимодействии апатита или фосфорита с серной кислотой:
— получается при взаимодействии апатита или фосфорита с серной кислотой:
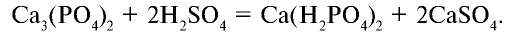
Ввиду хорошей растворимости в воде его можно использовать для удобрения растений на почвах с любой средой.
Простой суперфосфат вы можете приготовить сами. Для этого необходимо взять несколько кусков костей животного и обжигать до выгорания органических веществ. Обгоревшие кости следует измельчить в ступке до порошкообразного состояния. К 50 г порошка надо добавить 3 — 5 г порошка мела и, поместив смесь в химический стакан, постепенно залить 20 г 70%-ной серной кислоты. Смесь следует помешивать стеклянной палочкой. В результате химической реакции, протекающий в стакане, смесь нагреется. Порошок, образовавшийся после охлаждения смеси, и есть простой суперфосфат, то есть 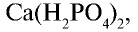 смешанный с
смешанный с 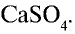
Для предохранения порошка простого суперфосфата от затвердевания под воздействием влаги в настоящее время его выпускают в гранулированном виде.
В составе простого суперфосфата содержится 14—20% 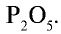
3. Двойной суперфосфат 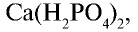 — концентрированное фосфорное минеральное удобрение, хорошо растворимое в воде:
— концентрированное фосфорное минеральное удобрение, хорошо растворимое в воде:
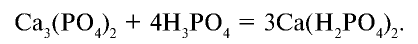
Количество 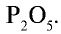 в двойном суперфосфате достигает 40—50% .
в двойном суперфосфате достигает 40—50% .
4. Преципитат 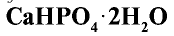 — также концентрированное минеральное удобрение, но малорастворимое в воде.
— также концентрированное минеральное удобрение, но малорастворимое в воде.
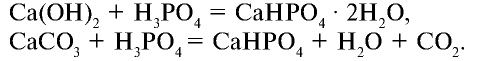
Количество 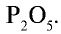 в преципитате составляет 30—35%.
в преципитате составляет 30—35%.
5. Костная мука изготавливается путем переработки костей животных и используется в измельченном виде в качестве форфорного минерального удобрения. Состав костной муки — 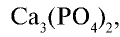 не растворима в воде. Хорошие результаты дает применение костной муки в почвах с кислотной средой.
не растворима в воде. Хорошие результаты дает применение костной муки в почвах с кислотной средой.
6. Аммофос - смесь 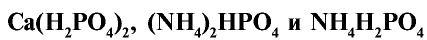 - относится к комплексным удобрениям, содержащим азот и фосфор. Хорошо растворяется в воде. Среди фосфорных минеральных удобрений используется чаще всего.
- относится к комплексным удобрениям, содержащим азот и фосфор. Хорошо растворяется в воде. Среди фосфорных минеральных удобрений используется чаще всего.
Питательный элемент в этих удобрениях представлен 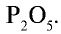
Пример: В состав одного из фосфорных удобрений входит 40% 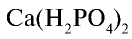
В каком количестве удобрения содержится 1 т питательного элемента 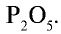 ?
?
Решение:
1) выясним, какое количество 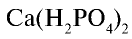 содержит 1 т питательного элемента:
содержит 1 т питательного элемента:
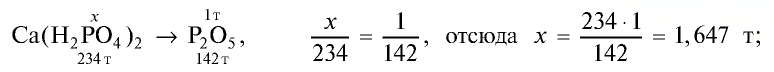
2) в каком количестве фосфорного удобрения содержится 1,647 т 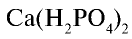
Продолжим вычисления, учитывая, что в составе минерального удобрения содержится 40% 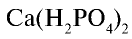 :
:
т/фосфорное удобрение = 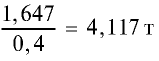 (40% = 0,4 части).
(40% = 0,4 части).
Ответ: 4,117 т.
Калийные удобрения: Калий имеет важное значение в повышении урожайности сельскохозяйственных растений. В сельском хозяйстве в качестве калийных удобрений используются такие соединения калия, как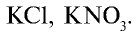
Питательный элемент в калийных удобрениях представлен 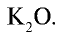
1. Неочищенные калийные удобрения.
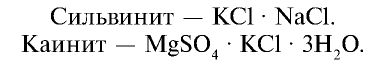
Они используются в качестве удобрения в измельченном до порошкообразного состояния виде. Следует, однако, учитывать, что при внесении этих удобрений в почву выделяются вредные для растений ионы хлора. Поэтому не рекомендуется использовать эти удобрения в количествах, превышающих нормы внесения.
2. Концентрированные калийные удобрения имеют обогащенный питательный элемент, что достигается путем переработки природных соединений калия. Содержание питательного элемента 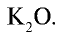 в составе минерального удобрения хлорида калия равно 52—60 %. Получают хлорид калия нагреванием и последующим обогащением сильвинита, при этом исходят из того, что КС1 и NaCl имеют различную растворимость. В составе нитрата калия —
в составе минерального удобрения хлорида калия равно 52—60 %. Получают хлорид калия нагреванием и последующим обогащением сильвинита, при этом исходят из того, что КС1 и NaCl имеют различную растворимость. В составе нитрата калия — 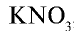 помимо питательного элемента
помимо питательного элемента 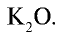 , содержится 12—13 % азота.
, содержится 12—13 % азота.
3. Древесная (растительная) мука представляет собой остаток, то есть золу, образовавшуюся после сгорания растений, в которой содержится в основном 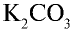 , (поташ).
, (поташ).
Питательный элемент в калийных удобрениях представлен в виде 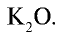
Пример: Вычислите количество питательного элемента в 1 т калийного удобрения, содержащего 75% хлорида калия.
Решение:
1) найдем массу КС1 в составе калийного удобрения: т (КС1) = 1000 кг • 0,75 = 750 кг;
2) зная, что питательным элементом в калийных удобрениях является 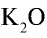 , определим содержание
, определим содержание 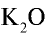 в 750 кг КС1:
в 750 кг КС1:
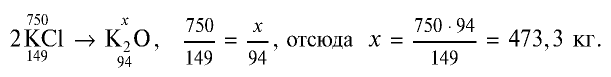
Ответ: 473,3 кг.
Элементы знаний, умений и навыков: натриевая селитра, калиевая селитра, аммиачная селитра, мочевина, фосфоритная мука, простой суперфосфат, двойной суперфосфат, преципитат, костная мука, аммофос, хлорид калия, сильвинит, каинит, древесная зола.
Биогенные элементы и их значение для живых организмов
К каким заболеваниям может привести недостаток микроэлементов в живых организмах?
Подавляющую часть земной поверхности (98%) составляют в основном восемь элементов: О, Si, Al, Fe, Са, Na, К, Mil. Хотя в процессе эволюции все они вошли в состав живой материи, основным элементом жизни стал углерод. 99,1 % растительной ткани представлен элементами О, С, Н, Na, К, Са, Si, 99,4% тела человека представлены элементами Н, О, С, N, Са.
Все они называются макробиогенными элементами.
Восемь элементов, встречающихся в составе живых организмов в количестве менее 0,01 % — Fe, Mn, Со, Си, Mo, Zn, F, Br, J, В, — называются микробиогенными элементами. Они крайне необходимы для жизни. Микробиогенные элементы называют также микроэлементами. Они способствуют образованию сахаристых веществ, крахмала, белков, различных нуклеиновых кислот, витаминов, ферментов. Микроэлементы обеспечивают также хороший рост растений на неплодородных почвах, повышение урожайности, приспособление их к засухе и низким температурам, устойчивость к различным заболеваниям. Железосодержащие ферростимуляторы, разработанные И.Р.Аскаровым и Ш.М.Киргизовым, применяются в качестве биологически активных веществ, положительно влияющих на рост растений.
Элементы Мn, Сu, Мо и В имеют важное значение для протекания процессов фотосинтеза, роста и созревания семян растений. Они способствуют повышению устойчивости растений к вредным воздействиям внешней среды (недостаток влаги в почве, повышение или понижение температуры воздуха), обеспечивают относительную устойчивость к ряду заболеваний, вызываемых бактериями и грибами (кенафный бактериоз, гниение корневища свеклы, серые пятна на зерновых растениях и т.д.).
Многочисленными опытами доказано значение бора в повышении урожайности растений гороха, фасоли, люцерны, сахарной свеклы, кенафа, бахчевых культур и ягод.
Одним из важнейших элементов в организме человека является кальций, 99 % которого входят в состав костной ткани, а примерно 1 % — в состав крови и лимфы. Недостаток кальция в организме человека вызывает ряд заболеваний, поэтому в медицине широко используются лекарственные вещества, изготовленные на основе хлорида и глюконата кальция. Так, препарат "Аскальций" содержит в своем составе 29 активизированных биогенных элементов и используется в качестве средства, повышающего защитную силу организма человека, а также позволяющего лечить заболевания костей и крови.
Использование микроэлемента меди на осушенных болотных, песчаных и обедненных медью землях позволяет повысить урожайность зерновых культур, молибден способствует увеличению продуктивности бобовых и кормовых культур, марганец обеспечивает получение высоких урожаев сахарной свеклы и пшеницы, а цинк — кукурузы. Кобальт и йод имеют большое практическое значение в получении высококачественной продукции животноводства. Марганец — основной элемент, регулирующий мочеобразование у живых организмов, он играет важную роль и при образовании витамина С.
Марганец повышает урожайность ягодных и зерновых культур. Так, при достаточном содержании марганца в почве урожай клубники достигает 30 ц/ra, а пшеницы — 3—4 ц/ra. При смачивании семян хлопчатника перед посевом солями марганца урожайность хлопчатника увеличивается на 2 центнера на гектар. Марганец ускоряет рост растений хлопчатника, табака, сахарной свеклы.
Кобальт имеет важное значение при синтезе гемоглобина, в ДНК и аминокислотном обмене. Наряду с повышением урожайности винограда кобальт способствует увеличению содержания сахаристых веществ в составе ягод.
При использовании кобальта вместе с цинком, бором и медью в качестве добавки к минеральным удобрениям ускоряется развитие хлопчатника, а урожайность его повышается на 3-4 ц с гектара.
Медь играет существенную роль в пигментации кожи и усвоении организмом железа.
Цинк имеет важное значение в образовании С03 и усвоении белков. При недостатке цинка зерновые растения, овощные культуры и кукуруза часто подвергаются заболеваниям: верхушки стеблей становятся белыми, растения ослабевают, резко снижается урожайность. Нехватка цинка у цитрусовых приводит к обесцвечиванию листьев и в результате к высыханию растения. Цинк важен и для растений персика, урюка и ореха.
Молибден способствует усвоению азота организмом и протеканию окислительно-восстановительных процессов. Микроудобрения с молибденом позволяют повысить урожайность сахарной свеклы на 20 %, льна — на 25 %. Микроудобрения с молибденом являются отходом производства лампочек. При внесении их в почву вместе с другими минеральными удобрениями урожайность озимой пшеницы возрастает на 37 %, а хлопчатника — на 7 ц/га.
Фтор является необходимым элементом в образовании костной ткани живых организмов. При недостатке фтора зубы начинают разрушаться.
Бром — один из элементов, ответственных за нормальное осуществление деятельности нервной системы.
Йод — элемент, необходимый для нормального роста и полового созревания организмов.
В последние годы ряд микроэлементов пополнился новыми элементами: Li, Al, Ti, V, Cr, Ni, Se, Sr, As, Cd, Sn, Ba, W. Их роль и значение в жизнедеятельности живых организмов изучаются учеными всего мира.
Так, профессором Х.Т. Шариповым разработана и внедрена в производство технология выделения из отходов драгоценных металлов золота, платины, молибдена, вольфрама.
На сегодняшний день, когда биосфера все больше загрязняется различными соединениями, мы должны осознавать, что изменение и перераспределение природных концентраций месторождений микроэлементов — металлов и неметаллов — является одним из факторов отрицательного воздействия на живую природу.
В настоящее время установлено, что около 300 видов растений из существующих 500000 и около 200 видов животных из более миллиона существующих испытывают потребность в микроэлементах. Неудовлетворение этой потребности может привести к исчезновению целых видов, нарушению равновесия в природе. В связи с этим усилия ученых всего мира направлены на исследование микроэлементов и их роли в жизнедеятельности живых организмов. Эти исследования начинают давать первые результаты.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |