
Относительная атомная и относительная молекулярная масса в химии с примерами
Содержание:
Относительная атомная и относительная молекулярная масса:
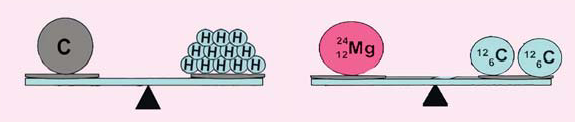
Сравните представленные картинки. Поясните сходства между этими картинками.
Почему 1 атом С равен 12 атомам Н, а 1 атом Mg - 2 атомам С?
Относительная атомная масса
Согласно атомно-молекулярному учению, один вид атома отличается от других видов атома своей массой. Как известно, масса атомов определяется суммой масс находящихся в их ядре протонов и нейтронов (нейтрон отсутствует лишь у атома легкого изотопа водорода). А можно ли выразить массу атомов известными нам единицами (мг, г, кг)? Атомы настолько мелкие частицы, что определить их массу непосредственно даже точнейшими весами (взвешивающими с точностью до одной стотысячной, одной миллионной) не представляется возможным.
Определить массу атомов возможно лишь при помощи физических экспериментов и математических вычислений. Так, например, было вычислено, что масса самого легкого изотопа водорода (протий) 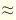
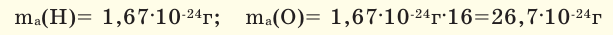
Так как производить расчеты с такими минимальными числами крайне неудобно, было введено понятие относительной атомной массы. С этой целью впервые Дж.Дальтон выдвинул идею сопоставления масс атомов с массой атома водорода. Позже было обнаружено, что при определении относительной атомной массы металлов на основе массы атома водорода возникают некоторые трудности. После этого относительную атомную массу элементов стали вычислять по 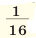 атомной массы кислорода. Открытие изотопов вновь создало определенные трудности. В настоящее время для определения относительной атомной массы элементов в качестве самого удобного эталона берется
атомной массы кислорода. Открытие изотопов вновь создало определенные трудности. В настоящее время для определения относительной атомной массы элементов в качестве самого удобного эталона берется 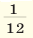 атомной массы изотопа углерода
атомной массы изотопа углерода 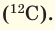 Данный эталон называют атомной единицей массы (а.е.м.).
Данный эталон называют атомной единицей массы (а.е.м.).
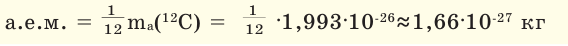
Относительная атомная масса элементов обозначается знаком 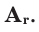 А - начальная буква слова «атом»;
А - начальная буква слова «атом»; 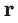 - от латинского слова «relative»— т.е. относительный.
- от латинского слова «relative»— т.е. относительный.
Относительная атомная масса химического элемента — это отношение средней атомной массы его природных изотопов к 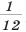 массы атома углерода
массы атома углерода 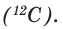
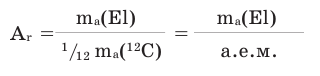
Относительные атомные массы некоторых элементов даны в таблице 1. Относительные атомные массы других элементов даны в таблице «Периодической системы химических элементов».

Относительная молекулярная масса
Так как молекулы состоят из атомов, их масса будет равна сумме масс составляющих эти молекулы атомов. Массу молекулы вещества, выраженную в атомных единицах массы, называют относительной молекулярной массой. При вычислениях используется относительная молекулярная масса. Относительная молекулярная масса веществ обозначается знаком 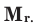 М - заглавная буква слова «молекула»,
М - заглавная буква слова «молекула», 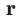 - от латинского слова «relative»- т.е. относительный.
- от латинского слова «relative»- т.е. относительный.
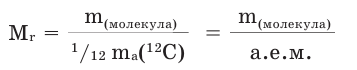
Относительная молекулярная масса веществ с молекулярным и немолекулярным строением вычисляется по относительной атомной массе атомов, составляющих молекулу: относительная атомная масса каждого элемента умножается на его индекс, полученные произведения суммируются. Например, вычислим относительную молекулярную массу серной кислоты 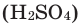 (рис.1).
(рис.1).
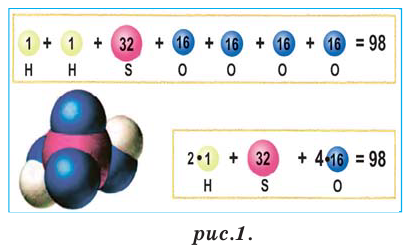
Пользуясь относительной молекулярной массой, на основе химических формул производят следующие вычисления.
Вычисление массовой доли химического элемента по формуле
Массовая доля обозначается буквой 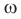 (омега).
(омега).
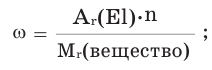 выражение в процентах
выражение в процентах 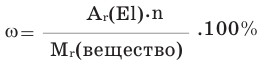
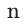 — индекс элемента, у которого вычисляется массовая доля.
— индекс элемента, у которого вычисляется массовая доля.
Вычисление массовых отношений элементов в сложном веществе
Относительная атомная масса каждого элемента умножается на его индекс и записывается под его знаком. Полученные числа делятся на самый большой средний делитель.

Выведение химической формулы вещества на основе массовой доли элементов
Например, для вещества 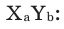
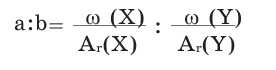
Выведение химической формулы сложного вещества по массовым отношениям элементов
Например, для химического соединения 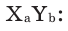
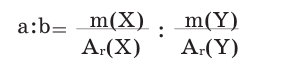
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |