
Окислительно-восстановительные реакции в химии - формулы и определения с примерами
Содержание:
Основные классы неорганических веществ:
Все известные неорганические вещества можно разделить на группы, или классы соединений. Такое деление называется классификацией. Вещества одного и того же класса обладают схожими свойствами, или признаками. Наиболее простая классификация основана на различии веществ по их агрегатному состоянию — твердому, жидкому и газообразному. Однако она не является строгой, поскольку большинство веществ, в зависимости от условий (температуры и давления), могут находиться в каждом из этих состояний. Чаще всего неорганические вещества классифицируются по составу, строению и химическим свойствам.
Классификация веществ
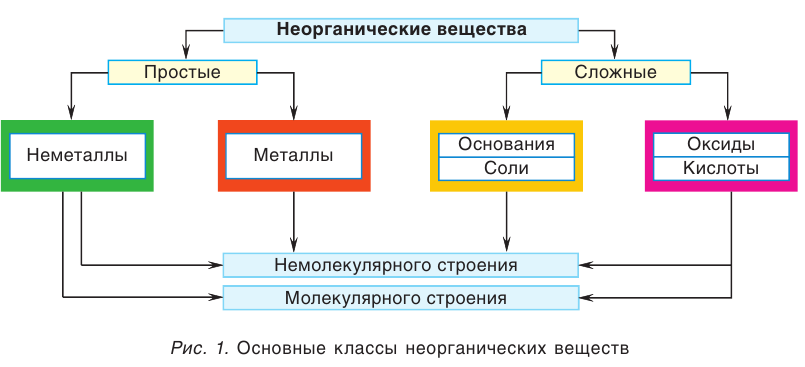
Общая схема классификации неорганических веществ представлена на рисунке.
1. Из схемы видно, что все неорганические вещества по числу химических элементов, входящих в их состав, делятся на две группы — простые и сложные. Вспомните, чем они отличаются друг от друга? Как вы уже знаете, к простым веществам относятся металлы и неметаллы.
Сложные неорганические вещества подразделяются по качественному составу и по химическим свойствам на несколько классов, важнейшими из которых являются: оксиды, кислоты, основания и соли. Все металлы, основания и соли относятся к веществам немолекулярного строения. Что касается неметаллов, оксидов и кислот, то среди них есть вещества как немолекулярного, так и молекулярного строения.
Рассмотрим более подробно важнейшие классы сложных неорганических веществ.
Оксиды
Оксиды — сложные вещества, в состав которых входят атомы двух химических элементов, один из которых кислород.
Степень окисления атомов кислорода в оксидах равна –2:
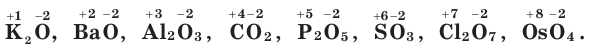
Название оксида образуется из слова «оксид» и названия второго элемента в родительном падеже, например 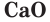 — оксид кальция,
— оксид кальция,  — оксид серы(VI). Если элемент может находиться в разных степенях окисления и образует несколько оксидов, в скобках указывается степень окисления этого элемента в данном оксиде.
— оксид серы(VI). Если элемент может находиться в разных степенях окисления и образует несколько оксидов, в скобках указывается степень окисления этого элемента в данном оксиде.
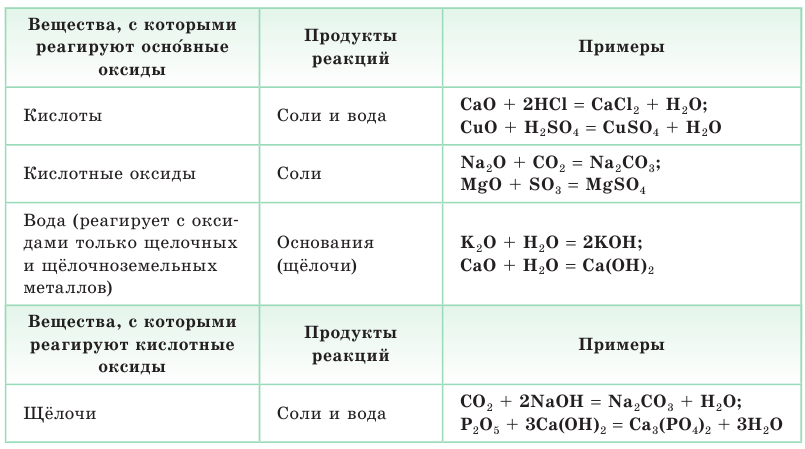
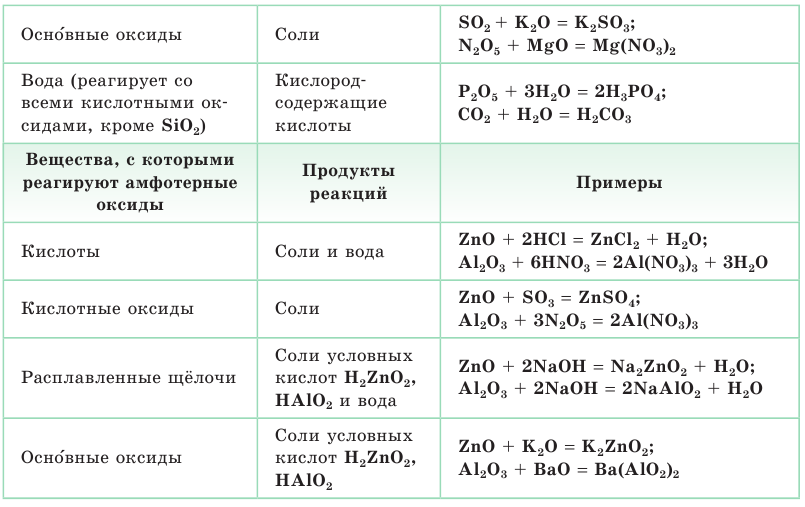
По способности реагировать с кислотами и основаниями с образованием солей все оксиды делятся на солеобразующие и несолеобразующие. К солеобразующим относятся основные, кислотные и амфотерные оксиды, принципиальное отличие между которыми заключается в их отношении к кислотам и щелочам.
Важнейшие химические свойства оксидов представлены в таблице 1.
Таблица 1. Важнейшие химические свойства оксидов
Кислоты
Кислоты — сложные вещества, в молекулах которых атомы водорода, способные замещаться атомами металлов, соединены с кислотными остатками.
Число атомов водорода в формулах кислотназывается их основностью. В соответствии с этим HCl — одноосновная, 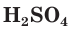 — двухосновная,
— двухосновная, 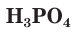 — трехосновная кислоты.
— трехосновная кислоты.
По составу неорганические кислоты делятся на кислородсодержащие (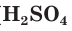 — серная,
— серная, 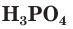 — фосфорная,
— фосфорная,  — азотная) и бескислородные (
— азотная) и бескислородные (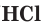 — хлороводородная,
— хлороводородная, 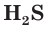 — сероводородная). Хлороводородную кислоту часто называют соляной.
— сероводородная). Хлороводородную кислоту часто называют соляной.
Почти все кислоты — вещества молекулярного строения. Большинство кислот хорошо растворимы в воде. К нерастворимым относится, например, кремниевая кислота 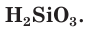 .
.
Важнейшие химические свойства кислот проявляются в их реакциях с металлами, основными оксидами, основаниями и солями (табл. 2).
Таблица 2. Важнейшие химические свойства кислот
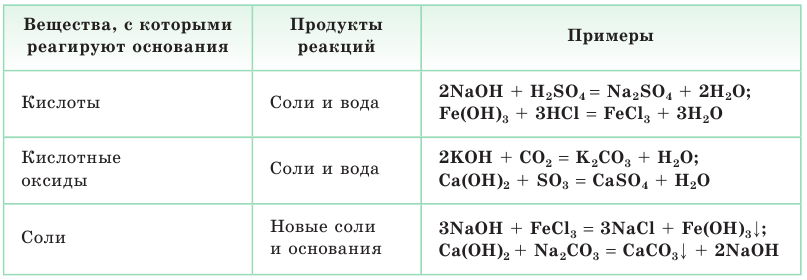
Основания
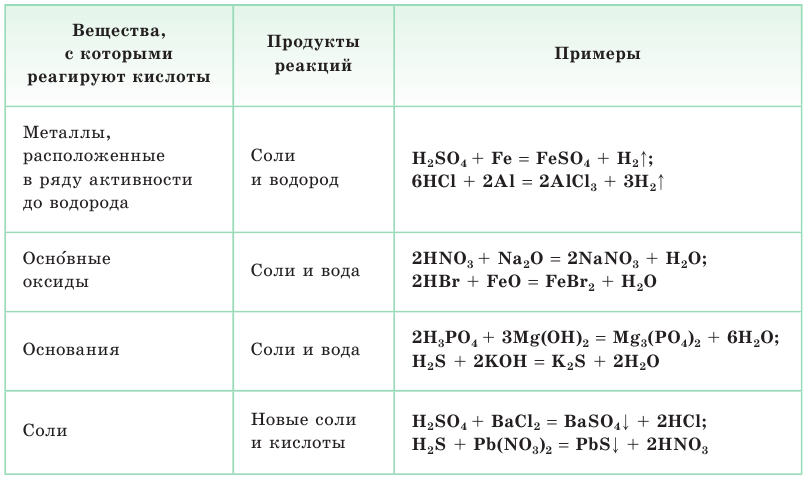
Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп ОН.
Напомним, что группа ОН одновалентна, а ее заряд равен 1–:
Названия оснований состоят из двух слов, первое из которых — это слово «гидроксид», а второе — русское название металла в родительном падеже, например:
 — гидроксид натрия;
— гидроксид натрия;  — гидроксид цинка.
— гидроксид цинка.
Все основания — твердые вещества немолекулярного строения. Гидроксиды щелочных и щёлочноземельных металлов, например NaOH, 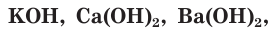 растворимы в воде и имеют общее название — щёлочи.
растворимы в воде и имеют общее название — щёлочи.
Важнейшие химические свойства оснований проявляются в их реакциях с кислотами, кислотными оксидами, солями, а также в их отношении к нагреванию (табл. 3, с. 10).
Таблица 3. Важнейшие химические свойства оснований
Малорастворимые и нерастворимые основания при нагревании разлагаются на соответствующий оксид металла и воду:
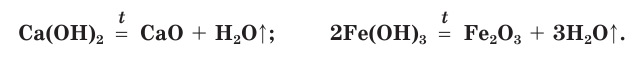
Соли
Соли — сложные вещества, в состав которых входят атомы металлов и кислотные остатки.
Название любой соли состоит из двух слов, первое из которых — название кислотного остатка в именительном падеже, а второе — название металла в родительном падеже:
 — хлорид алюминия;
— хлорид алюминия; 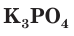 — фосфат калия;
— фосфат калия;
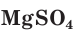 — сульфат магния;
— сульфат магния; 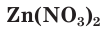 — нитрат цинка.
— нитрат цинка.
Если металл может находиться в разных степенях окисления и образует несколько солей, то в скобках указывается степень окисления атомов металла в данной соли, например 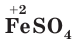 — сульфат железа(II),
— сульфат железа(II), 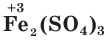 — сульфат железа(III).
— сульфат железа(III).
Все соли — твердые кристаллические вещества немолекулярного строения, большинство хорошо растворимы в воде.
Важнейшие химические свойства солей — их взаимодействие с металлами, кислотами, щелочами и другими солями (табл. 4).
Таблица 4. Важнейшие химические свойства солей
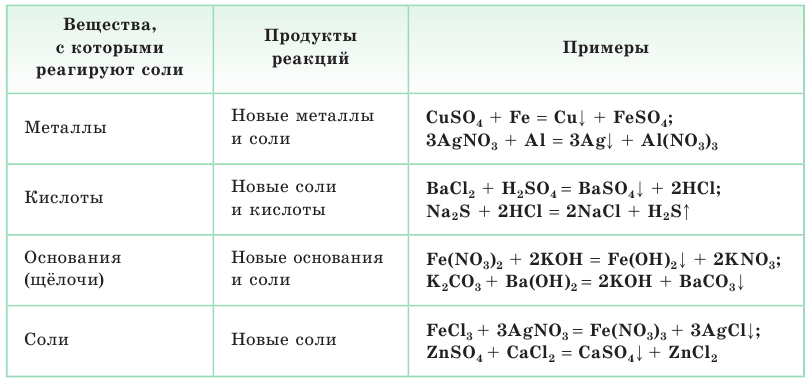
Напоминаем, что для реакций солей с металлами справедливо правило: более активный металл, расположенный в ряду активности левее, вытесняет из раствора соли менее активный металл, который располагается в этом ряду правее. Соответственно, менее активный металл не может вытеснить более активный из раствора его соли:
 реакция не идет.
реакция не идет.
Строение атома и периодический закон
Мы живем в мире веществ, из которых состоят все тела как природного, так и искусственного происхождения. Земля, океаны и моря, даже воздух, — все имеет вещественную основу. Число известных науке веществ близко к 150 млн и с каждым днем увеличивается на несколько тысяч.
Вам уже хорошо известно, что сами вещества состоят из различных атомов химических элементов — мельчайших, химически неделимых частиц, т. е. не исчезающих и не возникающих при химических реакциях. В течение многих веков атом считался элементарной, далее неделимой частицей. И только открытия, сделанные физиками на рубеже XIX — XX в., дали неоспоримые доказательства сложности строения атома. Английский ученый Э. Резерфорд в 1911 г. предложил модель строения атома, получившую название ядерной (планетарной). Согласно этой модели атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Практически вся масса атома заключена в ядре, диаметр которого примерно в 100 000 раз меньше диаметра всего атома. Современное физическое определение атома следующее.
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Позже было установлено, что ядро атома также имеет сложное строение. Оно состоит из протонов и нейтронов. Эти частицы имеют практически одинаковую массу, равную примерно 1 u, т. е. одной атомной единице массы. Протон (его символ р) имеет относительный заряд 1+, а нейтрон (символ n) — электронейтрален. Относительный заряд электрона (условное обозначение e– ) равен 1–, а масса примерно в 1840 раз меньше одной атомной единицы массы.
В таблице 5 приводятся основные характеристики частиц, входящих в состав атома.
Таблица 5. Основные характеристики частиц, входящих в состав атома

Масса атома, выраженная в привычных для нас весовых единицах (г, кг), представляет ничтожную величину. Поэтому еще с начала XIX в. в химии применяют относительные атомные массы. Они показывают, во сколько раз масса одного атома данного элемента больше массы определенного эталона сравнения. Первоначально в качестве такого эталона использовалась масса атома водорода, затем — кислорода, углерода. В настоящее время массы атомов сравнивают с 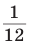 массы атома углерода. Она получила название атомной единицы массы (а. е. м.):
массы атома углерода. Она получила название атомной единицы массы (а. е. м.):
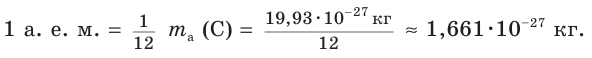
Сравнивая массы атомов различных химических элементов с атомной единицей массы, получают значения относительных атомных масс этих элементов.
Помимо этой количественной характеристики элемента, в таблице периодической системы химических элементов приведены и цифровые значения атомного (порядкового) номера элемента. Это главная характеристика химического элемента, которая определяется положительным зарядом ядра его атома, т. е. числом протонов. Поскольку атом в целом электронейтрален, очевидно, что число протонов в его ядре равно числу электронов:

Таким образом, можно заключить, что относительный заряд ядра атома является главной характеристикой элемента, определяя его положение в периодической системе, а следовательно, все свойства атомов этого элемента и его соединений.
Массовое число атома. Нуклиды. Изотопы
Атомы одного и того же элемента могут иметь разные массы. Это объясняется тем, что в их ядрах с одним и тем же числом протонов может находиться разное число нейтронов. Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом атома (А):
A = Z + N.
Число нейтронов N в ядре атома любого элемента легко подсчитать по разности:
N = A – Z.
Если слева от символа химического элемента индексами указать заряд ядра атома Z (атомный номер элемента) и его массовое число 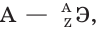 то такая запись будет обозначать нуклид данного элемента, например:
то такая запись будет обозначать нуклид данного элемента, например:
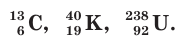
Нуклид — вид атомов с определенными значениями заряда ядра и массового числа.
Большинство химических элементов в природе существуют в виде нескольких нуклидов. Нуклиды одного элемента называются изотопами.
Изотопы — это нуклиды, имеющие одинаковый заряд ядра, но различные массовые числа.
Например, 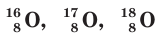 — изотопы кислорода, а
— изотопы кислорода, а 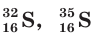 — изотопы серы.
— изотопы серы.
Изотопы любого элемента занимают одно место в периодической системе, так как принадлежат одному и тому же элементу. Следовательно, можно дать более точное определение химического элемента.
Химический элемент — вид атомов с одинаковым зарядом ядра.
Поскольку большинство химических элементов существуют в природе в виде смеси изотопов с собственным значением массового числа, то относительная атомная масса данного элемента является усредненной величиной относительных атомных масс его нуклидов.
Относительная атомная масса элемента — физическая величина, показывающая, во сколько раз масса атома данного химического элемента больше 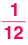 части массы атома нуклида
части массы атома нуклида 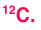
Теперь понятно, почему относительная атомная масса большинства химических элементов не является целочисленной величиной.
Электронное строение атомов
В химических реакциях атомы не исчезают и не возникают вновь, а просто пeреходят из одних веществ в другие, т. е. перегруппировываются. При этом ядра атомов остаются неизменными, хотя химические свойства атомов одного и того же химического элемента сильно различаются в зависимости от того, в каком веществе они находятся.
Если состав ядер данного химического элемента не меняется при химических реакциях, то очевидно, что все изменения, происшедшие с данным атомом, являются результатом изменения его электронного строения.
Электрон в атоме находится в постоянном движении вокруг ядра. Поскольку у такого движения отсутствует определенная траектория, то для его описания используется своеобразная модель движения электрона вокруг ядра — электронное облако (рис. 2).

Электронное облако характеризует вероятность нахождения электрона в той или иной области околоядерного пространства, которое не имеет четких границ. Поэтому его обычно ограничивают условной поверхностью, которая охватывает примерно 90 % облака. Такую область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона, называют атомной орбиталью.
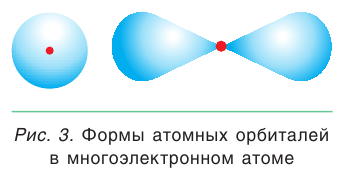
Орбитали, в зависимости от энергии электрона, имеют различные размеры и формы (рис. 3). Чем больше энергия электрона, тем дальше он находится от ядра и, следовательно, тем больше по размерам его орбиталь. На одной орбитали может находиться не более 2 электронов, а электроны, занимающие одну орбиталь, называются спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.
Электронные оболочки атомов
Общее число электронов в атоме всегда равно заряду его ядра. Но электроны, обладая различной энергией, по-разному располагаются в атоме. Электроны с большей энергией находятся дальше от ядра, а электроны, обладающие меньшей энергией, движутся в основном вблизи ядра. Так образуются оболочки (слои) из электронов с близкими значениями энергий, которые так и называются — электронные оболочки (электронные слои).
Электронный слой — это совокупность электронов с близкими значениями энергии.
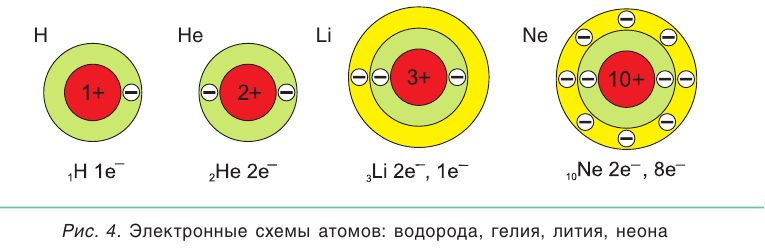
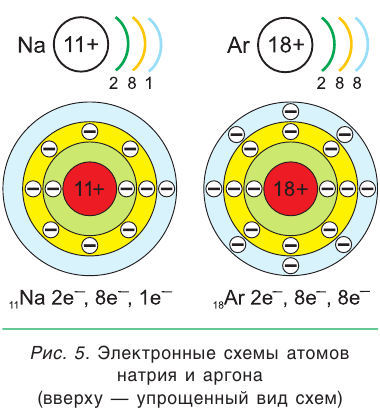
Число электронов на каждом слое различно и в основном определяется их энергией. На первом электронном слое максимально может находиться 2 электрона. Графическое изображение распределения электронов по слоям называется электронной схемой атома. На рисунке 4 показаны электронные схемы атомов водорода и гелия.
У атомов элементов второго периода (от лития Li до неона Ne) появляется в т о р о й электронный слой, на котором размещается от одного до восьми электронов (см. рис. 4).
С натрия Na начинается заполнение третьего электронного слоя: от одного электрона у атома натрия до восьми у атома аргона Ar (рис. 5).
В атоме любого элемента (кроме элементов первого периода — водорода и гелия) на внешнем электронном слое может находиться не более 8 электронов.
Внешний электронный слой, который содержит 8 электронов, называется завершенным. Поэтому у следующего за аргоном элемента калия K начинает заполняться четвертый электронный слой:
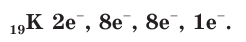
Калий является элементом четвертого периода. Вывод: число электронных слоев в атоме любого элемента совпадает с номером периода, в котором он находится. В этом заключается физический смысл номера периода.
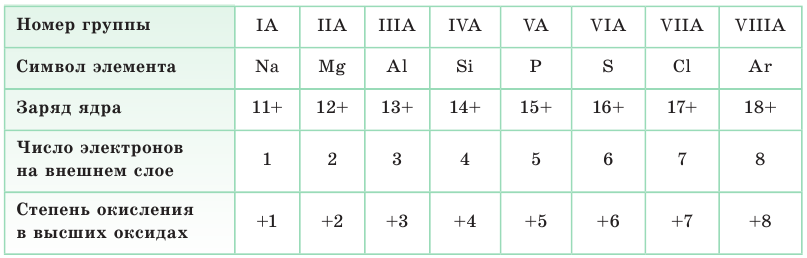
Электроны внешнего слоя связаны с ядром слабее, чем остальные, поэтому более подвижны. Они определяют химические свойства данного атома. Такие электроны называются валентными. У атомов элементов А-групп число валентных электронов равно номеру группы, обозначенному римской цифрой. Эта закономерность отражает физический смысл номера А-группы.
Таким образом, можно сделать главный вывод.
Свойства атомов химических элементов каждой группы периодически повторяются потому, что периодически повторяется строение их внешних электронных слоев.
Именно в этом заключается физический смысл периодического закона. Современная формулировка периодического закона звучит так.
Свойства атомов химических элементов, а также состав и свойства образуемых ими веществ находятся в периодической зависимости от зарядов атомных ядер.
Периодичность изменения свойств атомов химических элементов
Зная закономерности изменения электронного строения атомов, можно объяснить причины и характер изменения их свойств, а также физических и химических свойств образуемых ими простых и сложных веществ.
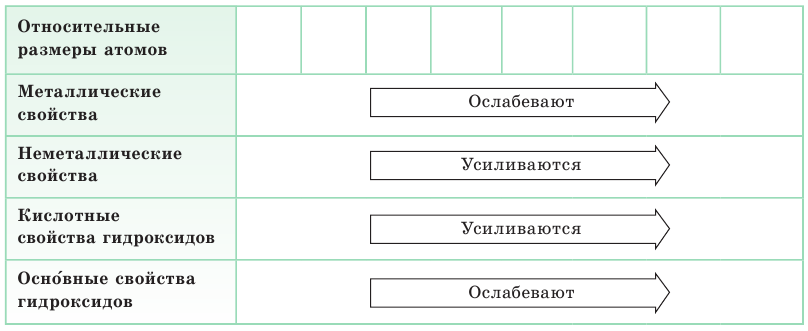
С точки зрения современной науки атом не имеет определенных границ, поэтому условно его форму считают шарообразной, а характеристикой его размера является радиус атома. Радиус атома в основном определяется зарядом его ядра, количеством электронных слоев и числом электронов на внешнем слое. У атомов элементов А-групп с увеличением атомного номера растет число электронных слоев и, следовательно, увеличиваются радиусы атомов (рис. 6). В периоде по мере увеличения ядер атомов элементов притяжение к ядру электронов, находящихся на одном и том же внешнем слое, усиливается. Происходит своеобразное «сжатие» атомов, и их радиусы уменьшаются.
Характер изменения радиусов атомов в группах и периодах определяет закономерности изменения металлических и неметаллических свойств атомов элементов, точнее их простых веществ.
Усиление металлических свойств атомов элементов в группах с возрастанием атомного номера элемента связано, прежде всего, с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов.
В противоположность этому неметаллические свойства атомов элементов А-групп с увеличением зарядов их ядер ослабевают, так как растет число электронных слоев. Кислотные свойства оксидов и гидроксидов этих элементов также ослабевают (см. табл. 6, с. 20).
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их.
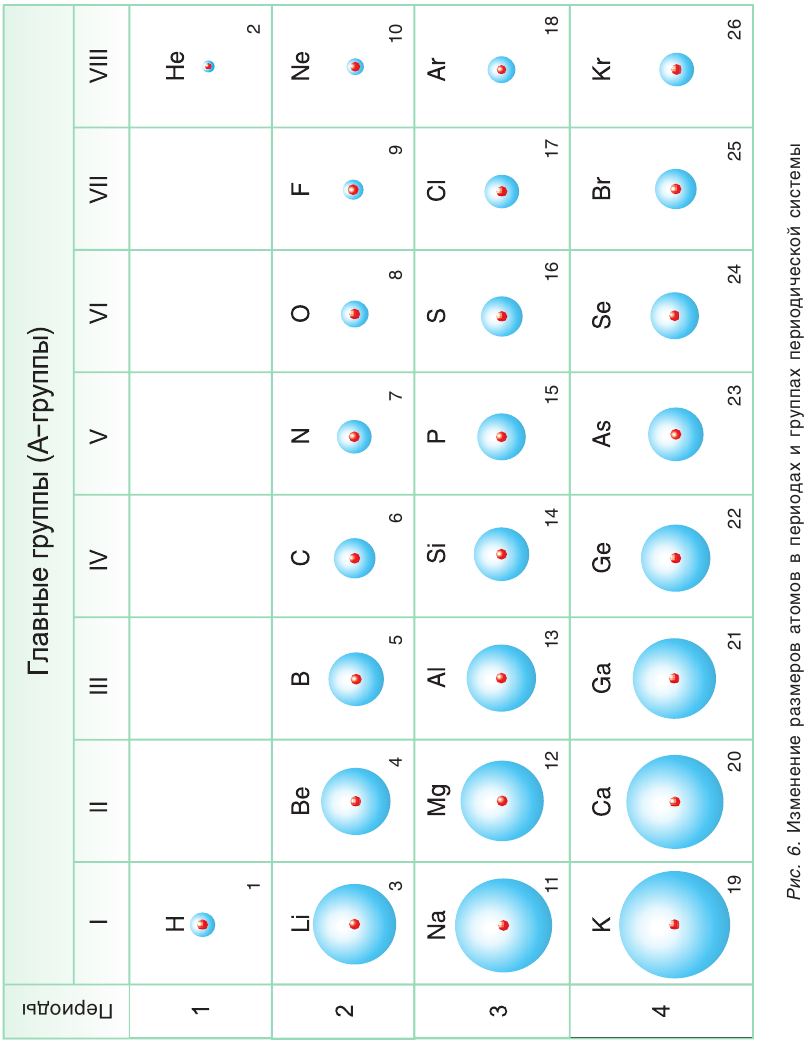
Таблица 6. Изменение различных характеристик атомов элементов IVА-группы
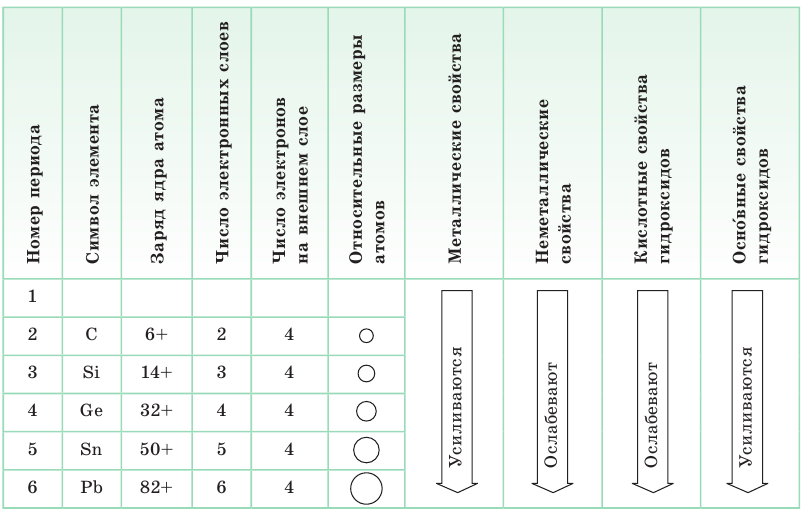
По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным (табл. 7).
Таблица 7. Изменение различных характеристик атомов элементов III периода
Химическая связь
Практически все изученные вами вещества представляют собой соединения, состоящие из атомов двух или более химических элементов. Исключение составляют одноатомные молекулы благородных газов — элементов VIIIА-группы. У атомов этих элементов на внешнем электронном слое находится максимально возможное число электронов — 2 у атома гелия He и по 8 у атомов остальных элементов. Такой электронный слой называется завершенным и считается самым устойчивым. У атомов остальных элементов внешние электронные слои являются незавершенными, поэтому в процессе химического взаимодействия атомы стремятся их завершить, т. е. приобрести электронное строение атома ближайшего благородного газа. Отсюда можно сделать вывод, что соединяться, т. е. связываться между собой, атомам выгодно с точки зрения стремления к максимально устойчивому состоянию. Такое взаимодействие, т. е. соединение атомов между собой, называется химической связью.
Химическая связь — это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, атомные кристаллы и др.).
Из курса химии 8-го класса вам уже известно, что химическая связь имеет электростатическую природу, т. е. определяется лишь силами притяжения частиц с разноименными зарядами и силами отталкивания частиц с одинаковыми зарядами. При образовании химической связи всегда выделяется энергия. Это является необходимым условием образования любой химической связи:
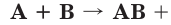 энергия, например
энергия, например 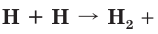 436 кДж/моль.
436 кДж/моль.
В зависимости от способа достижения атомами устойчивого электронного состояния различают три типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь
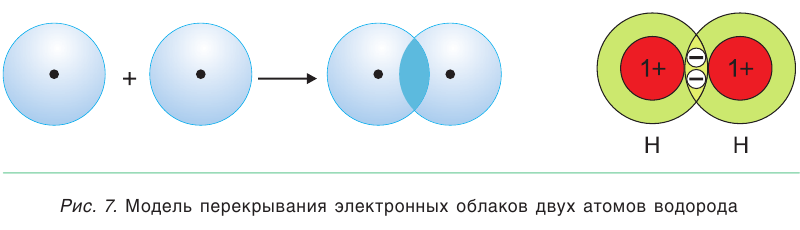
Ковалентная связь обычно возникает между атомами неметаллов, у которых на внешнем электронном слое находится от 4 до 7 электронов. Следовательно, до завершения этого слоя им не хватает немного электронов (1, 2, 3…). При сближении атомов электронные облака проникают друг в друга и перекрываются так, что между ядрами возникает область повышенного электронного заряда, которая так и называется — область повышенной электронной плотности (рис. 7). Другими словами, возникает общая электронная пара, одновременно принадлежащая обоим атомам. Эта общая пара и представляет собой ковалентную химическую связь.
Ковалентная связь — это связь, возникающая в результате образования общих электронных пар между двумя атомами.
При взаимодействии атомов одного и того же химического элемента общая электронная пара располагается симметрично между обоими ядрами.
Такая ковалентная связь называется неполярной (рис. 8). Она присуща молекулам простых веществ 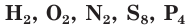 и др. Молекулы с неполярными ковалентными связями называются неполярными молекулами.
и др. Молекулы с неполярными ковалентными связями называются неполярными молекулами.
Взаимодействующие атомы могут иметь различные значения электроотрицательности (т. е. различную способность притягивать к себе общие электронные пары), например водород и хлор в молекуле НСl. В этом случае общая электронная пара смещается в сторону атома более электроотрицательного элемента, каким в данном случае является хлор:
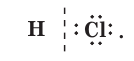
На его атоме возникает частичный (т. е. меньше 1) отрицательный заряд δ–, а на атоме водорода — частичный положительный заряд δ+. В результате образуются два полюса, а сама молекула становится полярной (или диполем):
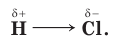
Ковалентную связь, образованную таким образом, называют полярной. Чем больше разность значений электроотрицательности обоих атомов, тем более полярной является химическая связь между ними.
Если атомы соединены между собой одной общей электронной парой, то такая ковалентная связь называется одинарной. Но между двумя атомами может возникать и большее число связей. В таких случаях говорят о к ратности связи, понимая под этим термином число электронных пар, участвующих в образовании ковалентной связи. Например, в молекуле кислорода О2 атомы связаны между собой двойной ковалентной связью:
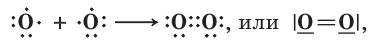
а в молекуле азота N2 атомы связаны между собой тройной ковалентной связью:
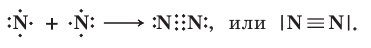
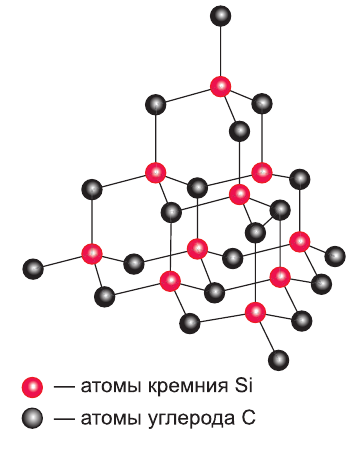

Кристаллические структуры, состоящие из атомов, связанных друг с другом ковалентными связями, называются атомными кристаллами или веществами с атомной кристаллической решеткой. Примерами являются алмаз С, кварц  карборунд SiC (рис. 9) и др. Это вещества немолекулярного строения, для которых характерна высокая прочность и твердость, высокие температуры плавления и кипения. Они нерастворимы в воде, не имеют запаха. Другие твердые вещества с ковалентными связями представляют собой молекулярные кристаллы, т. е. являются соединениями с молекулярной кристаллической решеткой (см. с. 28).
карборунд SiC (рис. 9) и др. Это вещества немолекулярного строения, для которых характерна высокая прочность и твердость, высокие температуры плавления и кипения. Они нерастворимы в воде, не имеют запаха. Другие твердые вещества с ковалентными связями представляют собой молекулярные кристаллы, т. е. являются соединениями с молекулярной кристаллической решеткой (см. с. 28).
Ионная связь
При значительном различии электроотрицательностей атомов (например, при взаимодействии атома щелочного металла натрия Na с атомом галогена хлора Сl) общая электронная пара практически полностью смещается в сторону более электроотрицательного атома неметалла хлора (рис. 10). В результате такого взаимодействия и натрий и хлор будут иметь на внешнем слое по 8 электронов, т. е. столько же, сколько и атомы ближайших к ним благородных газов неона Ne и аргона Ar. Сами атомы Na и Cl, теряя и присоединяя по одному электрону, превращаются
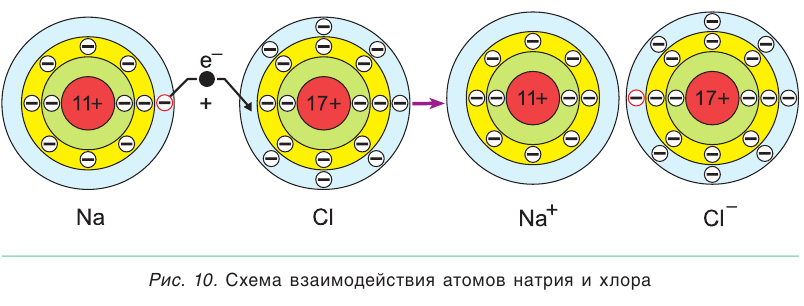
в ионы Na+ и Cl- . Противоположно заряженные ионы притягиваются друг к другу, и между ними возникает химическая связь, которая называется ионной связью.
Ионная связь — это химическая связь, которая осуществляется за счет притяжения противоположно заряженных ионов.
Схема такого взаимодействия вам уже знакома:
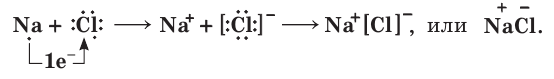
Все ионные соединения являются твердыми веществами с ионной кристаллической решеткой, в узлах которой расположены положительно и отрицательно заряженные ионы.
Каждый ион окружен определенным числом ионов противоположного заряда, некоторые образуют ионный кристалл. Химическая формула ионного соединения отображает простейшее (наименьшее) соотношение между числами ионов во всем кристалле и в каждой формульной единице этого вещества. Примерами ионных соединений могут служить оксиды металлов 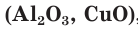 , щёлочи
, щёлочи  соли
соли 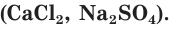 Как правило, они являются твердыми тугоплавкими веществами, не имеющими запаха.
Как правило, они являются твердыми тугоплавкими веществами, не имеющими запаха.
Металлическая связь
Как следует из самого названия, металлическая связь характерна для простых веществ металлов, у которых на внешнем электронном слое находится относительно небольшое число электронов. Эти электроны могут сравнительно легко отрываться и свободно перемещаться по всему объему кристалла металла:
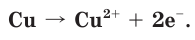
Совокупность таких электронов называют электронным газом. Именно эти электроны обусловливают высокую электропроводность и теплопроводность металлов, а также такие их механические свойства, как ковкость и пластичность.
При обычных условиях все металлы (исключая ртуть Hg) являются твердыми кристаллическими веществами. Кристаллическая решетка металлов состоит из расположенных в ее узлах положительных ионов, между которыми перемещаются валентные электроны.
Между положительно заряженными ионами металла и свободными электронами возникает прочная химическая связь, которая основана на обобществлении валентных электронов. Поэтому можно сказать, что металлическая связь является коллективной связью, а валентные электроны принадлежат не двум, а сразу всем атомам в кристалле металла (рис. 11).
Металлическая связь — это связь в металлах между положительно заряженными ионами посредством обобществленных электронов.
Металлы являются самыми многочисленными элементами периодической системы (их более 90). Металлы имеют много схожих химических свойств, но наряду с этим часто существенно различаются по некоторым физическим характеристикам. Так, например, большинство металлов А-групп, как правило, более мягкие и легкоплавкие, чем металлы В-групп. Например, цезий Cs, металл IА-группы, имеет температуру плавления 28,4 °С, а галлий Ga (IVА-группа) — 29,8 °С. В то же время вольфрам W (VIB-группа) плавится при 3420 °С, а железо (VIIIB-группа) — при 1450 °С.
Обобщающая информация о рассмотренных типах химической связи приведена в таблице 8.
Таблица 8. Типы химической связи

Межмолекулярное взаимодействие
Большинство молекул являются полярными и представляют собой диполи, которые способны притягиваться друг к другу. Такое притяжение называют межмолекулярным взаимодействием. Межмолекулярное взаимодействие, как и химическая связь, имеет электростатическую природу. Однако, в отличие от химической связи, межмолекулярное взаимодействие гораздо слабее. Тем не менее именно благодаря ему осуществляется переход веществ молекулярного строения из газообразного в жидкое, а затем и в твердое агрегатное состояние. Свидетельством тому является обыкновенная вода, которая при температурах ниже 100 °С переходит из парообразного состояния в жидкое, а при температурах ниже 0 °С — в твердое (лед).
При обычных условиях вещества молекулярного строения находятся в газообразном, жидком или твердом агрегатных состояниях. Твердые вещества этого типа, как правило, существуют в виде молекулярных кристаллов. В узлах их кристаллических решеток находятся молекулы, связанные между собой слабыми межмолекулярными силами. Молекулярные кристаллы обычно имеют небольшую прочность, малую твердость, невысокие температуры кипения и плавления. Многие из веществ, образующих молекулярные кристаллы, обладают запахом, так как их молекулы даже при обычных условиях могут отрываться от кристаллов и переходить в газообразное состояние. Примерами таких веществ являются ванилин, нафталин и др.
Окислительно-восстановительные реакции
В курсе химии 8-го класса вы впервые познакомились с особой группой химических процессов — с окислительно-восстановительными реакциями (ОВР). Поскольку такие реакции очень важны в природе и жизни человека, вам необходимо научиться составлять их химические уравнения. Для этого нужно вспомнить, что такое степень окисления и в чем заключается суть процессов окисления и восстановления.
Степень окисления
Как вы уже знаете, при образовании ковалентной полярной или ионной химической связи происходит смещение электронов от атомов с меньшей электроотрицательностью к атомам, у которых она больше. Поскольку при этом электроны смещаются не полностью, на атомах возникают частичные положительные и отрицательные заряды δ+ и δ–. Для характеристики такого состояния атомов в химических соединениях условились считать эти заряды не частичными, а целыми. Такой условный целочисленный заряд атома называют степенью окисления. Для ее обозначения в формуле вещества над символом химического элемента сначала ставится знак «+» или «–», а затем — целое число, например: 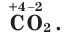
При определении величины степени окисления атомов в веществе условно допускают, что все электроны, участвующие в образовании химических связей, полностью смещаются к атомам более электроотрицательного элемента и, следовательно, вещество состоит из положительно и отрицательно заряженных ионов.
Степень окисления атома — это его условный заряд в химическом соединении, если предполагать, что соединение состоит из ионов.
Степень окисления может принимать значения от –4 до +8. Она равна нулю у атомов, входящих в состав только простых веществ — всех металлов и неметаллов. Для атомов некоторых элементов, входящих в состав сложных веществ, характерны постоянные степени окисления. Они приведены в таблице 9.
Таблица 9. Элементы с постоянными степенями окисления атомов

Кислород в большинстве соединений (оксиды, кислоты, основания, соли) проявляет степень окисления, равную –2. В пероксиде водорода 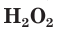 она равна –1, а во фториде кислорода
она равна –1, а во фториде кислорода 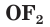 — +2 (так как электроотрицательность у фтора выше, чем у кислорода). Степень окисления водорода в большинстве сложных веществ равна +1, и только в соединениях с металлами она принимает значение, равное –1.
— +2 (так как электроотрицательность у фтора выше, чем у кислорода). Степень окисления водорода в большинстве сложных веществ равна +1, и только в соединениях с металлами она принимает значение, равное –1.
Что касается других элементов, то в сложных веществах для них характерны переменные степени окисления. Они рассчитываются исходя из того, что алгебраическая сумма степеней окисления всех атомов в веществе равна нулю. Определим степень окисления атома марганца (х) в формульной единице перманганата калия 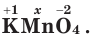 . Исходим из того, что число содержащихся в ней атомов калия, марганца и кислорода равно 1, 1 и 4, а степени окисления атомов калия и кислорода равны соответственно +1 и –2. Составим алгебраическое уравнение и, решив его, найдем величину х — искомую степень окисления атома марганца:
. Исходим из того, что число содержащихся в ней атомов калия, марганца и кислорода равно 1, 1 и 4, а степени окисления атомов калия и кислорода равны соответственно +1 и –2. Составим алгебраическое уравнение и, решив его, найдем величину х — искомую степень окисления атома марганца:
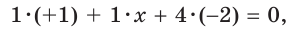 откуда
откуда 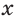 = +7.
= +7.
Процессы окисления и восстановления
Вы уже знаете, что в ходе любой ОВР одни атомы отдают электроны (окисление), а другие атомы их принимают (восстановление). Эти процессы всегда протекают одновременно. В результате окисления степень окисления атомов повышается, а в результате восстановления — понижается:
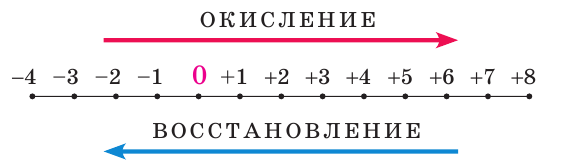
Атомы, которые отдают электроны, называются восстановителями. Вещества, в состав которых входят такие атомы, также называются восстановителями. К ним относятся простые вещества металлы, водород 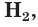 , углерод С, кремний Si, некоторые сложные вещества
, углерод С, кремний Si, некоторые сложные вещества 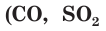 и др.). Атомы, присоединяющие электроны, называются окислителями. Так же называются и вещества, в состав которых входят эти атомы. К окислителям относится большинство простых веществ неметаллов
и др.). Атомы, присоединяющие электроны, называются окислителями. Так же называются и вещества, в состав которых входят эти атомы. К окислителям относится большинство простых веществ неметаллов 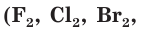
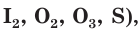 а также некоторые сложные вещества
а также некоторые сложные вещества 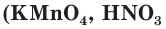 и др.).
и др.).
Электронный баланс в окислительно-восстановительных реакциях
Как вам уже известно, в ходе любой окислительно-восстановительной реакции общее число электронов, отданных восстановителем, всегда равно общему числу электронов, принятых окислителем:
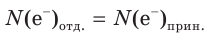
Это равенство, называемое электронным балансом, лежит в основе метода расстановки коэффициентов в уравнениях ОВР, который называется методом электронного баланса. Рассмотрим его на примерах.
Пример №1
Составить уравнение ОВР, протекающей по схеме:

Выполнение
1. Расставим степени окисления атомов в формулах всех веществ и подчеркнем символы элементов, у атомов которых изменились степени окисления:
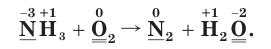
2. Определим атомы-восстановители и атомы-окислители. Поскольку в ходе реакции степень окисления атомов азота повышается, они окисляются (отдают электроны) и являются восстановителями. В то же время степень окисления атомов кислорода понижается, следовательно, они восстанавливаются (принимают электроны) и являются окислителями.
3. Составим схему электронного баланса. Для этого запишем одно под другим уравнения процессов окисления атомов азота и восстановления атомов кислорода (см. с. 32).
Запомните!
В этих уравнениях число атомов каждого элемента такое же, как в формуле соответствующих исходных веществ
Учитывая, что в молекуле  один атом азота, а в молекуле
один атом азота, а в молекуле  два атома кислорода, схема электронного баланса имеет вид:
два атома кислорода, схема электронного баланса имеет вид:
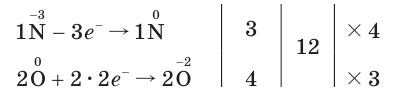
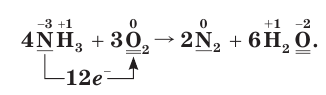
Из этих уравнений видно, что один атом азота отдает 3 электрона, а два атома кислорода принимают 4 электрона. Эти числа (3 и 4) записываются напротив соответствующих уравнений за первой вертикальной чертой. Далее находится наименьшее общее кратное 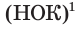 указанных чисел — число 12, которое записывается посередине за второй вертикальной чертой. После этого наименьшее кратное поочередно делится на число электронов, отданных одним атомом азота, т. е. на 3 (12 : 3 = 4), и на число электронов, принятых двумя атомами кислорода, т. е. на 4 (12 : 4 = 3). Полученные цифры — 4 и 3 записываются напротив соответствующих уравнений за третьей вертикальной чертой со знаком
указанных чисел — число 12, которое записывается посередине за второй вертикальной чертой. После этого наименьшее кратное поочередно делится на число электронов, отданных одним атомом азота, т. е. на 3 (12 : 3 = 4), и на число электронов, принятых двумя атомами кислорода, т. е. на 4 (12 : 4 = 3). Полученные цифры — 4 и 3 записываются напротив соответствующих уравнений за третьей вертикальной чертой со знаком 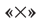 (умножить). Эти цифры представляют собой множители, показывающие, во сколько раз нужно увеличить числа атомов в записанных уравнениях окисления и восстановления для достижения электронного баланса. Следовательно, число 1, записанное перед символами N, нужно умножить на
(умножить). Эти цифры представляют собой множители, показывающие, во сколько раз нужно увеличить числа атомов в записанных уравнениях окисления и восстановления для достижения электронного баланса. Следовательно, число 1, записанное перед символами N, нужно умножить на 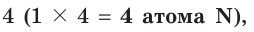 а число 2, записанное перед символами O, нужно умножить на
а число 2, записанное перед символами O, нужно умножить на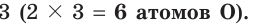 Таким образом, получается электронный баланс: число электронов (12), отданных четырьмя атомами азота, равно числу электронов (12), принятых шестью атомами кислорода.
Таким образом, получается электронный баланс: число электронов (12), отданных четырьмя атомами азота, равно числу электронов (12), принятых шестью атомами кислорода.
4. Учитывая, что в обеих частях уравнения должно быть по четыре атома азота и по шесть атомов кислорода, расставим соответствующие коэффициенты перед формулами веществ в исходной схеме реакции и получим искомое уравнение:
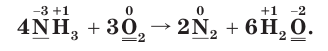
Из курса химии 8-го класса вы помните, что в уравнениях ОВР под формулами исходных веществ располагались поясняющие слова «восстановитель» и «окислитель», а стрелка, показывающая переход электронов, изображалась сверху, над формулами этих веществ.
1 НОК — наименьшее число, которое одновременно делится на каждое из указанных чисел.
Поскольку теперь нет необходимости в поясняющих словах, переход электронов впредь будем показывать стрелкой, расположенной под формулами исходных веществ:
Пример №2
Составить уравнение ОВР, протекающей по схеме:

Выполнение
1. Расставим степени окисления атомов в формулах всех веществ и подчеркнем символы элементов, у атомов которых изменились степени окисления:
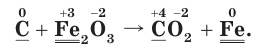
2. Определим атомы-восстановители и атомы-окислители в данной ОВР. Поскольку в ходе реакции степень окисления атомов углерода повышается, следовательно, они окисляются (отдают электроны) и являются восстановителями. В то же время степень окисления атомов железа понижается, они восстанавливаются (принимают электроны) и являются окислителями.
3. Составим схему электронного баланса. Для этого запишем одно под другим уравнения процессов окисления атомов углерода и восстановления атомов железа:
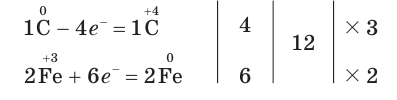
Из этих уравнений видно, что один атом углерода отдает 4 электрона, а два атома железа принимают 6 электронов. Эти числа (4 и 6) записываются напротив соответствующих уравнений за первой вертикальной чертой. Наименьшее общее кратное указанных чисел — число 12, записанное за второй вертикальной чертой, поочередно делится на число электронов, отданных одним атомом углерода, т. е. на 4 (12 : 4 = 3), и на число электронов, принятых двумя атомами железа, т. е. на 6 (12 : 6 = 2). Полученные цифры — 3 и 2 записываются напротив соответствующих уравнений за третьей вертикальной чертой. Они показывают, что число 1, записанное перед символами С, нужно умножить на 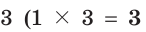 атома С), а число 2, записанное перед символами Fe, нужно умножить на
атома С), а число 2, записанное перед символами Fe, нужно умножить на 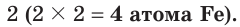 Таким образом, получается электронный баланс: число электронов (12), отданных тремя атомами углерода, равно числу электронов (12), принятых четырьмя атомами железа.
Таким образом, получается электронный баланс: число электронов (12), отданных тремя атомами углерода, равно числу электронов (12), принятых четырьмя атомами железа.
4. Расставим соответствующие коэффициенты перед формулами веществ:
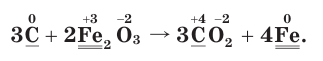
Переход электронов от восстановителя к окислителю изобразим схемой:
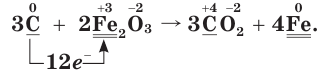
Примеры расчетов по уравнениям окислительно-восстановительных реакций
Вам уже известно, что по уравнениям химических реакций можно проводить различные расчеты. Например, зная массу одного вещества, по уравнению реакции можно найти массу другого вещества, которое с ним прореагировало или которое образовалось в результате данной реакции. Аналогичные расчеты можно выполнять и с объемами газообразных веществ. Для закрепления приобретенных ранее навыков разберем примеры расчетов по уравнениям окислительно-восстановительных реакций. Это особенно важно потому, что реакции этого типа лежат в основе промышленных методов получения металлов, большинства неметаллов, оксидов, кислот и других важных веществ.
Пример №3
Рассчитайте массу алюминия, при взаимодействии которого с хлоридом меди(II) образуется медь массой 28,8 г.
Решение
1. Запишем схему данной окислительно-восстановительной реакции:
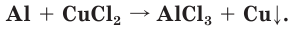
2. Расставим степени окисления атомов в формулах всех веществ и подчеркнем символы элементов, у атомов которых изменились степени окисления:
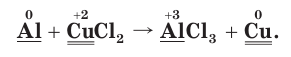
3. Поскольку в ходе реакции степень окисления атомов алюминия увеличивается от 0 до +3, они отдают электроны, окисляются и являются восстановителями. Так как степень окисления атомов меди уменьшается от +2 до 0, они принимают электроны, восстанавливаются и являются окислителями.
4. Составим схему электронного баланса:
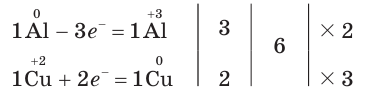
5. Расставим в схеме коэффициенты и получим уравнение химической реакции:
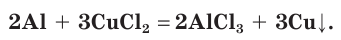
6. Рассчитаем химическое количество меди, которая должна образоваться в результате реакции:
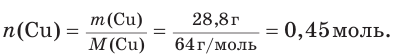
7. Зная химическое количество меди, по уравнению реакции определим химическое количество (х) исходного алюминия:
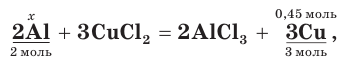
откуда найдем х = 0,3 моль (Al).
8. Рассчитаем искомую массу алюминия:
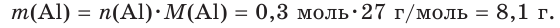
Пример №4
Рассчитайте объем (н. у.) кислорода, необходимого для полного сгорания сероводорода объемом 56 дм3 (н. у.), если известно, что при этом образуются оксид серы(IV) и вода.
Решение
1. Запишем схему данной окислительно-восстановительной реакции:
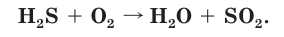
2. Расставим степени окисления атомов в формулах всех веществ и подчеркнем символы элементов, у атомов которых изменились степени окисления:
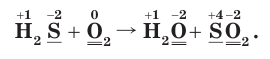
3. Поскольку в ходе реакции степень окисления атомов серы увеличивается от –2 до +4, они отдают электроны, окисляются и являются восстановителями. Так как степень окисления атомов кислорода уменьшается от 0 до –2, они принимают электроны, восстанавливаются и являются окислителями.
4. Составим схему электронного баланса:
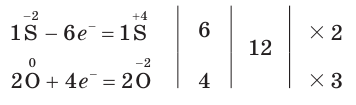
5. Расставим в схеме коэффициенты и получим уравнение химической реакции:
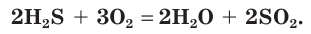
6. Рассчитаем химическое количество исходного сероводорода:
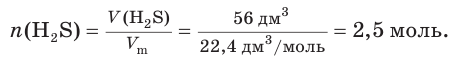
7. Зная химическое количество сероводорода, по уравнению реакции определим химическое количество (х) прореагировавшего с ним кислорода:
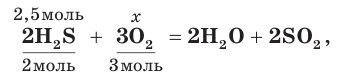
откуда найдем х = 3,75 моль (О2).
8. Рассчитаем искомый объем (н. у.) кислорода:
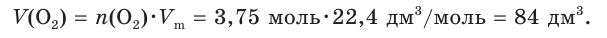
Пример №5
Рассчитайте объем (н. у.) воздуха, необходимого для полного сгорания фосфора массой 74,4 г, если известно, что в результате реакции образуется оксид фосфора(V), а объемная доля кислорода в воздухе составляет 21 %.
Решение
1. Запишем схему данной окислительно-восстановительной реакции:
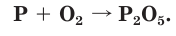
2. Расставим степени окисления атомов в формулах всех веществ и подчеркнем символы элементов, у атомов которых изменились степени окисления:
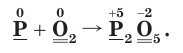
3. Поскольку в ходе реакции степень окисления атомов фосфора увеличивается от 0 до +5, они отдают электроны, окисляются и являются восстановителями. Так как степень окисления атомов кислорода уменьшается от 0 до –2, они принимают электроны, восстанавливаются и являются окислителями.
4. Составим схему электронного баланса:
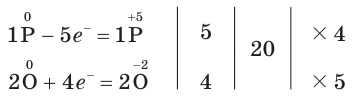
5. Расставим в схеме коэффициенты и получим уравнение химической реакции:
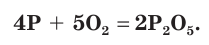
6. Рассчитаем химическое количество исходного фосфора:
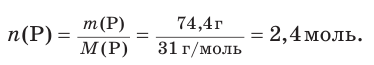
7. Зная химическое количество фосфора, по уравнению реакции определим химическое количество (х) вступившего в реакцию кислорода:
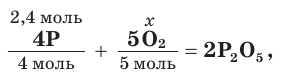
откуда найдем х = 3 моль (О2).
8. Рассчитаем объем (н. у.) кислорода:
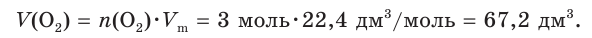
9. Найдем объем (н. у.) воздуха, в котором содержится кислород объемом 67,2 дм3:
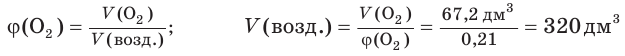
Растворы
В курсе химии 8-го класса вы познакомились с многокомпонентными системами, которые называются растворами. Они образуются в результате смешивания двух, трех, а иногда и большего числа веществ.
Нас окружает мир растворов. Мы живем на дне «воздушного океана» — газообразного раствора кислорода и других газов в азоте. Все важнейшие процессы на Земле, протекающие в неживой и живой природе, осуществляются в жидких растворах, в которых растворителем является вода. К таким процессам относятся, например, почвообразование, питание и развитие растений, пищеварение и обмен веществ у животных и др.
Вспомним, каковы же общие признаки растворов. В качестве примера рассмотрим водные растворы сахара, поваренной соли и серной кислоты. Внешне они выглядят совершенно одинаково и представляют собой прозрачные жидкости (рис. 12). Общая черта всех растворов — их однородность (гомогенность). Она заключается в том, что свойства раствора одинаковы в любой его части. Даже с помощью самого сильного микроскопа в растворе нельзя обнаружить отдельные частицы растворенных веществ. Однородность — это свойство растворов, которое роднит их с чистыми веществами. Но в то же время между растворами и чистыми веществами есть отличия. Например, растворы можно разделить на отдельные компоненты с помощью физических процессов — выпаривания или вымораживания. Кроме того, если состав чистого вещества всегда постоянен, то состав растворов одного и того же вещества может изменяться в широких пределах. В одном стакане воды можно растворить 2, 3 и более ложки сахара — и всегда будет получаться раствор. Растворы могут храниться очень долго — они являются устойчивыми системами.
Раствор — это однородная устойчивая система, состоящая из двух или большего числа компонентов.
В процессе образования раствора участвуют, как минимум, два вещества — растворитель и растворяемое вещество. Растворителем считается то вещество, у которого при образовании раствора не изменяется агрегатное состояние.
По отношению к воде вещества делятся на растворимые, малорастворимые и нерастворимые. Некоторые вещества, например спирт и серная кислота, при образовании растворов смешиваются с водой в любых соотношениях. Такие вещества называются неограниченно растворимыми. Другие вещества растворяются в воде ограниченно. Например, при 20 °С в воде массой 100 г можно растворить не более 6,36 г перманганата калия 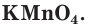
Растворимость веществ в воде и других растворителях зависит от множества факторов: природы вещества и растворителя, температуры, давления (для газов).
Из курса химии 8-го класса вы уже знаете, что растворы бывают жидкие, газообразные и твердые. Агрегатное состояние раствора, как правило, такое же, как и агрегатное состояние исходного растворителя.
Водород, очень мало растворимый в воде, прекрасно растворяется в металле палладии Pd — в одном объеме металла может раствориться до 800 объемов водорода. Образующийся раствор, как и растворитель палладий, находится в твердом агрегатном состоянии.
К твердым растворам относятся сплавы металлов (латунь, бронза, мельхиор).
По степени насыщенности растворенным веществом растворы делятся на насыщенные и ненасыщенные. Насыщенным называется раствор, в котором содержание растворенного вещества является максимально возможным при данной температуре. Если же содержание растворенного вещества меньше максимально возможного, раствор является ненасыщенным (рис. 13).
По содержанию растворенного вещества растворы делятся на концентрированные и разбавленные. Если в растворе массовая доля растворенного вещества более 50 %, он является концентрированным, а если намного меньше 50 % — разбавленным. Нужно иметь в виду, что понятия «концентрированный» и «насыщенный» — не синонимы, они обозначают не одно и то же. Например, после смешивания с водой малорастворимого в ней сульфата кальция 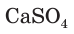 на дне стакана остается осадок этого вещества. Раствор над осадком содержит небольшое количество растворившегося сульфата и является разбавленным. Но, поскольку сульфат кальция больше в воде не растворяется, этот раствор является насыщенным. Поэтому мы можем назвать данный раствор разбавленным и насыщенным. Аналогичная ситуация и с понятиями «концентрированный» и «ненасыщенный».
на дне стакана остается осадок этого вещества. Раствор над осадком содержит небольшое количество растворившегося сульфата и является разбавленным. Но, поскольку сульфат кальция больше в воде не растворяется, этот раствор является насыщенным. Поэтому мы можем назвать данный раствор разбавленным и насыщенным. Аналогичная ситуация и с понятиями «концентрированный» и «ненасыщенный».
Запомните!
Концентрированный раствор может быть как насыщенным, так и ненасыщенным.
Насыщенный раствор, с другой стороны, может быть как концентрированным, так и разбавленным
Количественный состав растворов выражается разными способами в зависимости от того, где и для чего они используются. Например, в лаборатории можно увидеть склянки с растворами серной кислоты, на этикетках которых указаны ее массовая доля (например, 10 %) или молярная концентрация (например, 0,2 моль/дм3 ). С этими понятиями вы познакомились в курсе химии 8-го класса и уже знаете формулы для расчета массовой доли 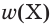 и молярной концентрации вещества c(Х) в растворе:
и молярной концентрации вещества c(Х) в растворе:
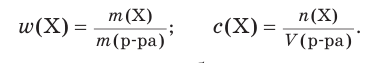
Напомним, что массовая доля — безразмерная величина, т. е. не имеет единиц выражения. В то же время молярная концентрация является размерной величиной и чаще всего выражается в моль/дм3 .
Решим простейшие задачи, связанные с использованием понятий «массовая доля растворенного вещества» и «молярная концентрация вещества».
Пример №6
Рассчитайте массу воды, в которой необходимо растворить хлорид калия массой 15 г для приготовления раствора с массовой долей соли, равной 3 %.
Решение
1. Зная массу соли и ее массовую долю в растворе, рассчитаем массу этого раствора:
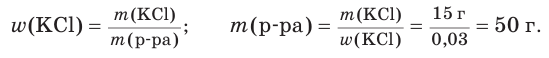
2. Найдем искомую массу воды, которая равна разности между массой раствора и массой содержащейся в нем соли:
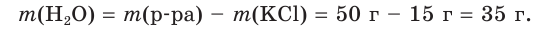
Пример №7
В мерную колбу поместили сульфат меди(II) массой 32 г и добавили воду до объема 250 см3 . Рассчитайте молярную концентрацию соли в приготовленном растворе.
Решение 1.
Рассчитаем химическое количество растворенного сульфата меди(II):
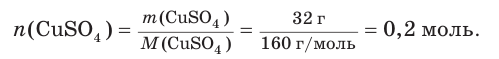
2. Найдем искомую молярную концентрацию соли в приготовленном растворе:
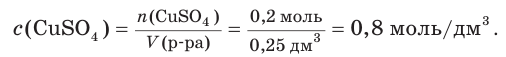
Любой раствор характеризуется плотностью (ρ). Она показывает, чему равна масса раствора (г или кг) в единице его объема (1 см3 или 1 дм3 ), и рассчитывается по формуле:
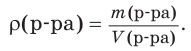
Плотность раствора выражается в единицах г/см3 , кг/дм3 или кг/м3 . Если, например, плотность раствора равна 1,25 г/см3 , это значит, что масса данного раствора объемом 1 см3 составляет 1,25 г.
Для измерения плотности растворов веществ используют специальные приборы — ареометры. Их верхняя узкая часть снабжена шкалой, откалиброванной в единицах плотности. При опускании ареометра в исследуемую жидкость он погружается на определенную глубину. Деление на шкале, которое оказывается на одном уровне с поверхностью раствора, показывает его плотность. Похожие приборы используются для определения содержания спирта в алкогольных напитках (спиртометры), жира в молоке (лактометры).
Плотность растворов зависит от природы растворенных веществ и их количественного содержания. Например, плотность раствора спирта с его массовой долей, равной 60 %, составляет 0,891 г/см3 , а плотность раствора серной кислоты с такой же массовой долей — 1,5 г/см3 . Познакомимся с вариантом решения задачи с использованием понятия «плотность раствора».
Пример №8
Гидроксид натрия массой 30 г растворили в воде объемом 296 см3 . Рассчитайте объем (дм3 ) и молярную концентрацию щёлочи в приготовленном растворе, если его плотность составляет 1,086 г/см3 .
Решение
1. Рассчитаем массу приготовленного раствора:
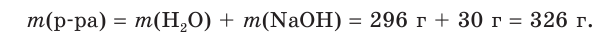
2. Найдем объем приготовленного раствора:
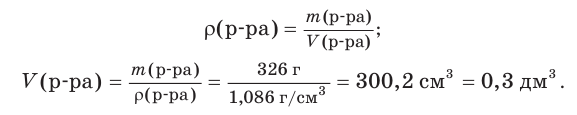
3. Вычислим химическое количество растворенной щёлочи:
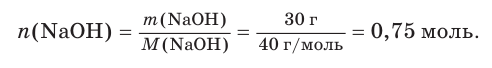
4. Рассчитаем молярную концентрацию щёлочи в приготовленном растворе:
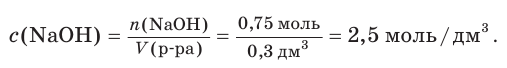
Растворы широко используются практически во всех сферах человеческой деятельности — в промышленности, сельском хозяйстве и в быту.
Раствор — это однородная устойчивая система, состоящая из двух или большего числа компонентов.
По агрегатному состоянию растворы подразделяются на твердые, жидкие и газообразные; по степени насыщенности — на насыщенные и ненасыщенные; по содержанию растворенного вещества — на концентрированные и разбавленные.
Количественно растворы характеризуются массовой долей или молярной концентрацией растворенного вещества, а также плотностью.
Классификация химических реакций
В настоящее время известно множество химических реакций. Каждая из них, безусловно, индивидуальна, поскольку в ней принимают участие конкретные вещества с присущими им химическими свойствами. Впрочем, химические реакции имеют много общих признаков, что позволяет объединить их в несколько типов. В таблице 5 приведены некоторые критерии, по которым классифицируют химические реакции.
Таблица 5. Классификация химических реакций
| Признаки классификации | Типы реакций |
| Изменение количества реагентов и продуктов реакции | Реакции соединения. Реакции разложения. Реакции замещения. Реакции обмена |
| Изменение степеней окисления элементов, которые входят в состав веществ, принимающих участие в реакции | Окислительно-восстановительные реакции |
| Выделение или поглощение энергии в ходе химической реакции | Экзотермические реакции. Эндотермические реакции |
| Протекают в одном направлении и до конца либо в двух противоположных направлениях и не до конца | Необратимые реакции. Обратимые реакции |
| Наличие катализатора | Каталитические реакции. Некаталитические реакции |
Мы уже ознакомились со многими из перечисленных типов. Вспомним классификацию реакций по первому признаку — по количеству исходных и конечных веществ (реагентов и продуктов реакции) и обобщим полученные знания.Начнём с демонстрационных опытов.
Опыт 1. В фарфоровой ступке смешиваем порошок цинка массой б г и порошок серы массой 3 г. Смесь насыпаем горкой на керамическую плитку (или жесть) и нагреваем в одном месте при помощи длинной лучинки (не спички!). Происходит сильная вспышка. Образуется сульфид цинка (опыт лучше проводить под тягой):
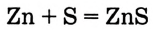
Химические реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество, называются реакциями соединения.
Опыт 2. На керамическую плитку (или жесть) насыпаем горкой оранжево-красные кристаллы дихромата аммония 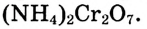 В центре горки делаем небольшое углубление и смачиваем его спиртом.
В центре горки делаем небольшое углубление и смачиваем его спиртом.
Подносим горящую лучинку. Начинается бурное разложение соли. Выбрасываются масса тёмно-зелёного оксида хрома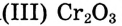 и водяной пар, это похоже на «извержение вулкана» (рис. 48).
и водяной пар, это похоже на «извержение вулкана» (рис. 48).
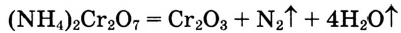

Рис. 47. Учитель делает углубление в горке кристаллов дихромата аммония

Рис. 48. «Извержение вулкана»
Химические реакции, в результате которых из одного вещества образуются два и более новых веществ, называются реакциями разложения.
Химические реакции между простым и сложным веществами, в ходе которых атомы простого вещества замещают атомы одного из элементов в сложном веществе, образуя новое простое и новое сложное вещества, называются реакциями замещения.
Химические реакции, в ходе которых два вещества обмениваются своими компонентами, образуя два новых вещества, называются реакциями обмена.
Классификация химических реакций по другим признакам будет рассматриваться в следующих параграфах.
Выводы:
- Химические реакции — это преобразование одних веществ (исходных соединений) в другие (продукты реакции).
- Химические реакции по общим признакам разделяют на типы. По количеству исходных веществ и конечных продуктов химические реакции разделяют на реакции соединения, разложения, замещения и обмена.
- По тепловому эффекту реакции делятся на эндотермические, протекающие с поглощением теплоты, и экзотермические — с выделением теплоты.
- Реакции, протекающие при наличии катализатора, называются каталитическими, а без его участия — некаталитическими.
Справочный материал по окислительно-восстановительным реакциям
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ:
- -соединения
- -замещения
- -обмена
- -разложения
Степень окисления — это условный заряд атома в веществе, который возник бы на атоме при условии, что общие электронные пары полностью сместились к более электроотрицательному элементу (то есть атомы превратились бы в ионы)
Окислительно-восстановительные реакции — это реакции, протекающие при изменении степеней окисления элементов, которые входят в состав реагирующих веществ
Ты уже знаешь разные типы химических реакций. Так, по количеству веществ, которые принимают участие и образуются в ходе реакции, реакции классифицируют на следующие типы: соединения, разложения, замещения и обмена.
Среди разнообразных химических реакций можно выделить и такие, которые протекают с изменением степеней окисления элементов, входящих в состав реагирующих веществ. По этому признаку все химические реакции делятся на два типа:
1. Реакции, протекающие без изменения степеней окисления элементов, которые входят в состав реагирующих веществ. Например:
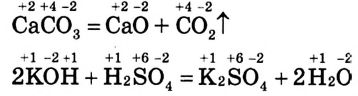
Обрати внимание: степени окисления атомов каждого элемента до и после реакции остаются неизменными.
2. Реакции, протекающие с изменением степеней окисления атомов элементов,
которые входят в состав реагирующих веществ. Например: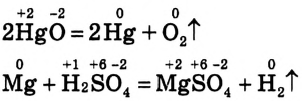
Здесь в первом уравнении ртуть и кислород, во втором — магний и водород изменили степени окисления.
Восстановление — процесс присоединения электронов атомом элемента
Окислителями называются вещества, атомы или ионы которых в ходе химической реакции способны присоединять электроны
Окисление — процесс отдачи электронов атомом элемента
Реакции, протекающие с изменением степеней окисления элементов, входящих в состав реагирующих веществ, называют окислительно-восстановительными.
Чем же объясняется изменение степеней окисления элементов? А тем, что в процессе реакции электроны переходят (или смещаются) от одних атомов к другим. Процесс отдачи электронов атомом элемента называют окислением, а процесс их присоединения — восстановлением.
В данном примере магний до реакции имеет степень окисления 0 (нуль), как обычно в простых веществах, а после реакции +2. Это означает, что каждый атом магния в процессе реакции отдаёт 2 электрона. То есть происходит процесс окисления. Атомы водорода до реакции имели степень окисления +1, а после реакции 0 (нуль). Следовательно, каждый атом водорода присоединил по одному электрону, то есть происходит процесс восстановления. Эти процессы можно представить следующими схемами:
Восстановителями являются вещества, атомы или ионы которых в ходе химической реакции способны отдавать электроны
- восстановитель:
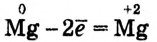 (процесс окисления)
(процесс окисления) - окислитель:
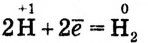 (процесс восстановления)
(процесс восстановления)
Вещества, отдающие в процессе химической реакции электроны, называ-ются восстановителями.
В данном примере магний — восстановитель. Отдавая электроны, он окисляется. А атомы водорода со степенью окисления +1 в составе серной кислоты присоединяют электроны и восстанавливаются до газообразного водорода 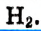
Вещества, присоединяющие в ходе химической реакции электроны, называются окислителями.
Окислитель в процессе реакции восстанавливается, а восстановитель — окисляется
Процессы окисления и восстановления всегда взаимосвязаны
Следовательно, окислитель в процессе реакции восстанавливается, а восстановитель — окисляется.
В каждой окислительно-восстановительной реакции всегда имеются вещества, атомы химических элементов которых отдают либо присоединяют электроны. Это означает, что процессы окисления и восстановления всегда сопровождают друг друга.
Независимо от того, переходят электроны от одного атома к другому полностью или только частично смещаются (оттягиваются), условно говорят лишь об отдаче и присоединении электронов.
Подбор коэффициентов: Коэффициенты в окислительно-восстановительных реакциях удобно подбирать по методу электронного баланса. В его основе лежит сравнение степеней окисления атомов в исходных и образующихся веществах.
Рассмотрим конкретный пример. Например, необходимо подобрать коэффициенты в уравнении реакции взаимодействия меди с разбавленным раствором плотной кислоты, протекающей по следующей схеме:
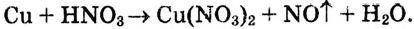
Используй такой алгоритм выполнения:
1. Определи, какие атомы изменяют степень окисления, и укажи её над символами элементов:
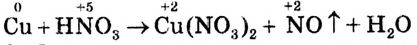
2.Запиши электронные уравнения и укажи, сколько электронов отдаёт восстановитель и сколько электронов присоединяет окислитель:
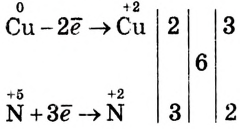
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных (образующихся) веществах
Окислительно-восстановительные реакции протекают с изменением степеней окисления обычно двух элементов, которые входят в состав исходных и конечных продуктов
Такая запись означает, что каждый атом меди со степенью окисления 0 (нуль)
отдаёт 2 электрона и преобразуется в 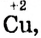 то есть медь
то есть медь  — восстановитель. Атомы азота со степенью окисления +5 (в составе азотной кислоты) присоединяют каждый по 3 электрона, превращаясь в
— восстановитель. Атомы азота со степенью окисления +5 (в составе азотной кислоты) присоединяют каждый по 3 электрона, превращаясь в 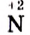 (в составе оксида азота
(в составе оксида азота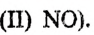 Следовательно,
Следовательно, 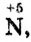 точнее
точнее 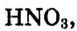 — окислитель.
— окислитель.
Число отданных и присоединённых электронов вынеси за вертикальную линию и, чтобы уравнять, найди для этих чисел наименьшее общее кратное 6 и раздели на эти числа, получишь дополнительные множители. Они записываются за третьей вертикальной линией. Помни, что общее число электронов, отданных восстановителем, должно быть равным числу электронов, которые присоединяет окислитель. Дополнительные множители, записанные после третьей вертикальной линии, — коэффициенты для восстановителя и окислителя.
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель
На окислительно-восстанови-тельных реакциях базируется производство металлов и неметаллов, аммиака, азотной и серной кислот, различных лекарств
3. Напиши в схеме реакции эти коэффициенты для восстановителя и окислителя, уравняй число их атомов в обеих частях уравнения:
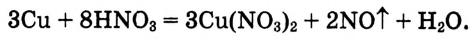
4. Методом подбора определи коэффициент перед формулой воды. Уравнение этой реакции имеет следующий вид:
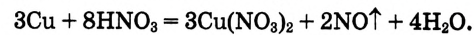
5. Для проверки правильности написания уравнения сравни количество атомов каждого элемента в обеих частях уравнения.
Иногда достаточно проверить число атомов кислорода в обеих частях уравнения.
Значение: Окислительно-восстановительные реакции играют большую роль в природе и технике. Они самопроизвольно протекают в природных биологических системах — фотосинтез у растений, процессы дыхания у человека и животных и т. д. Сжигание топлива на тепловых электростанциях, в двигателях внутреннего сгорания — это также примеры окислительно-восстановительных реакций. Их использование даёт возможность получать металлы, органические и неорганические соединения, очищать различные вещества, природные и сточные воды, газовые выбросы электростанций, заводов и т. д.
Выводы:
- Окислительно-восстановительные реакции протекают с изменением степеней окисления обычно двух элементов, входящих в состав исходных и конечных продуктов.
- Изменение степеней окисления элементов обусловливается переходом (смещением) электронов от одних атомов к другим.
- Отдача электронов, то есть окисление, всегда сопровождается присоединением электронов, то есть восстановлением. И, напротив, восстановление всегда сопровождается окислением.
- Окислительно-восстановительные реакции — это единство двух противоположных процессов — окисления и восстановления.
- Вещества, присоединяющие электроны, — это окислители, в процессе реакции они восстанавливаются, а вещества, отдающие электроны, — восстановители, они окисляются.
Энергетический эффект химических реакций. Термохимические уравнения
Экзо- и эндотермические реакции: Ты уже знаешь, что в процессе химических реакций сохраняются число атомов, их общая масса, количество электрических нарядов, а изменяются только химические связи между атомами: одни — разрушаются, другие — возникают. На разрушение химических связей необходима энергия, а при образовании новых связей энергия высвобождается.
Обратимся к демонстрационным опытам.
Опыт 1. Поджигаем магниевую ленту (рис. 51):
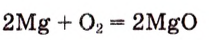

Рис. 51. Горение магния
Магний горит ярким пламенем. При этом происходит перегруппировка атомов магния и кислорода с формированием оксида магния, что сопровождается выделением теплоты и света.
Химические реакции, протекающие с выделением теплоты, называются экзотермическими.

Рис. 52. Разложение малахита
По тепловому эффекту различают экзотермические и эндотермические реакции
Выделение или поглощение теплоты в процессе химической реакции объясняется преобразованием электронных структур атомов, молекул, ионов
Опыт 2. В пробирку насыпаем тёмно-зелёные кристаллы малахита 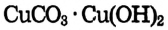 (или
(или 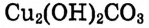 — основная соль), закрываем пробирку пробкой с газоотводной трубкой, конец которой погружаем в стакан с известковой водой. Пробирку закрепляем в штативе наклонно, как показано на рис. 52, и нагреваем:
— основная соль), закрываем пробирку пробкой с газоотводной трубкой, конец которой погружаем в стакан с известковой водой. Пробирку закрепляем в штативе наклонно, как показано на рис. 52, и нагреваем:
Наблюдаем образование вещества чёрного цвета — оксид меди Помутнение известковой воды свидетельствует о выделении углекислого газа
Помутнение известковой воды свидетельствует о выделении углекислого газа  а на стенках пробирки с малахитом появились капли воды
а на стенках пробирки с малахитом появились капли воды  Это реакция разложения малахита. Она требует постоянного нагревания. Если прекратить нагревание, то прекратится и реакция. Это означает, что она протекает с поглощением теплоты.
Это реакция разложения малахита. Она требует постоянного нагревания. Если прекратить нагревание, то прекратится и реакция. Это означает, что она протекает с поглощением теплоты.
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими.
Возникает вопрос: почему в одних случаях в ходе реакции энергия высвобождается, а в других — поглощается?
Внутренняя энергия и тепловой эффект реакции: Из курса физики ты знаешь, что каждое вещество имеет определённый запас энергии. Это внутренняя энергия, то есть энергия хаотичного (теплового) движения всех частиц в составе вещества (атомов, молекул, ионов, протонов, электронов и т. д.).
В процессе химической реакции, если одни связи разрушаются, а другие образуются, внутренняя энергия вещества изменяется. Это объясняется тем, что перестраиваются электронные структуры атомов, ионов, молекул. А это обусловливает выделение или поглощение теплоты (света, электрического тока) либо других форм энергии. Например, сгорание многих веществ протекает с выделением теплоты и света. Соединение металлов с серой или хлором, нейтрализация кислот щелочами также сопровождаются выделением значительного количества теплоты. При этом такие реакции, как разложение карбоната кальция 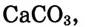 малахита
малахита 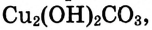 перманганата калия
перманганата калия 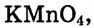 образование оксида азота
образование оксида азота N0 из азота и кислорода, протекают с поглощением теплоты.
N0 из азота и кислорода, протекают с поглощением теплоты.
Теплота, которая высвобождается либо поглощается в ходе химических реакций, называется тепловым эффектом реакции.
Ход реакции
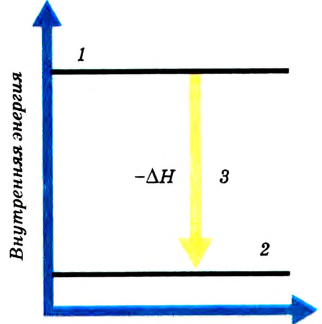
Рис. 53. Тепловой эффект экзотермической реакции:
1 — энергия исходных веществ;
2 — энергия продуктов реакции;
3 — выделение теплоты
Ход реакции
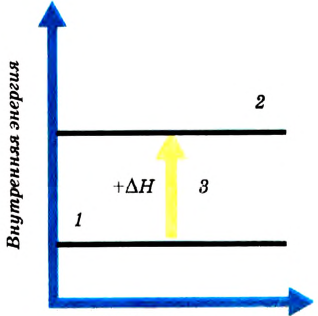
Рис. 54. Тепловой эффект эндотермической реакции:
1 — энергия исходных веществ;
2 — энергия продуктов реакции;
3 — поглощение теплоты
Тепловой эффект реакции обозначается  (читается «дельта аш») и выражается в джоулях (Дж) или кратных единицах — килоджоулях (кДж).
(читается «дельта аш») и выражается в джоулях (Дж) или кратных единицах — килоджоулях (кДж).
Разумеется, если реакция экзотермическая, то есть сопровождается выделением теплоты, это означает, что содержание энергии в исходных веществах было больше, чем в продуктах реакции (рис. 53). А для эндотермических реакций, которые нуждаются в поступлении теплоты извне, напротив, содержание энергии в исходных веществах меньше, чем в полученных продуктах (рис. 54). Следовательно,
Внешняя среда:
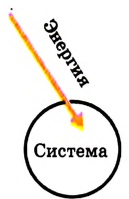
Реакция эндотермическая, величина 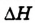 положительная
положительная
Внешняя среда
Реакция экзотермическая, величина 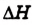 отрицательная
отрицательная
Рис. 55. Схема эндотермических (а) и экзотермических (б) процессов
Тепловой эффект реакции 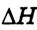 — это разность между содержанием энергии в исходных веществах и конечных про дуктах реакции.
— это разность между содержанием энергии в исходных веществах и конечных про дуктах реакции.
В этом заключается физическая сущ ность величины 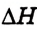 (греческая буква
(греческая буква  — «дельта» означает «различие, изменение»).
— «дельта» означает «различие, изменение»).
Поскольку тепловой эффект вычисляется относительно всей реакционной системы, то для экзотермических реакций, если теплота выделяется и энергия реакционной системы уменьшается, он является отрицательным. Для эндотермических реакций, если теплота поглощается и энергия системы увеличивается, тепловой эффект реакции 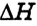 — положительный (рис. 55).
— положительный (рис. 55).
Тепловые явления, сопровождающие химические реакции, изучает термохимия (один из разделов химической термодинамики).
Термохимические уравнения. Ты уже знаешь, что при сгорании веществ, например водорода, теплота выделяется. Этот процесс выражается уравнением:
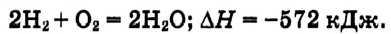
Химические уравнения с указанием количества теплоты, которая выделяется или поглощается, называются термохимическими уравнениями.
Обрати внимание: тепловой эффект реакции записывают отдельно от химического уравнения, после точки с запятой. Он касается такого числа молей вещества, которое определяется уравнением реакции. В данном примере при взаимодействии каждых 2 моль водорода с 1 моль кислорода выделяется 572 кДж теплоты.
Согласно закону сохранения энергии такое же количество теплоты необходимо, чтобы разложить воду на водород и кислород:
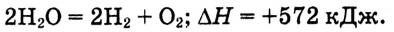
Для выполнения какой-либо реакции важно знать значение её теплового эффекта. В зависимости от того, протекает реакция с выделением или поглощением теплоты, определяют условия её проведения.
Пример №9
Составить термохимическое уравнение реакции горения алюминия, если известно, что на 1 моль образованного оксида алюминия выделяется 1582 кДж теплоты.
Дано:
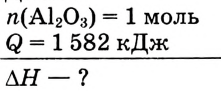
Решение:
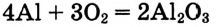 Тепловой эффект реакции составляет 2 моль 1 582 кДж/моль = 3 164 кДж. Поскольку реакция протекает с выделением теплоты, то тепловой эффект
Тепловой эффект реакции составляет 2 моль 1 582 кДж/моль = 3 164 кДж. Поскольку реакция протекает с выделением теплоты, то тепловой эффект 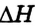 отрицательный. Следовательно, термохимическое уравнение имеет вид:
отрицательный. Следовательно, термохимическое уравнение имеет вид:
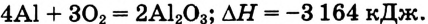
Пример №10
Вычислить количество теплоты, необходимой для разложения аммиака  количеством вещества 5 моль, если тепловой эффект реакции составляет 46 кДж/моль.
количеством вещества 5 моль, если тепловой эффект реакции составляет 46 кДж/моль.
Дано:
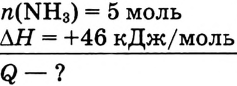
Решение:
Составляем термохимическое уравнение: 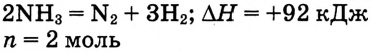
На разложение 2 моль  необходимо 92 кДж. На разложение 5 моль
необходимо 92 кДж. На разложение 5 моль  расходуется х:
расходуется х:
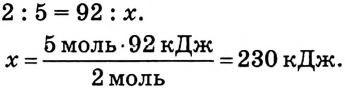
Ответ: на разложение аммиака количеством вещества 5 моль необходимо 230 кДж теплоты.
В литературе можно встретить устаревший способ записи термохимических уравнений, когда тепловой эффект реакции указан непосредственно в уравнении химической реакции, например:
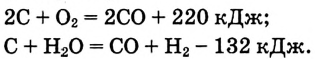
Здесь для экзотермической реакции тепловой эффект указан со знаком «плюс», для эндотермической реакции — со знаком «минус».
Мы используем современный термодинамический способ записи термохимических уравнений, где знаки для экзо- и эндотермических реакций противоположные. Поэтому, пользуясь литературой прошлых лет, следует быть внимательным: какой способ — термохимический или термодинамический — используется для записи термохимического уравнения.
Выводы:
- Каждое вещество имеет определённую внутреннюю энергию, то есть энергию хаотичного (теплового) движения и взаимодействия всех его микрочастиц. В ходе химической реакции происходит изменение внутренней энергии реагирующих веществ и энергии системы в целом. Такое изменение энергии связано с разрушением одних химических связей и образованием других. Поэтому химические реакции сопровождаются определённым тепловым эффектом-поглощением или выделением теплоты.
- По тепловому эффекту химические реакции делятся на два типа: экзотермические, протекающие с выделением теплоты, и эндотермические,-с поглощением теплоты.
- В случае экзотермических реакций энергия реакционной системы уменьшается, и тепловой эффект
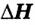 обозначают со знаком "минус"
обозначают со знаком "минус"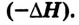 В случае эндотермических реакций энергия системы увеличивается,и тепловой эффект реакции
В случае эндотермических реакций энергия системы увеличивается,и тепловой эффект реакции 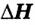 обозначают со знаком "плюс"
обозначают со знаком "плюс"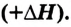
Скорость химических реакций
Ты уже ознакомился с основными типами химических реакций, умеешь отличать их от физических явлений и проводить расчёты, используя химические уравнения, а теперь научишься управлять химическими реакциями.
Для этого выясним сущность понятия "скорость химической реакции". Это понятие изучает один из разделов химии — химическая кинетика.
Тебе известно, что изделия из золота (рис. 56) сохраняют свои красоту и блеск на протяжении столетий, а изготовленные из железа — быстро ржавеют, в особенности во влажном воздухе, и со временем превращаются просто в металлолом. Ионные реакции протекают практически мгновенно, например: 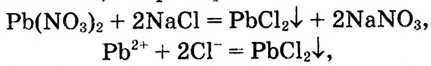
а выветривание горных пород — превращение гранита в песок, глину и другие вещества, продолжается столетиями. Следовательно, химические реакции протекают с разной скоростью.
О скорости химической реакции можно судить по изменению количества вещества реагента или продукта реакции за единицу времени в единице объёма.

Рис. 56. Золотая пектораль (Скифия, IV в. до н. э.)
Количество вещества в единице объёма называется молярной концентрацией. Она измеряется в моль/л, а время — в секундах. Итак, единица скорости химической реакции — моль/(л с):
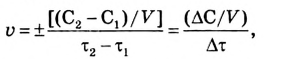
где 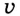 — скорость химической реакции;
— скорость химической реакции; 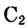 и
и 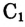 — исходная и конечная концентрации; V — объём;
— исходная и конечная концентрации; V — объём; 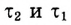 (греческая буква, читается «тау») — исходное и конечное время протекания химической реакции;
(греческая буква, читается «тау») — исходное и конечное время протекания химической реакции; 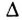 (греческая буква, читается «дельта» — синоним слова «изменение») — изменение концентрации (увеличение или уменьшение) в ходе реакции за время
(греческая буква, читается «дельта» — синоним слова «изменение») — изменение концентрации (увеличение или уменьшение) в ходе реакции за время 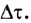
Поскольку концентрация исходных веществ в процессе реакции уменьшается, то в выражении скорости ставится знак «минус». Если скорость реакции определяется по продукту, а его концентрация увеличивается, то значение дроби является положительным. Учитывая, что скорость реакции можно вычислять по изменению концентрации любого компонента процесса, то в общем выражении скорости химической реакции ставят знак ±.
Пример:
В закрытой литровой ёмкости взаимодействуют газы А и В согласно уравнению А + В = АВ. Концентрация газа А в определённый момент времени была 0,04 моль/л, а через 50 с стала 0,01 моль/л. Определи скорость химической реакции.

Рис. 57. Памятник
Пример;
Бронзовый памятник под воздействием влажного воздуха покрывается зелёным налётом основного карбоната меди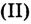
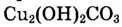
Дано:
Решение:

Ответ: 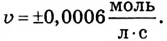
Скорости изменения концентраций исходных веществ и конечных продуктов — взаимосвязанные величины. Если перед формулами всех реагентов в уравнении реакции одинаковые коэффициенты, то изменение концентраций этих реагентов во времени также будет одинаковым. Для реакций с разными коэффициентами перед формулами реагентов в уравнении скорости изменения концентраций реагентов будут разными. Например, из уравнения реакции
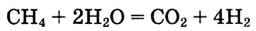
видно, что концентрация 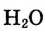 изменяется в 2 раза, а концентрация
изменяется в 2 раза, а концентрация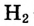 — в 4 раза быстрее, чем концентрация
— в 4 раза быстрее, чем концентрация 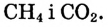 Это логично, поскольку в процессе реакции на 1 моль
Это логично, поскольку в процессе реакции на 1 моль 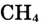 требуются 2 моль
требуются 2 моль 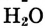 и образуются 1 моль
и образуются 1 моль 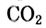 и 4 моль
и 4 моль 
Следовательно, чтобы определить, с какой скоростью протекает реакция, следует знать:
- а) какое количество вещества расходуется (для исходного вещества) или образуется (для продукта реакции);
- б)за какое время это происходит;
- в)в каком объёме осуществляется реакция.
В жизни часто возникает необходимость управлять скоростью химической реакции. Для разжигания огня, например, надо ускорить реакцию горения, а для гашения пожара — замедлить и погасить. Нежелательной реакцией является ржавление железа. Если остановить этот процесс мы не можем, то хотя бы замедлить можно.
Итак, одни реакции необходимо ускорять, а другие — замедлять. Для этого нужно знать, от чего зависит их скорость. Рассмотрим факторы, влияющие на скорость протекания химических реакций.
1. Природа реагирующих веществ. Ты уже знаешь, что в процессе реакции происходит разрушение химических связей. Следовательно, прочность связей влияет на скорость реакции. Так, скорость взаимодействия металлов с кислотами зависит от того, какой взяли металл (и какую кислоту). Например, при взаимодействии магния с соляной кислотой скорость выделения водорода больше, чем при взаимодействии цинка с этой же кислотой. В свою очередь, железо взаимодействует с соляной кислотой ещё медленнее, чем цинк, а медь вообще не взаимодействует (рис. 58).

Рис. 58. Зависимость скорости выделения водорода от природы металла, взаимодействующего с кислотой
2. Степень измельчения (раздробления) веществ. Безусловно, тебе известно, что дрова легче разжечь, если сначала полено порубить на щепки. Сложно поджечь кусок сахара, а вот сахарная пудра может мгновенно вспыхнуть и даже взо рваться. Это объясняется тем, что в твёрдом веществе частицы не могут свободно перемещаться, они лишь подвергаются колебаниям. Поэтому реакция происходит только на поверхности твёрдого вещества. Если же вещество измельчить, то поверхность столкновения веществ увеличивается, соответственно возрастает скорость реакции между ними (рис. 59).
Рис. 59. Дополнительная поверхность после разрушения
3. Концентрация реагирующих веществ. Если сравнить горение веществ на воздухе и в чистом кислороде, легко заметить, что в чистом кислороде горение происходит интенсивнее (почему?). Ты знаешь, что в воздухе на долю молекул кислорода приходится до 1/5 молекул всех газов, то есть концентрация молекул кислорода в воздухе почти в 5 раз меньше, чем в чистом кислороде. Поэтому количество столкновений молекул в чистом кислороде возрастает, следовательно, и скорость реакции увеличивается.
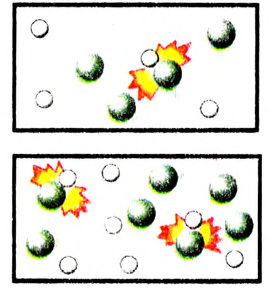
скорость реакции увеличивается с повышением концентрации реагентов
4. Температура. Ты уже знаешь, что для начала реакции частицы исходных веществ должны столкнуться. Если реакционную смесь нагреть, то частицы исходных веществ ускоряют свое движение, и вероятность их столкновения увеличивается. Поэтому подавляющее большинство реакций при нагревании протекает быстрее.
Повышение температуры как фактор ускорения процесса широко используется на предприятиях в производстве самых разных продуктов. Это повышает экономичность процесса, снижает себестоимость продукции.
Выводы:
- Скорость химической реакции определяется количеством вещества, прореагировавшего (или образовавшегося) за определённый период времени в определённом объёме.
- Скорость химической реакции зависит от природы реагирующих веществ, степени их измельчения (увеличения поверхности столкновения), концентрации и температуры.
Катализ
Тебе необходимо понимать сущность понятий: катализ; каталитическая реакция; отравление катализатора; ингибитор;
Уметь объяснять: сущность каталитического действия; значение каталитических процессов.
Тебе уже известны факторы, влияющие на скорость химической реакции. Это природа реагирующих веществ, степень их измельчения (увеличение поверхности соприкосновения), концентрация и температура. Ещё один важный фактор, определяющий скорость реакции, — наличие катализатора.

Рис. 60. Приготовление смеси порошкообразного алюминия и порошка кристаллического йода

Рис. 61. Вода — катализатор
Обратимся к опытам.
Опыт 1. На листе бумаги смешиваем примерно равные объёмы порошкообразного алюминия и растёртого в порошок кристаллического иода (рис. 60). Смесь горкой высыпаем на керамическую плитку (или жесть), в углубление в горке капаем из длинной пипетки (или стеклянной трубки) 1 — 2 капли воды (большее количество воды тормозит протекание реакции). Начинается бурная реакция 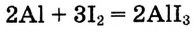
Вода в данном случае является катализатором взаимодействия алюминия с йодом (рис. 61).
Как объяснить наблюдаемые явления — появление фиолетовых паров, пламени и т. д.?
Эта реакция — экзотермическая. От теплоты, которая выделяется, полученный трииодид алюминия испаряется, а в условиях высокой температуры сгорает в кислороде воздуха с образованием оксида алюминия (белого порошка), искр и простого вещества иода, последний испаряется в виде фиолетового облачка.
Опыт 2. В колбу наливаем 20—30 мл раствора перекиси водорода с массовой долей 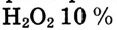 и добавляем немного (на кончике шпателя) оксида марганца
и добавляем немного (на кончике шпателя) оксида марганца
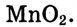 Наблюдаем бурное выделение газа (эффект кипения). Как доказать, что этот газ — кислород? К отверстию колбы подносим тлеющую лучинку. Она вспыхивает, поскольку перекись водорода при каталитическом воздействии
Наблюдаем бурное выделение газа (эффект кипения). Как доказать, что этот газ — кислород? К отверстию колбы подносим тлеющую лучинку. Она вспыхивает, поскольку перекись водорода при каталитическом воздействии 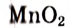 разлагается, выделяя кислород (рис. 62):
разлагается, выделяя кислород (рис. 62): 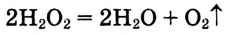
А как доказать, что оксид марганца
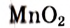 выполняет в этой реакции роль катализатора?
выполняет в этой реакции роль катализатора?
Сначала отфильтруем чёрный порошок 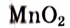 , а потом добавим его к новой порции перекиси водорода. Эффект тот же: оксид марганца
, а потом добавим его к новой порции перекиси водорода. Эффект тот же: оксид марганца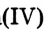 разлагает новую порцию перекиси водорода
разлагает новую порцию перекиси водорода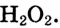
Обрати внимание: после разложения псей перекиси водорода 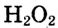 катализатор
катализатор 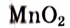 остался на дне колбы в неизменном ниде. Именно этот факт может привести к ошибке: ты подумаешь, что катализатор не принимает участия в реакции. Тогда возникает вопрос, как же он влияет на её скорость?
остался на дне колбы в неизменном ниде. Именно этот факт может привести к ошибке: ты подумаешь, что катализатор не принимает участия в реакции. Тогда возникает вопрос, как же он влияет на её скорость?
Доказано, что катализатор принимает участие в реакции. Например, реакция между веществами А и В происходит согласно уравнению А + В = АВ с очень малой скоростью. Ситуацию изменяет катализатор К. Он легко взаимодействует с одним из реагентов, например с веществом А, образуя промежуточное соединение АК. Последнее быстро взаимодействует с веществом В с образованием искомого АВ и высвобождением катализатора.

Рис. 62. Каталитическое разложение пероксида водорода
Реакции, протекающие при наличии катализатора, называются каталитическими, а процесс изменения скорости реакции под влиянием катализатора — катализом.
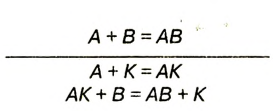
Действие катализатора: образование промежуточного соединения
Термин «катализ» обычно связывают с ускорением реакции. Так, оксид ванадия ускоряет окисление оксида серы
ускоряет окисление оксида серы в производстве серной кислоты:
в производстве серной кислоты:
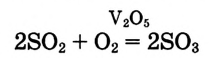
Катализатор направляет химическую реакцию по новому, энергетически более выгодному пути
Ингибиторы — замедлители реакции
Ферменты — это биологические катализаторы. Свойственны для живых организмов, ускоряют природные биохимические процессы
Иногда необходимо уменьшить скорость процесса, например коррозию металла. Для этого подбирают соответствующие замедлители реакции, их называют ингибиторами.
Но случается, что катализатор образует с реагирующим веществом (или примесями в нём) очень стойкое промежуточное соединение, из которого самопроизвольно освободиться не может. Тогда его каталитическое действие прекращается. Такое явление называют отравлением катализатора.
Катализаторы характеризуются специфичностью действия: они выборочно ускоряют какую-либо одну реакцию, а на скорость других не влияют. Универсального катализатора не существует. Для каждой реакции существует свой специфический катализатор. Хотя случается, что одно и то же вещество может воздействовать на скорость нескольких равных реакций.
Значение каталитических реакций: В современной химической промышленности преобладают каталитические процессы. Для переработки нефти, производства красителей, серной кислоты, аммиака, полимеров, синтетического каучука и многого другого необходимы катализаторы.
Они играют большую роль и в реакциях, протекающих в живых организмах. Биологические катализаторы — ферменты — обеспечивают стабильное и непрерывное протекание биохимических процессов.Однако и в организме возможно отравление биологических катализаторов. Ферменты могут быть отравлены алкоголем (или продуктами его окисления), никотином либо другими вредными веществами. В этом случае происходит нарушение ряда процессов, организм начинает болеть, а иногда и погибает.
Алкоголь, никотин отравляют ферменты
Выводы:
Катализаторы — это вещества, ускоряющие химические реакции, но сами при этом остаются в неизменном количестве. Реакции, протекающие при наличии катализаторов, называют каталитическими, а сам процесс изменения скорости реакции под влиянием катализатора — катализом.
- Катализатор принимает участие в химической реакции. Он способствует разрыву связей в исходных веществах, поэтому реакция становится энергетически более выгодной.
- Для катализаторов характерно такое явление, как отравление, тогда их каталитическое действие прекращается. Поэтому катализаторы необходимо защищать, в частности биологические (ферменты), от каталитических ядов — алкоголя, никотина, других вредных веществ.
- Современную химическую промышленность трудно представить без катализаторов, да и сама жизнь человека, существование животного и растительного мира — всё это базируются на каталитических процессах.
Химическое равновесие
Реагенты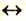 Продукты
Продукты
Ты уже знаешь, что химические реакции — это взаимодействие исходных веществ (реагентов) и образование конечных продуктов. Но не следует думать, что направление химической реакции только одно (реагенты  продукты). В действительности химические реакции протекают в прямом и обратном направлениях.
продукты). В действительности химические реакции протекают в прямом и обратном направлениях.

Рис.63.Взаимодействие магния с серой кислотой-необратимая реакция
Опыт 1. В пробирку с разбавленной серной кислотой опускаем стружку магния:
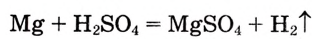
Реакция заканчивается тогда, когда весь магний прореагирует (рис. 63). Если попытаться провести эту реакцию в обратном направлении, то есть пропускать водород в раствор сульфата магния, то металлический магний и серная кислота при этом не образуются. Следовательно,данная реакция не может протекать в оо-ратном направлении, она необратимая.
Опыт 2. В большую демонстрационную пробирку помещаем кристаллы хлорида аммония 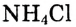 массой 2—3 г, слегка прикрываем отверстие пробирки стекловатой и нагреваем. Хлорид аммония разлагается с образованием двух газов — аммиака
массой 2—3 г, слегка прикрываем отверстие пробирки стекловатой и нагреваем. Хлорид аммония разлагается с образованием двух газов — аммиака  и хлорида водорода
и хлорида водорода 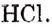 В верхней, более холодной части пробирки они взаимодействуют между собой с образованием мелких кристалликов хлорида аммония
В верхней, более холодной части пробирки они взаимодействуют между собой с образованием мелких кристалликов хлорида аммония 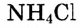 (рис. 64), и мы видим густой белый дым:
(рис. 64), и мы видим густой белый дым: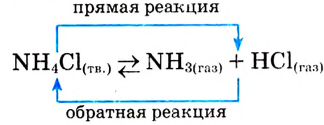
- 1).Аммонии хлорид сублимируется, и обратная реакция происходит с образованием газов хлорида водорода и аммиака — это прямая реакция
- 2).Аммоний хлорид повторно конденсируется
- 3).Твёрдый хлорид аммония
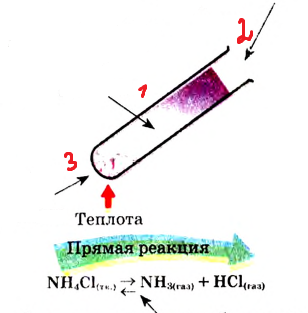
Этот символ означает обратимость

Рис. 64. Обратимая реакция
Реакция, в процессе которой из исходных веществ образуются конечные продукты, называется прямой реакцией. В уравнении реакции обозначают стрелочкой, направленной слева направо.
Реакция, в процессе которой исходные вещества являются продуктами реакции, называется обратной реакцией. В уравнении реакции обозначают стрелочкой, направленной справа налево.
Химические реакции, протекающие одновременно в противоположных направлениях, называются обратимыми.

Рис. 65. Обезвоживание медного купороса
В уравнениях обратимых реакций вместо знака «равенства» ставят две стрелки направленные в противоположные сто ны, например:
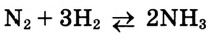
В начале реакции концентрации исходных веществ азота и водорода — большие, как и скорость прямой реакции. По мере расходования исходных веществ скорость прямой реакции уменьшается. При этом накапливается продукт реакции аммиак  Пока его мало, скорость обратной реакции незначительная. С накоплением аммиака скорость обратной реакции возрастает. Наступает момент, когда скорости прямой и обратной реакций становятся равными (рис. 66). Это означает, что наступает химическое равновесие: сколько частиц исходных веществ вступает в прямую реакцию, именно столько их образуется в результате обратной реакции, то есть концентрации веществ остаются неизменными.
Пока его мало, скорость обратной реакции незначительная. С накоплением аммиака скорость обратной реакции возрастает. Наступает момент, когда скорости прямой и обратной реакций становятся равными (рис. 66). Это означает, что наступает химическое равновесие: сколько частиц исходных веществ вступает в прямую реакцию, именно столько их образуется в результате обратной реакции, то есть концентрации веществ остаются неизменными.
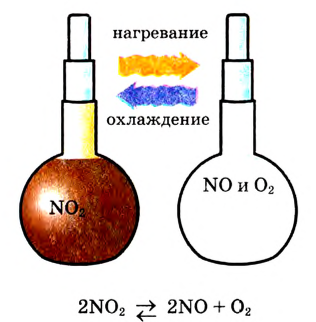
Рис. 66. Химическое равновесие
С достижением состояния равновесия обратимые реакции продолжают протекать с одинаковой скоростью, поэтому каких-либо изменений в реакционной системе не наблюдается. Такое равновесие называют динамичным. На момент его установления всегда можно обнаружить как продукты реакции, так и исходные вещества.
Иногда необходимо выделить один из продуктов обратимой реакции, преимущественно прямой. В этом случае влияют на установившееся равновесие и смещают его в нужном направлении. В итого, равновесие снова устанавливается.
Какие же факторы оказывают влияние на состояние химического равновесия? Химическое равновесие можно сместить, изменяя концентрацию веществ, температуру, а для газообразных соединений давление.
больше А
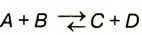
Увеличение концентрации А см смещает равновесие вправо
1. Влияние концентрации. Если при синтезе аммиака 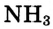 увеличить концентрацию азота
увеличить концентрацию азота 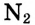 или водорода
или водорода 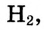 то равновесие сместится в сторону прямой реакции, и аммиака можно получить больше. Это понятно, ведь число молекул
то равновесие сместится в сторону прямой реакции, и аммиака можно получить больше. Это понятно, ведь число молекул 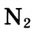 или
или 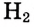 на единицу объёма увеличивается, сталкиваются они чаще, поэтому аммиака образуется больше.
на единицу объёма увеличивается, сталкиваются они чаще, поэтому аммиака образуется больше.
Экзотермическая реакция
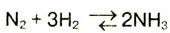
Эндотермическая реакция
Можно действовать иначе: уменьшать концентрацию продукта реакции. Если при взаимодействии азота с водородом постоянно удалять образующийся аммиак, то равновесие будет смещаться вправо, поскольку новые и новые порции азота и водорода начинают реагировать с образованием аммиака, чтобы компенсировать его удаление.2.Влияние температуры. Реакция синтеза аммиака экзотермическая, то ость происходит с выделением теплоты. Значит, если необходимо получить больше аммиака  то систему следует охлаждать. Тогда утраченная теплота будет пополняться за счёт прямой реакции, протекающей с выделением теплоты. Следовательно, всё новые и новые порции азота и водорода будут реагировать между собой. И, напротив, повышение температуры сопровождается ускорением обратной реакции,то есть разложением аммиака.
то систему следует охлаждать. Тогда утраченная теплота будет пополняться за счёт прямой реакции, протекающей с выделением теплоты. Следовательно, всё новые и новые порции азота и водорода будут реагировать между собой. И, напротив, повышение температуры сопровождается ускорением обратной реакции,то есть разложением аммиака.
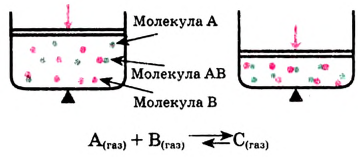
Мал. 67. Влияние давления на равновесие .Повышение давления смещает равновесие в сторону уменьшения числа молей газа, то есть понижения давления

Ле Шателье Анри-Луи (1850—1936) Французский физико-химик и металловед. Сформулировал (1884) закон смещения термодинамического равновесия (принцип Ле Шателье). Исследовал высокотемпературные процессы, металлические сплавы. Сконструировал металлографический микроскоп
3. Влияние давления. При сжатии газов реакция между ними будет протекать/ в сторону образования веществ, занимающих меньший объём (рис. 67). Обрати внимание на число молей в обеих частях уравнения синтеза аммиака. В левой части имеем 4 моль, а в правой — 2 моль. Следовательно, реакция протекает с уменьшением объёма, поэтому повышение давления способствует смещению равновесия вправо, в сторону образования аммиака.
Если реакция происходит без изменения объёмов реагирующих газов, например:
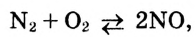
то давление не будет влиять на состояние равновесия.
Обрати внимание, что катализатор, оказывая заметное влияние на скорость реакции, совершенно не влияет на смещение равновесия, поскольку в одинаковой степени ускоряет как прямую, так и обратную реакции.
Все перечисленные точки зрения о способах смещения химического равновесия исследовал французский учёный Ле Шателье. Он сформулировал общий принцип смещения химического равновесия, названный в его честь принципом Ле Шателье:
внешнее влияние на систему, находящуюся в состоянии равновесия, способствует протеканию той реакции, которая ослабляет (сглаживает) это влияние.
Следовательно, система пытается противостоять изменению внешних условий (температуры, давления, концентрации). Если, например, температуру экзотермической реакции повышают при помощи нагревания, то, разумеется, сама система не может уменьшить внешнее на трепание. Но равновесие в системе смещается в сторону эндотермической реакции, протекающей с поглощением теплоты.
В промышленности использовать обратимые реакции невыгодно, поскольку выход продукта небольшой. Однако »то неизбежно. Поэтому высоко ценится умение управлять химическим равновесием, создавать для обратимых реакций такие условия, при которых равновесие смещается в сторону образования конечных продуктов, и обратимая реакция практически становится необратимой.
У необратимых реакций обратный процесс также наблюдается, но выражен слабо. Поэтому необратимые реакции практически протекают до конца. К ним относят обычно те реакции, в ходе которых:
 один из образующихся продуктов выходит из сферы реакции — выпадает в осадок или выделяется в виде газа:
один из образующихся продуктов выходит из сферы реакции — выпадает в осадок или выделяется в виде газа:
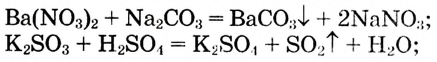
 образуется малодиссоциированное соединение (слабый электролит):
образуется малодиссоциированное соединение (слабый электролит):
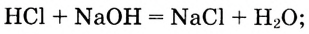
 реакция сопровождается выделением большого количества энергии:
реакция сопровождается выделением большого количества энергии:
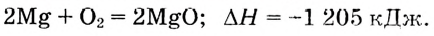
Рис. 68. Между осадком и его насыщенным раствором существует химическое равновесие: часть вещества из осадка непрерывно переходит в раствор,а из раствора — в осадок. Количество вещества осадка и концентрация раствора при этом не изменяются
Выводы:
- Химические реакции разделяют на обратимые и необратимые. Обратимые реакции протекают одновременно в двух противоположных направлениях — в прямом и обратном. Самопроизвольное про текание обратимых реакций происходит не до конца, а до определён' ного момента — до установления в системе химического равновесия. После наступления равновесия концентрации веществ, как исходных, так и продуктов реакции, при данных условиях остаются неизменными.
- На состояние химического равновесия влияют концентрация вещества, температура и давление (для газов). Под их влиянием равновесие смещается в том направлении — в сторону прямой или обратной реакции, — где это влияние сглаживается (сущность принципа Лe Шателье).
Всё о окислительно-восстановительные реакции
К концу XVIII в. широкое распространение в химии получила кислородная теория окисления. Согласно этой теории окисление — это процесс соединения вещества с кислородом, а восстановление — это процесс отнятия у него кислорода.
Вы познакомились с современной электронной теорией окислительно-восстановительных процессов. Она объясняет протекание этих процессов переходом электронов от восстановителя к окислителю.
Согласно данной теории в химических реакциях, протекающих с изменением степеней окисления атомов, происходит передача электронов от одних частиц к другим. Такими частицами могут быть атомы, ионы.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Частицы, которые в течение окислительно-восстановительных реакций отдают электроны, называются восстановителями, а процесс — окислением:

Из всех простых веществ легче всего окислению подвергаются металлы. Металлы в свободном состоянии могут быть только восстановителями и в своих соединениях проявляют только положительные степени окисления:

Частицы, которые принимают электроны, называются окислителями. Процесс присоединения электронов атомами или ионами — это восстановление:
Самые сильные окислители — атомы галогенов, так как они наиболее активно принимают электроны. Например:

Окисление невозможно без протекающего одновременно с ним восстановления. Поэтому каждая реакция, протекающая с переходом электронов, является единством двух противоположных процессов — окисления и восстановления, где окислитель восстанавливается, а восстановитель окисляется.
Процесс окисления сопровождается увеличением степени окисления атомов элементов, входящих в состав восстановителя, а процесс восстановления — наоборот, понижением степени окисления атомов элементов, входящих в состав окислителя:
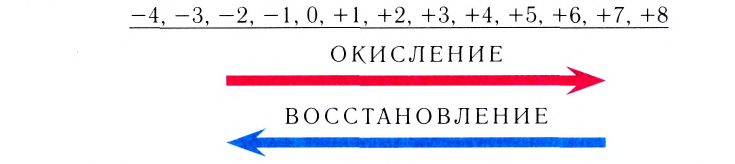
При составлении уравнений окислительно-восстановительных реакций необходимо соблюдать следующую последовательность:
- Записать схему химической реакции.
- Расставить степени окисления атомов элементов, выделить элементы, изменяющие степень окисления в ходе реакции, определить окислитель и восстановитель.
- Определить число отданных и принятых электронов, составить электронный баланс, т. е. уравнять число отдаваемых и принимаемых электронов.
- Подобрать коэффициенты для всех участников реакции.
Рассмотрим в качестве примера реакцию горения сероводорода H2S.
1. Запишем схему химической реакции:
2. Расставим степени окисления атомов элементов, выделим элементы, изменившие степень окисления в ходе реакции:
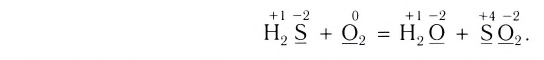
3. Определим число электронов, приобретенных двумя атомами кислорода (четыре) и отданных атомом серы (шесть). Запишем это в виде отдельных процессов — окисления серы и восстановления кислорода: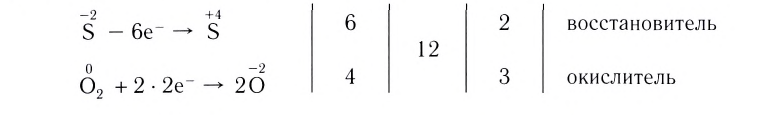
Для того чтобы сбалансировать число отданных и принятых электронов, находим наименьшее общее кратное этих чисел (12), которое поочередно делим на число отданных и принятых электронов. Результаты деления будут коэффициентами в уравнении химической реакции.
4. Переносим коэффициенты в левую часть схемы химической реакции:
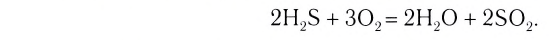
Числа атомов водорода, которые не участвовали в окислительно-восстановительном процессе, уравниваем подбором.
Этот метод уравнивания окислительно-восстановительных реакций называется методом электронного баланса и широко применим особенно в тех случаях, когда в качестве исходных берутся вещества, не диссоциирующие на ионы.
Обратите внимание, что уравнение процесса восстановления составлено для двух атомов кислорода. Это общее правило: число атомов в электронных схемах окисления и восстановления должно соответствовать их числу в формулах исходных веществ.
В реакциях с участием ионных соединений часть ионов участвует в окислительно-восстановительных процессах, часть — в реакциях обмена. Поскольку в методе электронного баланса рассматривается лишь переход электронов от восстановителя к окислителю, то найденные коэффициенты относятся только к формулам соединений, содержащих восстановитель и окислитель. Все остальные коэффициенты расставляются методом подбора.
Например, в химической реакции взаимодействия азотной кислоты с металлами часть атомов азота со степенью окисления +5 из нитрат-ионов восстанавливается, а часть в составе этих ионов идет на связывание ионов металла дня образования соли, не изменяя степени окисления.
Запишем схему химической реакции взаимодействия магния с азотной кислотой, расставим степени окисления элементов, изменивших ее в ходе реакции:
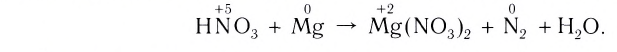
Определим число отданных и присоединенных электронов, окислитель и восстановитель:
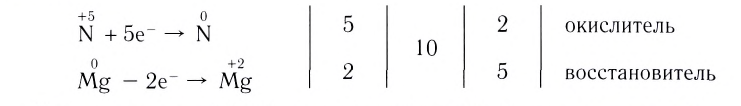
Расставляем коэффициенты, уравнивающие числа атомов в обеих частях схемы:
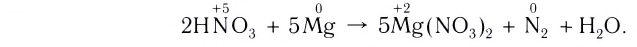
Как видно из схемы реакции, на связывание 5 моль ионов магния необходимо 10 моль нитрат-ионов, т. е. дополнительно 10 моль азотной кислоты, кроме тех 2 моль, которые пошли на окисление магния. Следовательно, в левой части уравнения перед формулой азотной кислоты коэффициент будет представлять сумму 2+10=12:
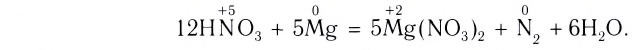
Для проверки правильности подобранных коэффициентов подсчитывают число атомов кислорода в левой и правой частях. Как вы уже заметили, все вышеприведенные реакции относятся к тому типу, когда степени окисления изменяют элементы в разных веществах.
Окислительно-восстановительные реакции являются самыми распространенными в природе, на производстве. В природе — это дыхание и обмен веществ во всех живых организмах, фотосинтез, брожение, гниение и многие другие процессы.
В промышленности их применяют при получении металлов, аммиака, кислот и многих других веществ в процессе изготовления фотографий и др. В повседневной жизни мы часто встречаемся с окислительно-восстановительными реакциями, например при ржавлении железных изделий, горении природного газа, потемнении серебряных ювелирных изделий и др.
- Окислительно-восстановительные реакции протекают с изменением степеней окисления химических элементов.
- Восстановители отдают электроны и окисляются, окислители их принимают и восстанавливаются.
- Числа электронов, отданных восстановителем и принятых окислителем в ходе химической реакции, должны быть равными.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |