
Ненасыщенные углеводороды в химии - основные понятия, формулы, определения и примеры
Содержание:
Ненасыщенные углеводороды:
Углеводороды ациклического или циклического строения, содержащие двойные или тройные углерод-углеродные связи, относят к ненасыщенным (табл. 10).
Ненасыщенными углеводородами называют органические соединения, И содержащие в составе молекул двойные или тройные углерод-углеродные связи.
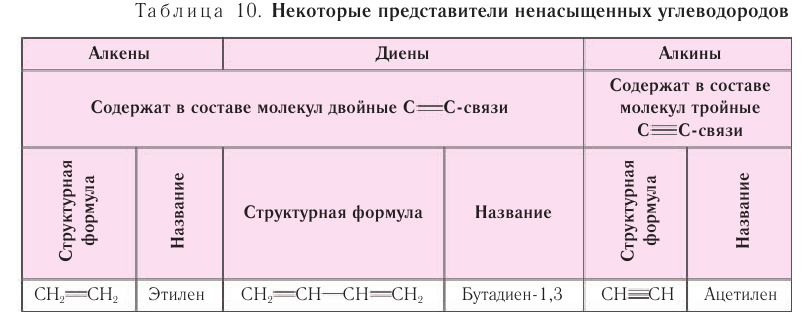
Рассмотрим последовательно строение, физические и химические свойства ненасыщенных соединений с одной двойной связью (алкены), двумя двойными связями (диены) и одной тройной связью (алкины).
Алкены
Алкены широко распространены в природе. Например, этилен является фитогормоном, ускоряющим созревание плодов. Насекомые выделяют некоторые алкены (феромоны), которые используются для привлечения особей другого пола, указания путей к пище и объявления опасности. Многие натуральные отдушки и ароматы в качестве основного компонента содержат алкены.
В незначительных количествах этилен содержится в природном газе и попутных газах при добыче нефти.
Строение алкенов
Простейшим алкеном является этилен (этен):
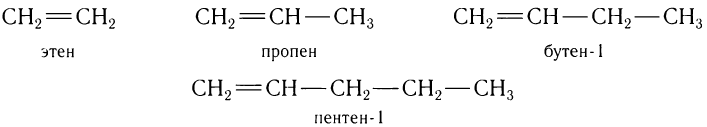
Углеводороды с одной двойной связью, как и алканы, образуют гомологический ряд, в котором любой последующий член ряда отличается по составу от предыдущего на одну группу
атомов —СН2—. Например, гомологический ряд алкенов от С2 до С5:
Состав углеводородов этого ряда можно выразить общей формулой 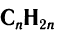 . Буква
. Буква 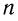 показывает число атомов углерода, которые могут содержаться в молекуле конкретного углеводорода.
показывает число атомов углерода, которые могут содержаться в молекуле конкретного углеводорода.
Общая формула алкенов 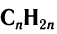 .
.
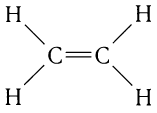
Строение алкенов рассмотрим подробно на примере этилена. Молекулярная формула этилена С2Н4. Структурной особенностью этилена является присутствие в молекуле двойной связи между атомами углерода:
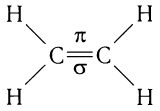
При образовании двойной связи обобществляются две пары электронов от соседних атомов углерода. Одна пара электронов образует 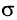 -связь (рис. 21, а).
-связь (рис. 21, а).
Другая связь образуется за счет перекрывания электронных облаков р - электронов по обе стороны от линии (показана на рисунке пунктиром), соединяющей центры атомов (рис. 21, б). Связь такого типа называют 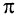 -связью.
-связью. 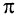 - Связь значительно отличается по энергии от
- Связь значительно отличается по энергии от 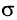 -связи (табл. 9).
-связи (табл. 9).
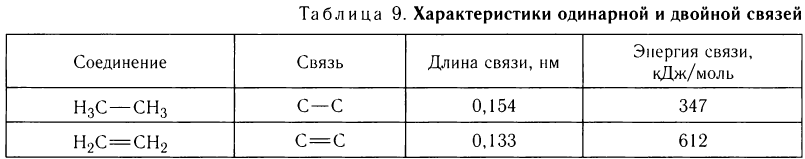
Из данных, представленных в таблице 9, видно, что энергия одинарной 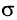 -связи равна 347 кДж/моль, а общая энергия двойной связи равна 612 кДж/моль. Отсюда следует, что энергия
-связи равна 347 кДж/моль, а общая энергия двойной связи равна 612 кДж/моль. Отсюда следует, что энергия 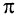 -связи в молекуле этилена равна 265 кДж/моль.
-связи в молекуле этилена равна 265 кДж/моль.
Таким образом, прочность 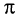 -связи меньше прочности а-связи, что и объясняет характерные для алкенов реакции присоединения с разрывом
-связи меньше прочности а-связи, что и объясняет характерные для алкенов реакции присоединения с разрывом 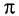 -связи.
-связи.
Физическими методами установлено, что молекула этилена имеет плоское строение: оси всех четырех связей С — Н молекулы этилена лежат в одной плоскости с валентными углами связей, равными приблизительно 120°.
Длина С = С-связи в молекуле этилена меньше одинарной связи в молекуле этана, она равна 0,133 им.
Днина С = С-связи равна 0,133 нм.
Электронная формула молекулы этилена:
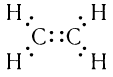
Из электронной формулы видно, что каждый атом углерода имеет устойчивую восьмиэлектронную оболочку, а каждый атом водорода — устойчивую двухэлектронную оболочку.
Масштабная и шаростержневая модели молекулы этилена приведены на рисунке 24.
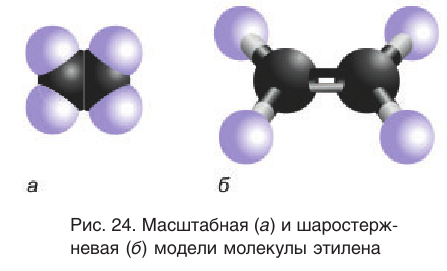
Аналогичное строение двойной связи характерно и для других алкенов.
Общая формула алкенов 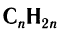 . Все шесть атомов молекулы этилена находятся в одной плоскости.
. Все шесть атомов молекулы этилена находятся в одной плоскости.
У этилена между атомами углерода, кроме а-связи, имеется другая связь, называемая 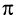 -связью. Прочность
-связью. Прочность 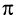 -связи меньше прочности
-связи меньше прочности 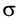 -связи, что и объясняет легкость ее разрыва в химических реакциях.
-связи, что и объясняет легкость ее разрыва в химических реакциях.
Номенклатура алкенов
Названия углеводородов с одной двойной связью образуют изменением суффикса -ан соответствующего насыщенного углеводорода, содержащего столько атомов углерода, сколько их имеется в углеродной цепи алкена, на суффикс -ен. Например:

По систематической номенклатуре ИЮПАК класс ненасыщенных углеводородов с одной двойной связью называют алкенами.
Если ненасыщенный углеводород содержит больше трех атомов углерода, цифра (локант), указывающая положение двойной связи, записывается после суффикса:
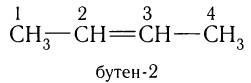
Нумерация углеродной цепи в случае ненасыщенных углеводородов определяется в первую очередь положением двойной связи, при этом атом углерода около двойной связи должен получить наименьший номер:
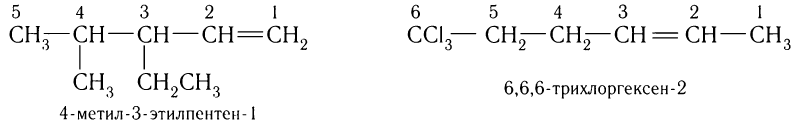
Во всех случаях записи названий веществ заместители приводятся в алфавитном порядке.
Изомерия алкенов
Для алкенов характерны несколько видов структурной изомерии: изомерия цепи (углеродного скелета), изомерия положения двойной связи и др. Эти виды изомерии рассмотрены в таблице 10 на примере алкенов, имеющих молекулярную формулу С4Н8.
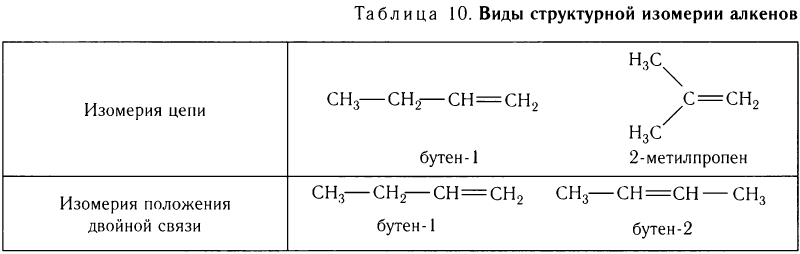
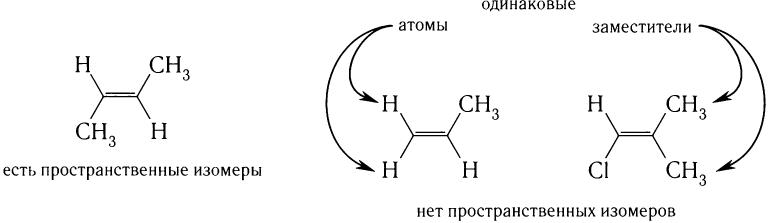
Кроме структурной изомерии, для алкенов характерна также пространственная изомерия (стереоизомерия). Пространственная изомерия является следствием отсутствия вращения заместителей вокруг двойной связи.
Пространственной изомерией обладают алкены, содержащие разные атомы или группы атомов у каждого из атомов углерода, образующих двойную связь:
Рассмотрим строение пространственных изомеров бутена-2 (рис. 23).
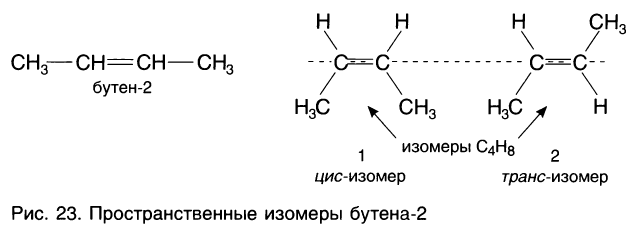
Расположение заместителей в структурной формуле алкена следует рассматривать относительно атомов углерода, образующих двойную связь. Если одинаковые заместители находятся по одну сторону двойной связи, то это цuc-изомер, если по разные стороны — транс-изомер бутена-2 (от лат. сis — на одной стороне, trans — через, на другой).
На рисунке 23 приведены формулы разных соединений, которые имеют и различные физические свойства (табл. 11). Различие в строении этих соединений лучше видно на самостоятельно приготовленных шаростержневых моделях. Модели при их наложении друг на друга не совмещаются. Их нельзя перевести друг в друга, поскольку вращение вокруг С = С-связи невозможно, так как оно приведет к разрыву  -связи. Модели, у которых заместители являются одинаковыми атомами, при наложении друг на друга полностью совпадают. Следовательно, если у любого атома углерода при двойной связи находятся одинаковые атомы или группы атомов, пространственные изомеры в этом случае отсутствуют.
-связи. Модели, у которых заместители являются одинаковыми атомами, при наложении друг на друга полностью совпадают. Следовательно, если у любого атома углерода при двойной связи находятся одинаковые атомы или группы атомов, пространственные изомеры в этом случае отсутствуют.
Физические свойства алкенов
Физические свойства алкенов рассмотрим на примере некоторых представителей с неразветвленной цепью атомов углерода. Их названия и важнейшие физические свойства приведены в
таблице 11.
Как и в случае алканов, температуры кипения алкенов увеличиваются с увеличением относительной молекулярной массы. Зависимость температур плавления соединений с двойными связями от молекулярной массы не имеет общего характера.
Для алкенов характерна структурная и пространственная цис-транс-изомерия.
Названия алкенов образуют изменением суффикса -ан в названии соответствующего насыщенного углеводорода на суффикс -ен.
Химические свойства алкенов
По химическим свойствам этилен и другие алкены сильно отличаются от ал-канов и при обычных условиях легко подвергаются многочисленным реакциям присоединения по следующей схеме:
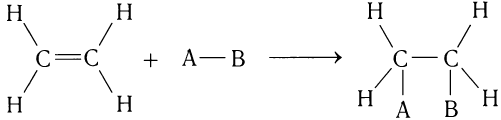
Атомы А и В могут быть одинаковыми (например, атомы брома) или разными (например, атом водорода и атом галогена).
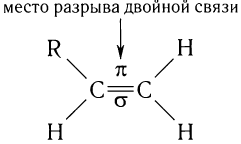
Реакции присоединения происходят за счет разрыва менее прочной  -связи. Многие реакции окисления алкенов также проходят за счет разрыва этой связи:
-связи. Многие реакции окисления алкенов также проходят за счет разрыва этой связи:
Реакции присоединения
1)Присоединение галогенов.
Этилен и другие алкены присоединяют при комнатной температуре галогены (хлор, бром, менее эффективно иод). Например, этилен присоединяет бром с образованием 1,2-дибромэтана:
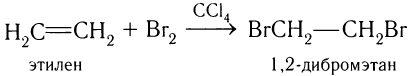
В процессе реакции происходит разрыв 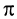 -связи в молекуле этилена и
-связи в молекуле этилена и 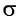 -связи в молекуле реагента с образованием двух
-связи в молекуле реагента с образованием двух 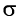 -связей С—Вr.
-связей С—Вr.
Так как этилен обесцвечивает раствор брома в воде (рис. 24), данная реакция используется как качественная реакция (химический тест) на присутствие двойных связей в органических соединениях.
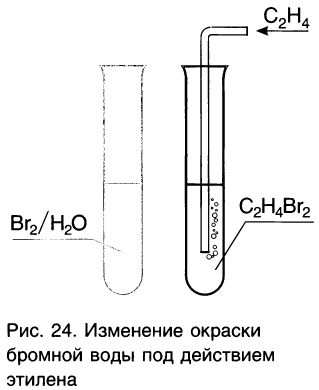
2)Присоединение водорода (гидрирование).
Присоединение к алкенам молекулярного водорода происходит при обычной или повышенной температуре под действием металлических катализаторов (платина, палладий, никель и др.), например:
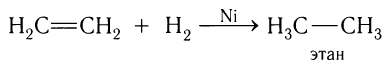
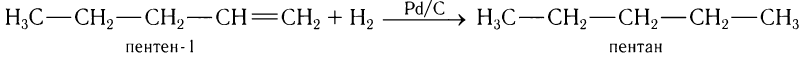
Практическое применение реакция такого типа находит в промышленности при превращении жидких жиров в твердые при получении маргарина.
Особым случаем реакции присоединения является реакция полимеризации этилена:
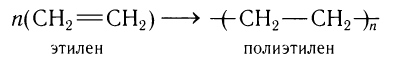
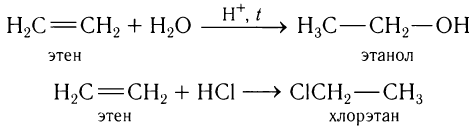
3)Присоединение воды (гидратация) и галогеноводородов к этилену.
Присоединение воды (в присутствии кислоты) и галогеноводородов к этилену происходит аналогично присоединению галогенов, например:
Реакции окисления
Алкены, как и большинство других соединений, содержащих двойную связь, достаточно легко окисляются кислородом воздуха, особенно при освещении. Реакция окисления приводит к образованию сложных смесей органических соединений. При этом качества веществ ухудшаются, они становятся непригодными к употреблению и иногда взрывоопасными. Поэтому хранить алкены следует на холоде и в темноте.
При реакциях окисления разрывается одна  -связь или обе С = С-связи.
-связь или обе С = С-связи.
1)Окисление перманганатом калия.
Алкены в отличие от алканов легко реагируют с окислителями. Так, при пропускании этилена через разбавленный раствор перманганата калия при низкой температуре фиолетовая окраска раствора исчезает (рис. 25):
Окисление перманганатом калия гомологов алкенов происходит аналогично окислению этилена.
Эта реакция может служить также качественной реакцией на этилен и другие углеводороды, содержащие двойные связи.
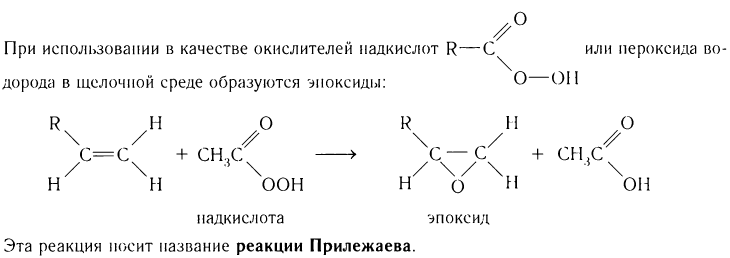
2)Полное окисление (горение).
Все алкены в избытке кислорода легко сгорают с образованием воды и оксида углерода(IV). Например:
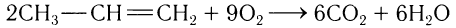
Этилен и его гомологи могут присоединять галогены, водород и воду. Алкены окисляются различными окислителями (КМnO4 и др.).
Реакция полимеризации алкенов
В современной жизни, вероятно, нет другого более важного продукта органической химии, чем синтетические полимеры (греч. поли — много, мерос — часть), получаемые в большинстве случаев из алкенов. Полимером называют молекулы очень большой длины и относительной молекулярной массы, с периодически повторяющимися одинаковыми группами атомов.
Исходный алкен А называют мономером, а образующийся в результате реакции продукт — полимером:
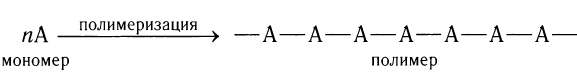
Многократно повторяющиеся группы атомов в полимерной цепи называют структурными звеньями.
Полимеризацией называется реакция синтеза высокомолекулярных соединений из низкомолекулярных, например алкенов. Исходный алкен называется мономером, а образующийся продукт реакции — полимером.
Получающиеся гигантские молекулы (их называют макромолекулами) интересны своими физико-химическими свойствами, благодаря которым полимеры незаменимы в технике и повседневной жизни.
Полимеры и пластмассы (основной компонент — полимер с добавкой красителя, стабилизатора, наполнителя и пластификатора) — легкие, прочные, относительно инертные материалы, не изменяют свои свойства в течение длительного периода времени.
Образование полимеров рассмотрим на примере реакции полимеризации этилена, в результате которой при многократном присоединении молекул этилена друг к другу образуется высокомолекулярное вещество — полиэтилен.
В общем виде схему реакции полимеризации этилена можно записать таким образом:
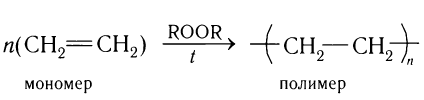
Полимеризацию проводят часто в присутствии веществ, называемых инициаторами, и их остатки находятся на концах цепей полимерных макромолекул.
Буква n обозначает степень полимеризации, которая показывает число молекул мономера, которые соединились в процессе полимеризации.
По радикальному механизму может происходить полимеризация и других мономеров.
Названия мономеров и строение полимеров, образующихся в результате реакции полимеризации этилена и его производных, приведены в таблице 12.

Свойства и применение полимеров
Образующиеся при полимеризации этена полимеры напоминают по структуре алканы с большим числом атомов углерода. Поэтому они не реагируют ни с концентрированными растворами щелочей, ни с концентрированными растворами кислот. При небольшом нагревании, например в горячей воде, они становятся мягкими и могут изменять форму.
Полиэтилен применяют для производства хозяйственных пакетов, труб, шприцев, предметов домашнего обихода, игрушек, пленки для парников и т. д.
Поливинилхлорид используется для получения искусственной кожи, полов, клеенки, труб, окон, дверей и изолирующих материалов для электрических проводов.
Полипропилен находит применение в производстве труб, вентилей, медицинских приборов и принадлежностей, упаковочной пленки и т.д.
Тефлон устойчив в концентрированных растворах щелочей и кислот при температурах порядка 250—300 °С. Применяется для изготовления электроизоляторов, покрытий для сковород и утюгов, различных устройств в химической и атомной промышленности.
Полимеризацией называется реакция синтеза высокомолекулярных соединений из низкомолекулярных соединений. Исходное соединение называют мономером, а образующийся продукт реакции — полимером.
Получение и применение алкенов
Получение этилена:
В химической промышленности этилен является самым высокотоннажным продуктом среди других органических соединений.
Для промышленных целей его получают высокотемпературным разложением углеводородов нефти. Наибольший выход этилена получается при пиролизе этана:
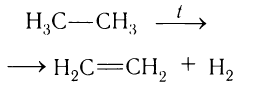
Этилен в лаборатории получают с небольшим выходом при разложении полиэтилена (рис. 26) или дегидратацией этанола:
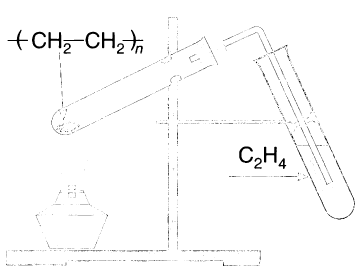
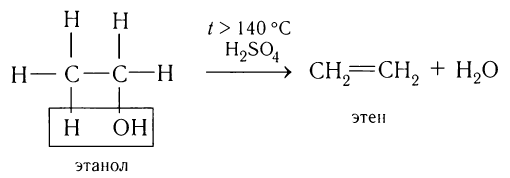
Получение алкенов:
1)Отщеплением галогеноводорода от галогеналканов при нагревании:
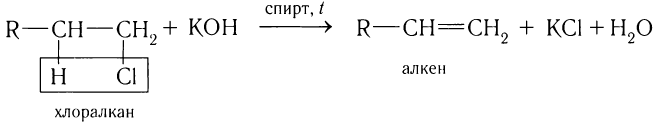
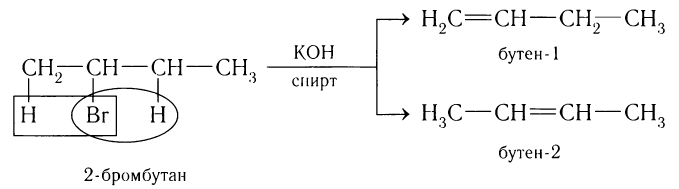
В зависимости от структуры исходного галогеналкана часто получается смесь алкенов. Например, при взаимодействии 2-бромбутана со спиртовым раствором щелочи образуются два продукта — бутен-1 и бутен-2. Схема реакции:
2)Дегидратация спиртов.
Алкены образуются при нагревании спиртов с концентрированными растворами минеральных кислот:
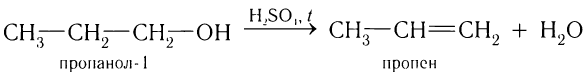
3)Гидрированием алкинов:
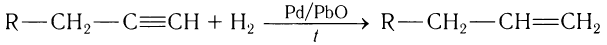
Применение этилена:
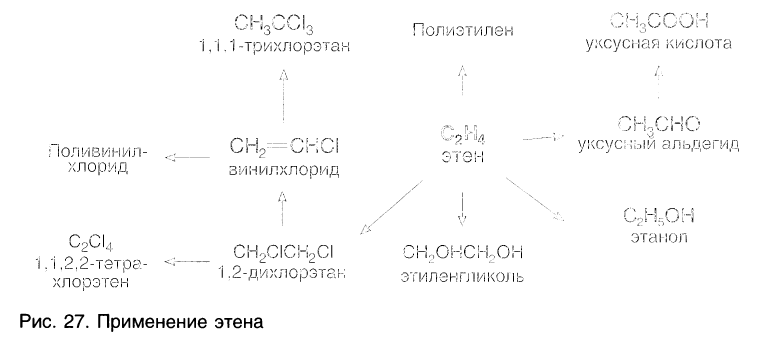
Этилен в промышленности преимущественно используют для получения полиэтилена. Примеры использования этилена в других отраслях хозяйства показаны на рисунке 27.
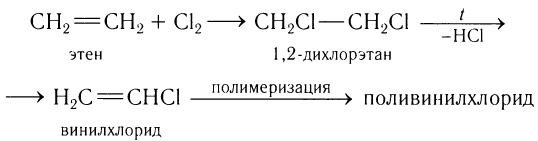
Второй по значимости пример использования этилена — превращение полученного из него винилхлорида в поливинилхлорид:
Большие количества этилена перерабатываются также в этиленоксид, далее в этиленгликоль, основную часть которого используют для. получения полиэтилентерефталата (лавсана). Тетрахлорэтен (перхлорэтилен) и 1,1,1-трихлорэтан применяют в качестве растворителей для сухой химчистки.
Этилен получают при крекинге углеводородов нефти. В лаборатории этилен получают дегидратацией этанола или разложением полиэтилена.
В лаборатории алкены получают отщеплением воды от спиртов, отщеплением галогеноводородов от галогеналканов и гидрированием алкинов.
Диены
Диенами называют углеводороды, содержащие в составе молекул две двойные связи.
В данном курсе изучаться будут только диены, у которых двойные связи разделены одинарной связью. Такая система связей называется сопряженной.
Диены в природе:
Углеводороды с сопряженными двойными связями широко распространены в природе: это растительные пигменты моркови, помидоров, листьев деревьев (окраска обнаруживается осенью после расщепления хлорофилла), а также близкий к ним по строению витамин А, канифоль из смолы хвойных деревьев, некоторые феромоны. Такого типа диены в природных условиях образуют натуральный каучук и гуттаперчу.
Строение диенов
Простейшим представителем диенов, у которых двойные связи разделены одной одинарной связью, является бутадиен-1,3. Его молекулярная формула С4Н6. Структурная формула:
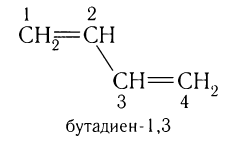
Общая формула диенов 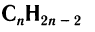 .
.
Строение диеновых углеводородов с сопряженными двойными связями отличается от строения углеводородов с двойными связями. Длины одинарных и двойных связей в молекулах обычно мало изменяются в зависимости от их строения. В то же время в молекуле бутадиена длина одинарной С—С-связи равна 0,148 нм, что короче связи С—С в алканах (см. табл. 9), а длина двойной связи — 0,134 нм, что немного длиннее двойных связей в алкенах. Наличие таких особенностей строения, как вы увидите далее, приводит к особым химическим свойствам диеновых углеводородов.
Номенклатура и изомерия диенов
В качестве основы для названия диенов выбирают углеродную цепь, содержащую обе двойные углерод-углеродные связи. Суффикс -ан соответствующего насыщенного углеводорода изменяют на суффикс -диен. Цифры, указывающие положение двойных связей, записывают после суффикса. Например:
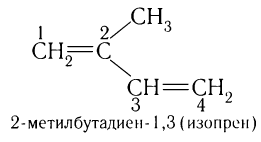
В случае диеновых углеводородов часто используют тривиальные названия. Например, бутадиен-1,3 иногда называют дивинилом, а 2-метилбутадиен-1,3 — изопреном. Название класса углеводородов с двумя двойными связями — диены.
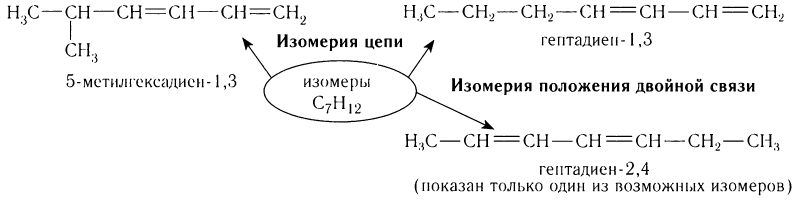
Для диенов характерны все виды структурной изомерии (изомерия цепи, изомерия положения двойной связи и т.д.). Рассмотрим изомерию на примере углеводорода, содержащего семь атомов углерода в составе молекул.
Физические свойства диенов
Бутадиен-1,3 представляет собой бесцветный газ, раздражающий слизистые оболочки, практически не растворимый в воде. Некоторые физические свойства диенов приведены в таблице 13.
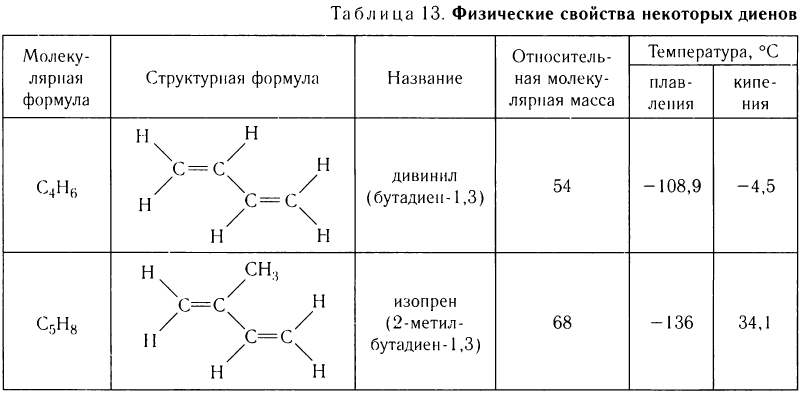
Химические свойства диенов
Диены так же, как алкены, вступают в реакции присоединения. Однако в отличие от алкенов, диены с сопряженными двойными связями в этих реакциях образуют смеси продуктов присоединения. Наряду с присоединением по двойной связи (называется 1, 2-присоединение) происходит присоединение и по концам системы сопряженных двойных связей молекулы (1, 4-присоединение).
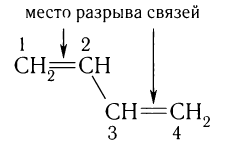
В последнем случае вместо одинарной связи между центральными атомами углерода образуется двойная связь.
1)Присоединение галогенов.
При взаимодействии брома или хлора с диенами образуется смесь изомеров 1, 2- и 1, 4-присоединения. Например, реакция бутадиена-1, 3 химическим количеством 1 моль с бромом химическим количеством 1 моль приводит к образованию смеси 3, 4-дибромбутена-1 и 1, 4-дибромбутена-2. Схема реакции:
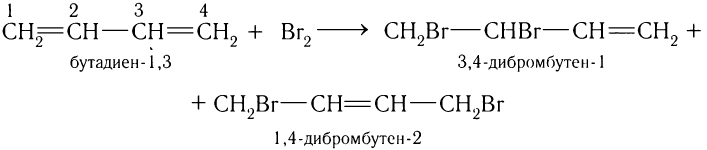
Соотношение продуктов зависит от условий проведения реакции.
2)Присоединение водорода.
Аналогично галогенам диены в реакции с водородом образуют продукты 1, 2- и 1, 4-присоединения. Например, бутадиен-1, 3 с водородом дает смесь бутена-1 и бутена-2:
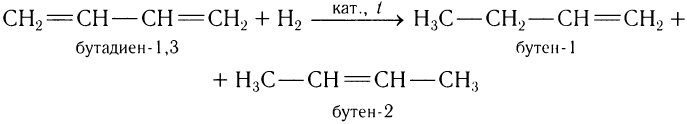
С избытком водорода образуется бутан.
3)Полимеризация.
Диеновые углеводороды легко вступают в реакции полимеризации с образованием синтетических каучуков:

В большинстве случаев образуются продукты 1, 4-присоединения.
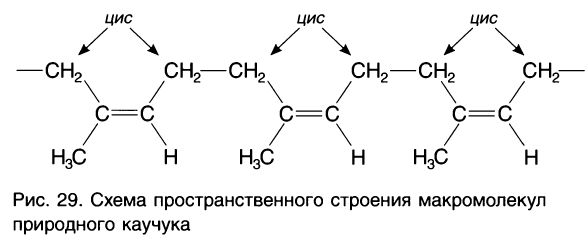
Ранее, до получения синтетических каучуков, в промышленности применялся только природный (натуральный) каучук, получаемый из сока каучуконосных растений. Его строение показано на рисунке 29.
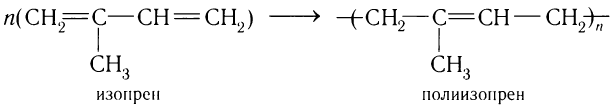
При разложении природного каучука при нагревании было установлено, что его макромолекулы состоят из остатков 2-метилбутадиена-1,3 (изопрена). Таким образом, процесс образования натурального каучука можно изобразить так:
Наличие двойных С = С-связей в макромолекулах полимеров обусловливает возможность существования цис- и транс-стереоизомеров. Оказалось, что в пространственном строении макромолекул природного каучука наблюдается регулярность — только цис- расположение заместителей в структурных звеньях
(см. рис. 29).
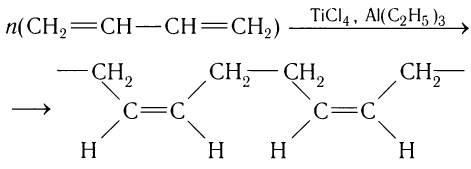
При получении синтетических каучуков образующиеся макромолекулы полимера построены из хаотично расположенных мономерных звеньев в цис- или транс-формах. По этой причине синтетические каучуки уступают природному каучуку по эластичности и износостойкости.
Ученым удалось решить проблему синтеза таких стереорегулярных каучуков при использовании смешанных катализаторов типа 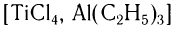 :
:
Эластичность каучуков является одним из важнейших условий при изготовлении авиационных и автомобильных шин и улучшается при вулканизации каучука — превращении каучука в резину при нагревании с серой:
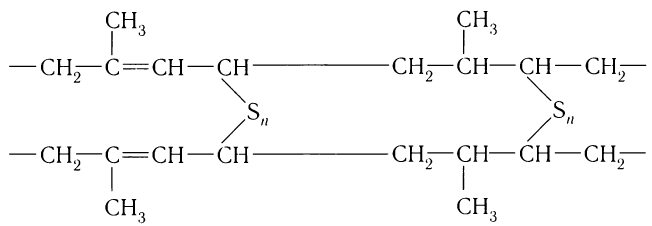
При этом сопротивление на разрыв вулканизированного каучука значительно повышается, а способность к набуханию уменьшается.
Получение и применение диенов:
Полупромышленный синтез бутадиена-1, 3 впервые был осуществлен под руководством С. В.Лебедева дегидратацией и дегидрированием этанола при высокой температуре:
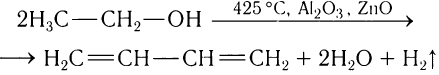
В настоящее время бутадиен-1, 3 получают дегидрированием бутана:
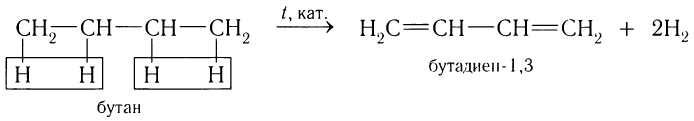
Аналогично дегидрированием 2-метилбутана получают изопрен:
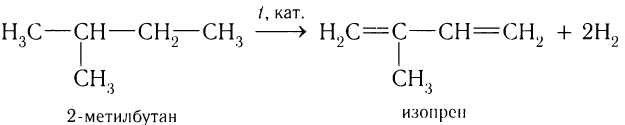
Диены применяют для получения синтетических каучуков, необходимых в производстве шин, а также различных резинотехнических изделий. Чаше всего применяют смесь мономеров, например бутадиен-1.3 и стирол в реакции сополимеризации. Синтетические каучуки используются также для изготовления транспортерных лент, резиновой обуви, водопроводных и лабораторных шлангов. Натуральный полиизопреновый полимер транс-строения гуттаперчу применяют для изготовления мячей для гольфа.
В Беларуси работает одно из крупнейших в Европе предприятий по производству шин — ОАО «Белшина» в Бобруйске.
В реакциях присоединения водорода и галогенов диены всегда образуют смеси продуктов: 1, 2-присоединение и 1, 4-присоединение.
Диеновые углеводороды легко вступают в реакции полимеризации с образованием синтетических каучуков.
Алкины
Алкины в природе:
Соединения с тройными связями не так широко распространены в природе, как алкены или диены. Простые алкины, за исключением ацетилена, выделяющегося в следовых количествах при созревании яблок, не встречаются в природе. Другие алкины находят в масле ромашки, некоторых видах грибов, феромонах насекомых. Токсичное вещество, применяемое индейцами Амазонки для смазывания наконечников стрел, содержит в составе молекул три тройные связи. Особенно много алкинов находят в морских организмах, например в губках.
Строение алкинов
Простейшим представителем углеводородов с одной тройной связью (алкинов) является ацетилен. Ацетилен представляет собой при обычных условиях газ, в чистом виде практически не имеющий запаха. Ацетилен плохо растворим в воде и в органических растворителях, за исключением ацетона.
Алкины, как и другие классы органических соединений, образуют гомологической ряд, общая формула которого 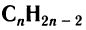 .
.
Например, гомологический ряд углеводородов с одной тройной связью от С2 до С5:
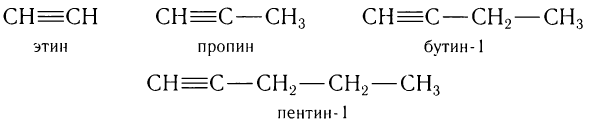
Общая формула алкинов 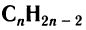 .
.
Строение алкинов рассмотрим на примере ацетилена. Молекулярная формула ацетилена С2Н2. Структурной особенностью ацетилена является присутствие в молекуле тройной связи между атомами углерода. Одна из этих связей является  -связью, две другие —
-связью, две другие — 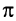 -связями.
-связями.
Электронная и структурная формулы молекулы ацетилена:
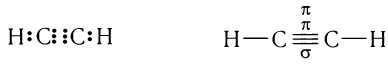
Физическими методами установлено, что в молекуле ацетилена наблюдается линейное расположение всех четырех атомов с валентными углами связей, равными 180°:
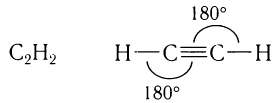
Длина С С-связи в молекуле ацетилена короче двойной связи и равна 0,120 нм.
С-связи в молекуле ацетилена короче двойной связи и равна 0,120 нм.
Длина связи С С равна 0,120 нм.
С равна 0,120 нм.
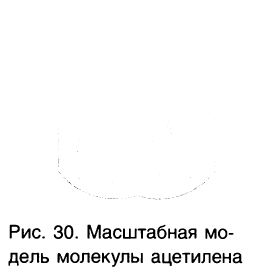
Масштабная модель молекулы ацетилена показана на рисунке 30.
Номенклатура алкинов
Названия углеводородов с одной тройной связью образуют изменением суффикса -ан соответствующего насыщенного углеводорода на суффикс -ин.
Например:
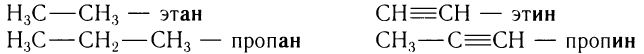
Название класса углеводородов, содержащих одну тройную связь, — алкины.
Если ненасыщенный углеводород содержит более трех атомов углерода, положение тройной связи указывают цифрой, записывая ее после суффикса:
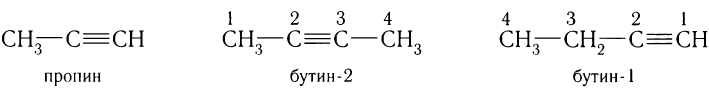
Другие правила номенклатуры ИЮПАК для алкинов такие же, как и правила для алкенов.
Изомерия алкинов
Для алкинов характерны все виды структурной изомерии: изомерия цепи, изомерия расположения тройной связи и т. д. Рассмотрим различные виды изомерии на примере алкинов с молекулярной формулой С5Н8 (табл. 14).
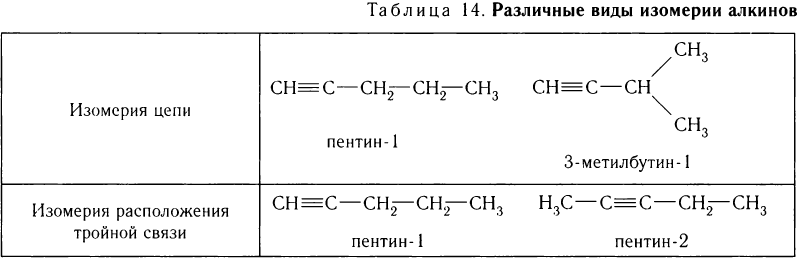
Алкины образуют гомологический ряд, общая формула которого 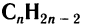 .
.
Названия углеводородов е одной тройной связью образуют изменением суффикса -ан соответствующего насыщенного углеводорода на суффикс -ин.
Физические и химические свойства, получение и применение ацетилена
Физические свойства:
Физические свойства ацетилена и его гомологов рассмотрим на примере некоторых представителей с неразветвленной цепью атомов углерода. Их названия и важнейшие физические свойства приведены в таблице 15.
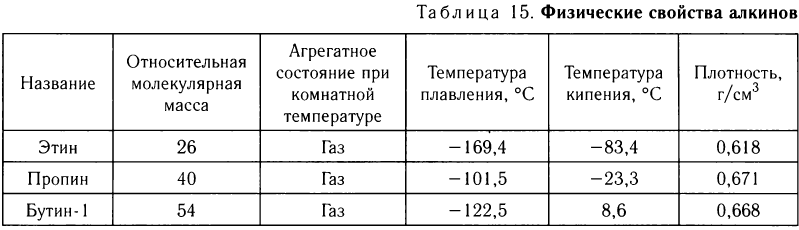
Как видно из данных таблицы, температуры кипения алкинов увеличиваются с увеличением относительной молекулярной массы.
Химические свойства:
Наиболее характерными химическими свойствами ацетилена являются реакции присоединения.
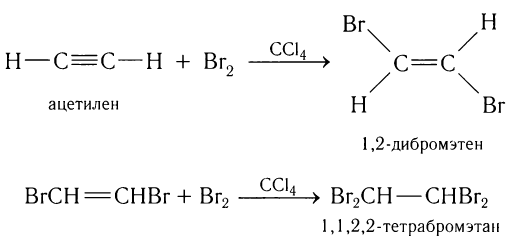
1) Присоединение галогенов.
Ацетилен обесцвечивает раствор брома в тетрахлорметане. Присоединение галогенов к ацетилену, в отличие от реакции с этиленом, может происходить в одну или две стадии. На первой стадии разрывается одна 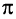 -связь, на второй — другая:
-связь, на второй — другая:
2) Присоединение водорода.
Присоединение водорода к ацетилену происходит при нагревании и в присутствии катализаторов:
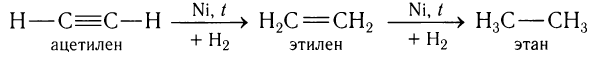
3) Присоединение воды.
Присоединение к ацетилену воды в кислой среде и в присутствии каталитических количеств солей двухвалентной ртути (реакция Кучерова) приводит к получению уксусного альдегида: 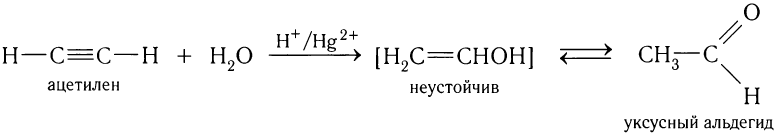
4) Присоединение галогеноводородов.
Например, при присоединении избытка хлороводорода к ацетилену образуется 1, 1 -дихлорэтан:
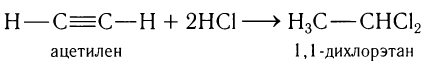
5) Тримеризация ацетилена.
При пропускании ацетилена над активированным углем при 500 °С происходит образование бензола:
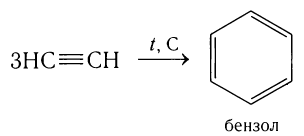
6) Полное окисление (горение).
Ацетилен при избытке кислорода легко сгорает с образованием воды и оксида углерода(ІV):

Получение и применение ацетилена:
В промышленности ацетилен ранее получали нагреванием метана при высокой температуре:
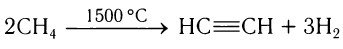
В настоящее время наиболее перспективным и более экономичным способом получения ацетилена является реакция метана с дозированным количеством кислорода:
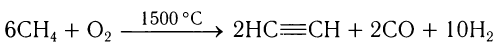
При безопасном соотношении объемов газов метана и кислорода 6: 1 образуется максимальное количество водорода, сжигание которого используют для поддержания высокой температуры реакции.
В лаборатории ацетилен получают обработкой водой карбида кальция:
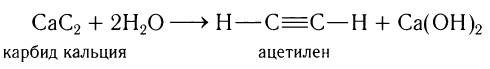
Карбид кальция, в свою очередь, получают сплавлением в электрических печах оксида кальция и угля:
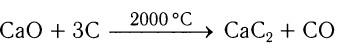
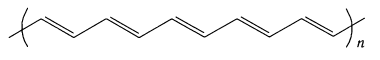
Большинство полимеров являются хорошими изоляторами. Однако ученым удалось на основе полимеров ацетилена, «обработанных» иодом, получить токопроводящие полимеры:
Ацетилен применяют для утилизации хлороводорода, образующегося в качестве побочного продукта при получении винилхлорида из этилена:
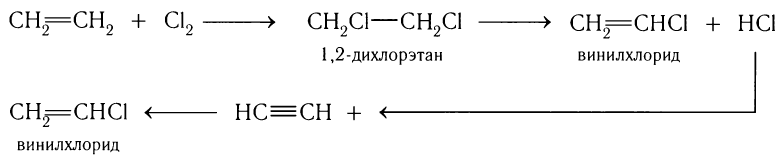
Таким образом получают дополнительные количества винилхлорида.
Ацетилен как исходный продукт для получения различных органических веществ в 40—50-х годах прошлого столетия заменили на более дешевый этилен. Ацетилен в настоящее время используют в основном для сварки и резки металлов, так как при горении ацетилена в чистом кислороде развивается высокая температура.
Для ацетилена характерны реакции присоединения: галогенов, водорода, воды и галогеноводородов.
В промышленности ацетилен получают нагреванием метана с дозированным количеством кислорода.
В лаборатории ацетилен получают обработкой карбида кальция водой.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |