
Кислородсодержащие органические соединения в химии - формулы и определения с примерами
Содержание:
Кислородсодержащие органические соединения:
Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами, называются спиртами.
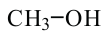
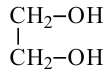 Этандиол - 1,2 (этиленгликоль)
Этандиол - 1,2 (этиленгликоль)
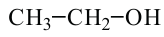 этанол (этиловый спирт)
этанол (этиловый спирт)
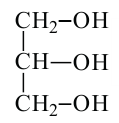 пропантриол (глицерин)
пропантриол (глицерин)
Предельные одноатомные спирты
Если в молекуле алкана один атом водорода замещается одной гидроксильной группой, то образовавшееся органическое соединение называется предельным одноатомным спиртом. Они имеют общую формулу 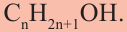
Спирты также имеют свой гомологический ряд, в котором предыдущий и следующие представители различаются на одну 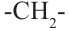 (метиленовую) -группу.
(метиленовую) -группу.
Номенклатура и изомерия: Согласно рациональной номенклатуре, в наименовании спиртов к названиям углеводородного радикала добавляют слово «спирт».
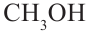 метиловый спирт
метиловый спирт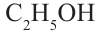 этиловый спирт
этиловый спирт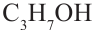 пропиловый спирт
пропиловый спирт
Согласно систематической номенклатуре при названии спиртов:
- В качестве основной углеродной цепи выбирается самая длинная цепь с гидроксильной
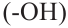 группой.
группой. - Нумерация углеродной цепи начинается с того конца, к которой ближе расположена гидроксильная группа.
- Название спиртов образуется путём добавления «ол» к названию соответствующего насыщенного углеводорода.
- В конце указывается номер углерода, которому присоединена гидроксильная группа:
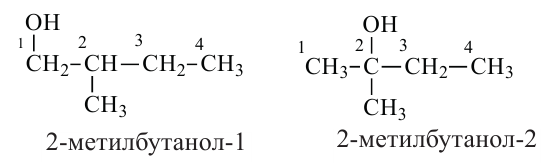
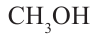 метиловый спирт метанол
метиловый спирт метанол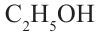 этиловый спирт этанол
этиловый спирт этанол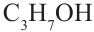 пропиловый спирт пропанол
пропиловый спирт пропанол-
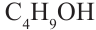 бутиловый спирт бутанол
бутиловый спирт бутанол
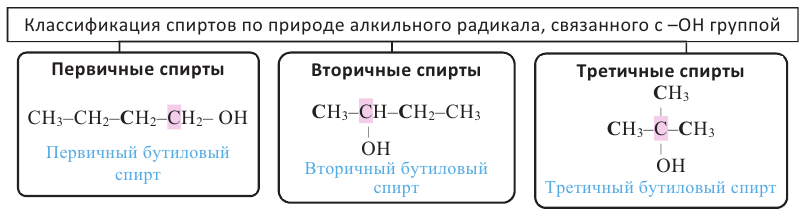
Если гидроксильная группа в спирте соединена с первичным атомом углерода, то этот спирт называется первичным, если соединена с вторичным атомом углерода, то - вторичным спиртом, если с третичным атомом углерода, то - третичным спиртом.
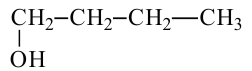 бутанол-1 Первичный спирт
бутанол-1 Первичный спирт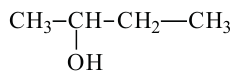 бутанол-2 вторичный спирт
бутанол-2 вторичный спирт 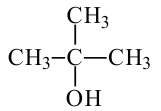 2-метилпропанол-2 третичный спирт
2-метилпропанол-2 третичный спирт
Получение: Спирты, в основном получают следующими способами:
1. Гидролизом сложных эфиров:
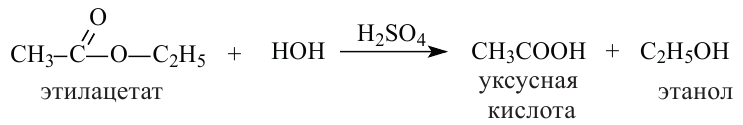
2. При воздействии водных растворов щелочей на галогенпроизводные алканов:
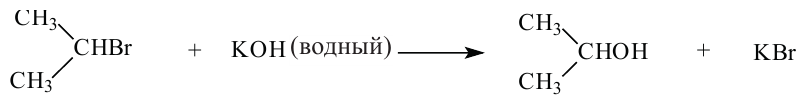
3. При воздействии воды на этиленовые углеводороды в присутствии катализатора - серной кислоты и температуры (реакция гидратации):
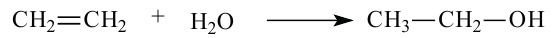
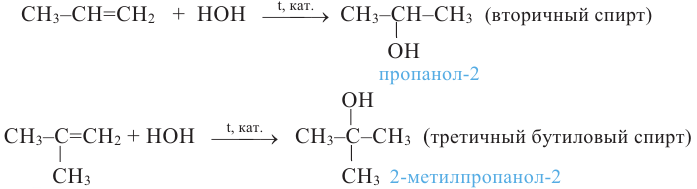
При гидратации гомологов этилена можно получить вторичные или третичные спирты. Присоединение воды алкенам происходит по правилу Марковникова. При разрыве двойной связи атом водорода молекулы воды присоединяется к атому углерода, у которого количество атомов водорода наибольшее, а к атому углерода с наименьшим количеством атомов водорода присоединяется гидроксильная группа. Например, из пропилена образуется вторичный пропиловый спирт:
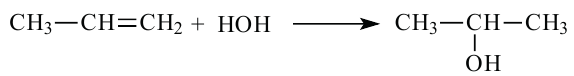
а из 2-метилпропилена получается третичный:
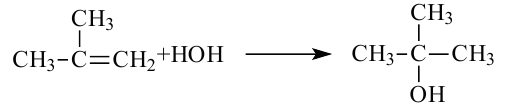
4. В промышленности метанол получают из синтез газа  Реакция протекает в присутствии катализатора, при высоком давлении и высокой температуры.
Реакция протекает в присутствии катализатора, при высоком давлении и высокой температуры.
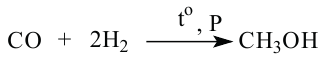
Физические и химические свойства насыщенных одноатомных спиртов
Физические свойства: Первые четыре представителя спиртов являются жидкими веществами с специфическим запахом. Высшие (начиная с 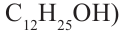 спирты - твердые вещества и практически не растворимы в воде. С увеличением относительной молекулярной массы спиртов повышаются их температуры кипения.
спирты - твердые вещества и практически не растворимы в воде. С увеличением относительной молекулярной массы спиртов повышаются их температуры кипения.
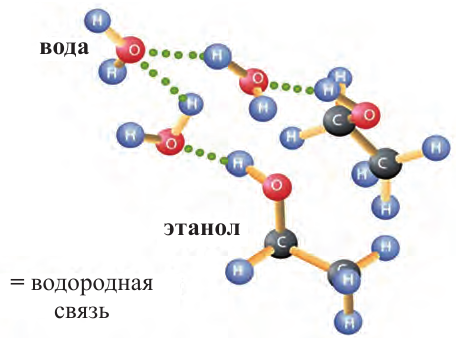
По сравнению с соответствующими углеводородами, температуры кипения спиртов гораздо выше. Это можно объяснить образованием особого вида химических связей, называемых водородными. В молекулах спиртов и воды водородные связи образуются за счет свободных электронных пар атомов кислорода: атом кислорода может взаимодействовать с атомами водорода другой молекулы, имеющих положительный заряд.
Водородная связь может возникнуть как между молекулами спиртов, так и между молекулами спиртов и воды:

По этой причине, температура ф кипения спиртов гораздо выше, вода ^.«о. Основная часть тепловой энергии CP при кипении спиртов используется для разрыва водородных связей.
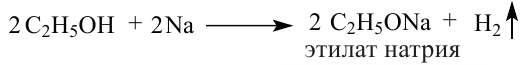
Химические свойства: 1. Спирты, подобно воде, реагируют с активными металлами и образуют алкоголяты.
Алкоголяты не устойчивы, в воде подвергаются гидролизу.

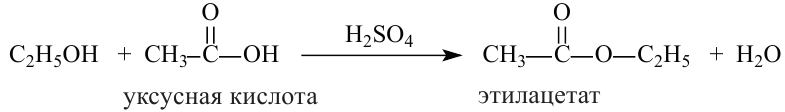
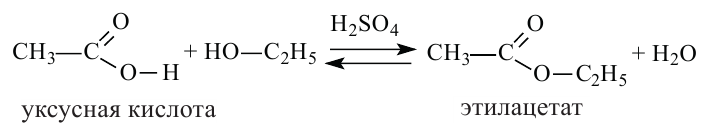
2. Спирты реагируют с кислотами в присутствии серной кислоты с образованием сложных эфиров. Реакция называется этерификацией.
3. В присутствии водоотнимающего вещества (серной кислоты) и при повышенной температуре, от молекул спиртов отщепляется вода и образуются непредельные углеводороды:
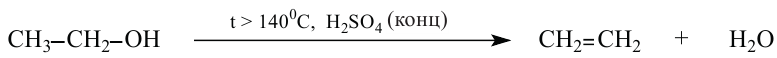
4. При избытке спирта и более низкой температуре, получаются простые эфиры.
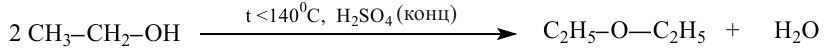
Реакции, протекающие с отщеплением воды, называются реакциями дегидратации.
5. При горении спиртов в присутствии кислорода выделяется углекислый газ и вода:

Горение этанола: 
Горение бутанола: 
Применение: Этанол в медицине применяется как дезинфицирующее средство. Он также используется в термометрах для измерения температуры. Этиловый спирт очень сильно воздействует на организм, нарушая деятельность нервной, пищеварительной и сердечно-сосудистой систем. Он приводит к тяжелым последствиям.
Многоатомные спирты. Их получение, свойства и применение
Спирты, в составе которых содержатся несколько гидроксильных групп, называются многоатомными спиртами.
В них несколько атомов водорода замещены гидроксильными группами.
Изомерия и номенклатура: По систематической номенклатуре двухатомных спиртов принято называть, применив окончание «диол» к названию соответствующего алкана, после которой указывается расположение гидроксильных групп в основной цепи:
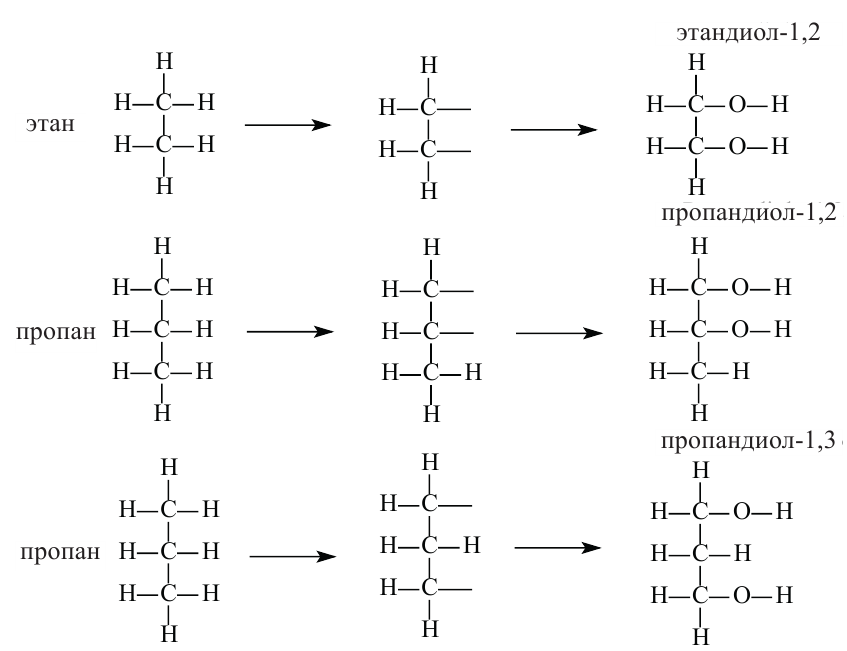 Замещением двух атомов водорода в составе этана на гидроксильные группы получим формулу этиленгликоля. При этом водороды замещаются от разных атомов углерода. Этиленгликоль по систематической номенклатуре называется этандиол-1,2.
Замещением двух атомов водорода в составе этана на гидроксильные группы получим формулу этиленгликоля. При этом водороды замещаются от разных атомов углерода. Этиленгликоль по систематической номенклатуре называется этандиол-1,2.
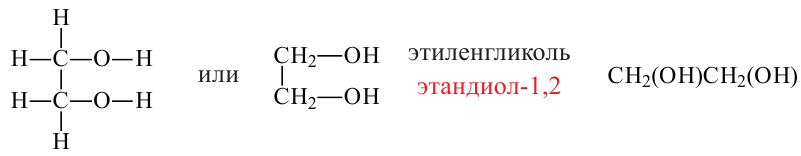
Спирты, содержащие две гидроксильные группы, называются двухатомными спиртами. Например, этиленгликоль.
Таким же образом, замещением трех атомов водорода пропана с различных атомов углерода на гидроксильные группы, образуется трехатомный спирт, который называется глицерином. По систематической номенклатуре глицерин называется пропантриол-1,2,3.
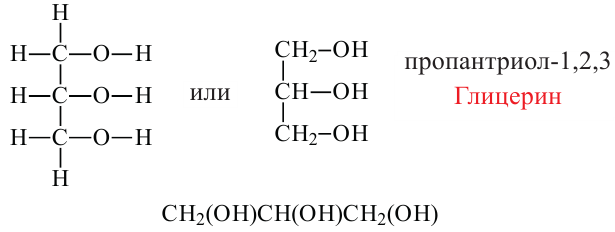
Спирты, содержащие три гидроксильные группы, называются трехатомными спиртами. В качестве примера можно привести глицерин.
В составе всех многоатомных спиртов гидроксильные группы соединены с разными атомами углеродов. Получить спирт с двумя гидроксиль-ными группами в одном и том же атоме углерода довольно сложно, поскольку такие соединения считаются неустойчивыми.
Физические свойства: Представители многоатомных спиртов как этиленгликоль, глицерин и другие являются жидкостями со сладким вкусом. Они хорошо растворяются в воде. Имеющий сладкий вкус этиленгликоль, в то же время, является ядовитым веществом.
Химические свойства: Как соединения, имеющие гидроксильную группу, многоатомные спирты повторяют большинство химических свойств одноатомных спиртов.
Например, этиленгликоль, как и одноатомные спирты, реагирует с металлическим натрием, где идет замещение атомов водорода в гидроксильных группах на атом металла металлом.
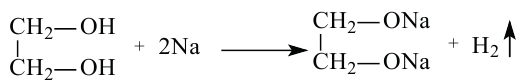
В глицерине также наблюдается замещение атомов водорода на щелочные металлы:
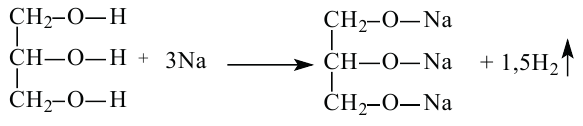
Если воздействовать на спирты галогеноводородами, протекает замещение гидроксильных групп на атомы галогенов.
При воздействии на многоатомные спирты свежеприготовленным раствором гидроксида меди 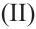 образуется раствор темно - синего цвета. Данная реакция является качественной реакцией на многоатомные спирты.
образуется раствор темно - синего цвета. Данная реакция является качественной реакцией на многоатомные спирты.
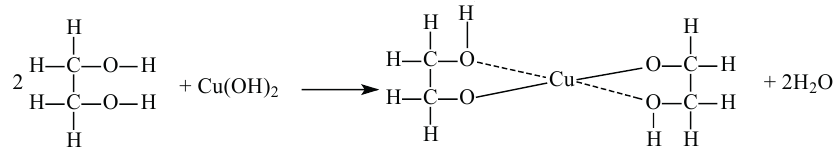
При реакции с азотной кислотой глицерин образует сложный эфир нитроглицерин:
Для данного эфира и по сей день широко используется его историческое название «Нитроглицерин». Нитроглицерин применяется как средство при лечении сердечных заболеваниях.
Получение:
1. Гидролиз 1,2 - дихлорэтана приводит к образованию этиленгликоля:
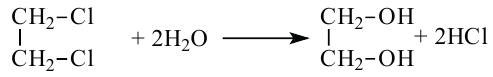
2. Глицерин можно получить гидролизом жиров. Он входит в состав любого жира.
Фенолы и ароматические спирты
Как и у углеводородов с открытой цепью, у ароматических углеводородов также имеются производные, содержащие гидроксильную группу. В таких соединениях  группы могут соединяться с атомами углерода боковой цепи или непосредственно с атомами углерода бензольного кольца.
группы могут соединяться с атомами углерода боковой цепи или непосредственно с атомами углерода бензольного кольца.
Ароматичекие соединения, имеющие гидроксильные группы, можно подразделить на две группы.
- Соединения, гидроксильная группа которых непосредственно соединена с бензольным кольцом, называются фенолами.
- Соединения, содержащие гидроксильные группы в боковой цепи, называются ароматическими спиртами.
Фенолы
По количеству содержащихся гидроксильных 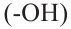 групп, фенолы могут быть одноатомными или многоатомными.
групп, фенолы могут быть одноатомными или многоатомными.
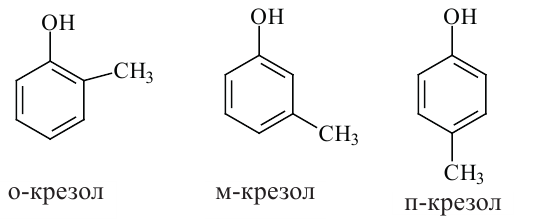
В качестве примера гомологам фенола можно привести 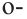 крезол,
крезол, 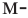 крезол и
крезол и 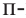 крезол.
крезол.
Соединения, образованные присоединением  группы на атом углерода боковой цепи, называются ароматическими спиртами. Например, бензиновый спирт, 2-фенилэтанол.
группы на атом углерода боковой цепи, называются ароматическими спиртами. Например, бензиновый спирт, 2-фенилэтанол.
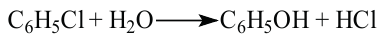
Получение: 1. В промышленности фенол получают щелочным гидролизом хлорбензола в присутствии катализатора.

2. В последующие годы в технике при получении фенола используют способ гидролиза хлорбензола:
Физические свойства: Фенол - бесцветное кристаллическое вещество с характерным запахом, плохо растворимое в воде.

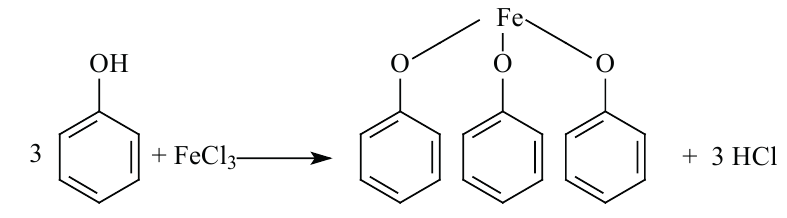
Фенолы хорошо растворимы в спирте, эфире и бензине. При попадании на кожу вызывают ожоги. Для фенола характерна цветная реакция с хлоридом железа (III) (фиолетовое окрашивание), и по этому эта реакция считается качественной для фенолов.
Химические свойства: В отличие от бензола, фенолы легко вступают в реакцию, так как электронная плотность в бензольном ядре распределена неравномерно из-за непосредственного соединения гидроксильной группы с бензольным кольцом.
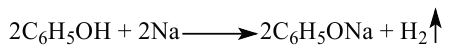
1. Фенолы, как и спирты, при взаимодействии с натрием образуют феноляты и выделяют водород.
2.В отличие от спиртов, фенолы взаимодействуют с щелочами. Это показывает, что фенолы обладают слабыми кислотными свойствами.

3.Фенолы, взаимодействуя с бромной водой, образуют 2,4,6-трибром-фенол (белый осадок).
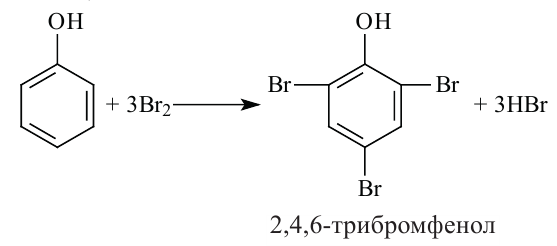
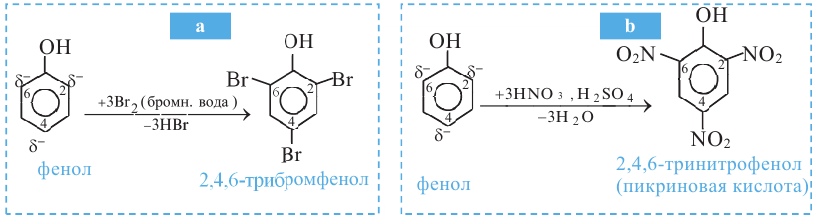
4.Фенолы, взаимодействуя с достаточным количеством азотной кислоты, образуют 2,4,6-тринитрофенол (пикриновая кислота).
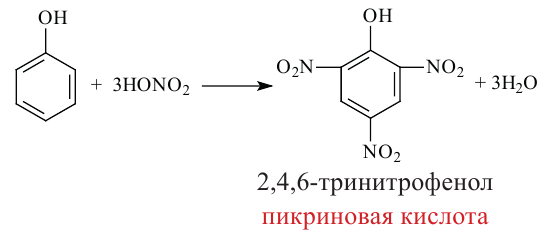

Оксосоединения. Альдегиды. Получение и свойства
Вещества, в составе которых содержится карбонильная группа 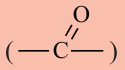 называются оксосоединениями. К ним относятся альдегиды и кетоны.
называются оксосоединениями. К ним относятся альдегиды и кетоны.
АЛЬДЕГИДЫ:
Вещества, в составе которых содержится альдегидная группа 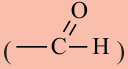 называются альдегидами. Их общая формула
называются альдегидами. Их общая формула 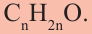
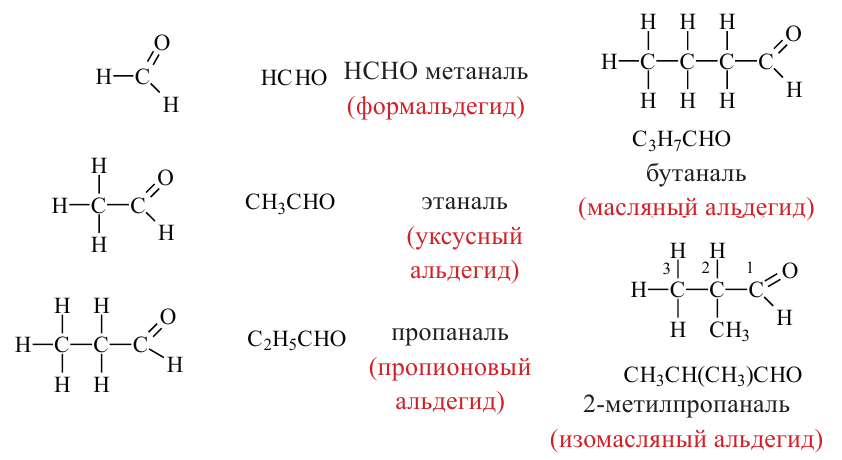
Номенклатура: При названии альдегидов широко используется тривиальная номенклатура. В этом случае в названии соответствующей карбоновой кислоты слово «кислота» заменяется на «альдегид». Например, муравьиная кислота соответствует муравьиному альдегиду, уксусная кислота - уксусному альдегиду.
Согласно систематической номенклатуре, к названию алкана, соответствующему числу атомов углерода в составе альдегида, добавляют суффикс «аль». Например, пропионовый альдегид - пропаналь, масляный альдегид - бутаналь.
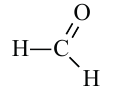 муравьиный альдегид (формальдегид) или метаналь
муравьиный альдегид (формальдегид) или метаналь
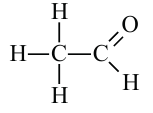 уксусный альдегид или этаналь
уксусный альдегид или этаналь
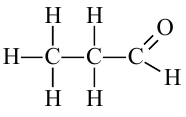 пропионовый альдегид или пропаналь
пропионовый альдегид или пропаналь
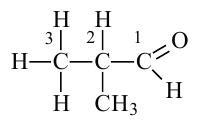 изомасляный альдегид или 2-метилпропаналь
изомасляный альдегид или 2-метилпропаналь
Способы получения:
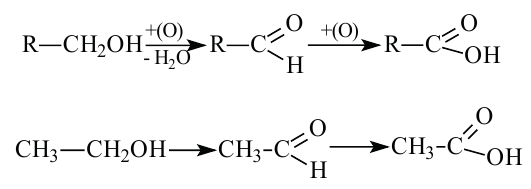
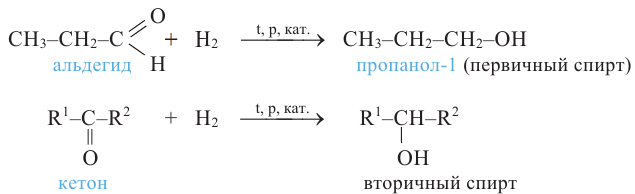
1. Окисление первичных спиртов. При окислении первичных спиртов образуются альдегиды:
При окислении метанола оксидом меди (II) образуется формальдегид:

Эта реакция протекает непрерывно, так как образующийся в результате реакции медь окисляется кислородом воздуха и дальше окисляет метанол.
2. Гидратация ацетилена. Ацетилен присоединяет молекулу воды и превращается в уксусный альдегид (реакция М. Г. Кучерова):
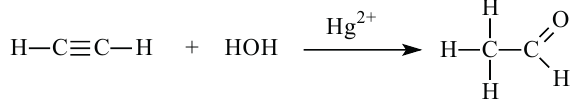
3. При гидролизе производных алканов, имеющие два атома галогена у первого атома углерода:
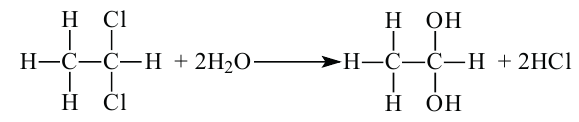
Сначала, в течение короткого промежутка времени, образуется двухатомный спирт. По причине своей неустойчивости, данное соединение разлагается на этаналь и воду:
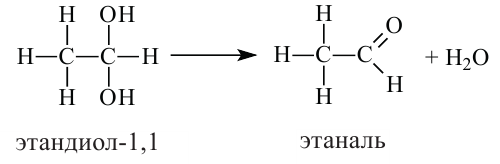
Физические свойства: Первый представитель альдегидов - муравьиный альдегид (формальдегид) при нормальных условиях является удушающим газом с резким запахом. Остальные низшие представители альдегидов являются жидкими веществами, легко растворимые в органических растворителях. Высшие представители альдегидов являются твёрдыми веществами. С увеличением молекулярной массы у альдегидов увеличивается температура кипения.
По причине отсутствия у альдегидов водородных связей, их температура кипения ниже, чем у соответствующих спиртов и карбоновых кислот.
Химические свойства: Альдегиды легко вступают в химические реакции. Альдегидам присущи реакции окисления, восстановления и конденсации.
Восстановление альдегидов: Альдегиды могут присоединять молекулу водорода в присутствии никелевого катализатора. В результате этой реакции образуется соответствующий данному альдегиду спирт:
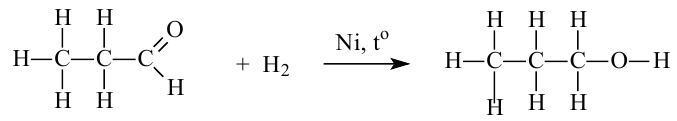
Окисление альдегидов: Альдегиды - легко окисляемые соединения. Они окисляются даже под воздействием кислорода воздуха или слабыми окислителями, например, аммиачным раствором оксида серебра и ги-дроксидом меди (II). Окисление альдегидов под воздействием аммиачного раствора оксида серебра называется реакцией «серебрянного зеркала». Эта реакция является качественной реакцией на альдегиды:
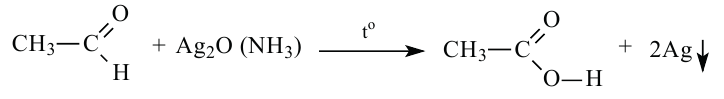
Восстановленное серебро покрывает тонким слоем стенки пробирки, а альдегид окисляется в соответствующую карбоновую кислоту.
Другой характерной реакцией для альдегидов является окисление под воздействием гидроксида меди (II). Если к голубому осадку гидроксида меди (II) добавить раствор альдегида и нагреть, то образуется жёлтый осадок гидроксида меди (I). При продолжении нагревания образуется красный оксид меди (I):
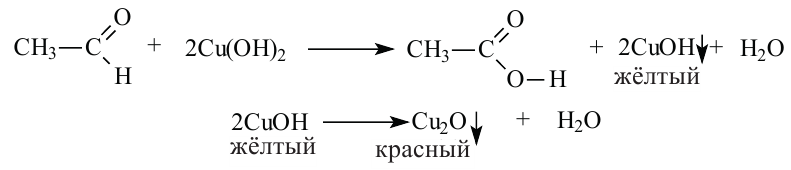
Эта реакция так же, как и реакция «серебрянного зеркала» является качественной реакцией на альдегиды.
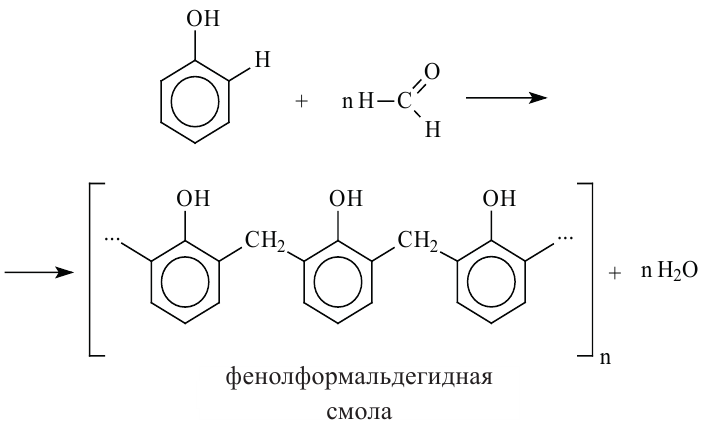
При нагревании альдегида с фенолом в присутствии катализаторов (кислота или основание) происходит реакция поликонденсации. В результате реакции образуется фенолформальдегидная смола и вода:
Реакция поликонденсации - это процесс образования высокомолекулярных соединений из низкомолекулярных, сопровождающийся с выделением побочных продуктов с низкой молекулярной массой (вода, спирт).
Пример №1
Смесь паров метанола с воздухом пропустили через нагретую медь. Полученное органическое соединение реагирует со свежеприготовленным раствором 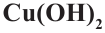 и образуется 121,5 г жёлтого осадка. Определите массу (г) вступившего в реакцию спирта.
и образуется 121,5 г жёлтого осадка. Определите массу (г) вступившего в реакцию спирта.
Решение:
В первую очередь, напишем необходимые уравнения реакций:

Полученное соединение - метаналь - вступает в реакцию с раствором 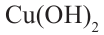 и образует метановую (муравьиную) кислоту:
и образует метановую (муравьиную) кислоту:
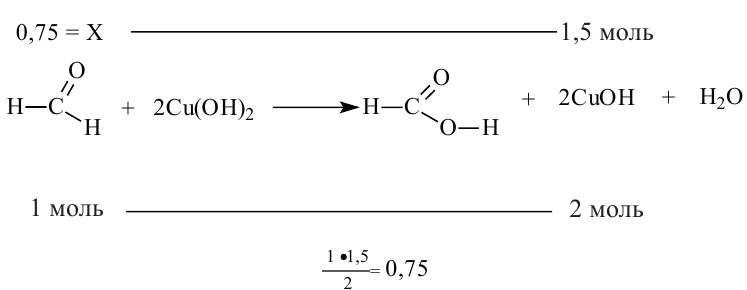
В этой реакции жёлтым осадком является гидроксид меди (I). Находим его количество: 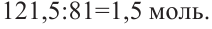 Через это значение мы можем перейти к количеству альдегида, вступившего в реакцию (0,75 моль). Данное количество вещества будет относиться и к метанолу:
Через это значение мы можем перейти к количеству альдегида, вступившего в реакцию (0,75 моль). Данное количество вещества будет относиться и к метанолу:
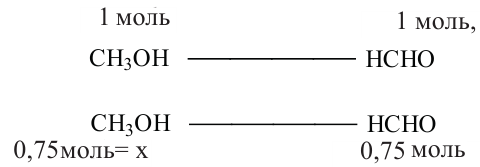
Находим массу 0,75 молей метанола: 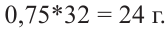
Ответ: 24 г.
Кетоны. Получение и свойства
Соединения, в составе которых с карбонильной группой соединяются два углеводородных радикала, называются кетонами.
Общая формула кетонов так же, как у альдегидов  поэтому они являются межклассовыми изомерами. Например, для вещества составом
поэтому они являются межклассовыми изомерами. Например, для вещества составом  соответствует следующий альдегид и кетон:
соответствует следующий альдегид и кетон:

Номенклатура: Название простых кетонов образуется путём добавления приставки «ди» к названию радикалов, связанных с карбонильной группой, и слова «кетон» в конце. Если радикалы разные, то сначала называют малый радикал, затем большой с добавлением в конце слова «кетон»:
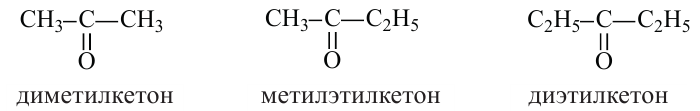
Изомерия кетонов связано с изменением количества углеродов в составе радикала.

Получение:
1. Гидратацией алкинов (кроме ацетилена) получают кетоны
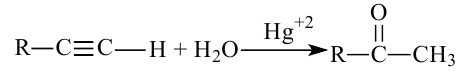
2. Получение кетонов возможно путём гидролиза дигалогеналканов, у которых атомы галогенов находятся у одного атома углерода. При этом атомы галогенов не должны находиться у крайнего атома углерода:

Физические свойства:
Низшие представители кетонов так же, как и альдегиды, хорошо растворимы в воде и обладают специфическим неприятным запахом.
Химические свойства:
Кетонам так же, как и альдегидам, присущи реакции присоединения. Реакционная способность кетонов ниже, чем у соответствующих альдегидов.
Реакция присоединения: Кетоны с помощью катализаторов присоединяют атомы водородов и превращаются во вторичный спирт:
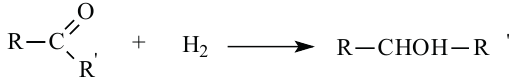
Кетоны окисляются только под воздействием сильных окислителей 
Ацетон (диметилкетон) бесцветная жидкость, кипящая при температуре 56,5 ° С, обладающая специфическим запахом. Ацетон получают из кальциевой соли уксусной кислоты, полученной при сухой перегонке древесины. Раньше этот способ являлся единственным способом получения ацетона. В настоящее время в промышленности существует несколько современных способов получения ацетона. Например, ацетон можно получить прямым путём из уксусной кислоты. Для этого пары  пропускают через катализатор
пропускают через катализатор  Ацетон широко применяется в промышленности. Его используют как растворитель при получении хлороформа и йодоформа, а также при производстве кислот и ацетатного волокна.
Ацетон широко применяется в промышленности. Его используют как растворитель при получении хлороформа и йодоформа, а также при производстве кислот и ацетатного волокна.
Карбоновые кислоты. Получение и свойства
Органические вещества, в молекуле которых углеводородный радикал связан с одной карбоксильной группой 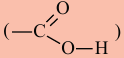 называются насыщенными одноосновными карбоновыми кислотами. Общая формула карбоновых кислота
называются насыщенными одноосновными карбоновыми кислотами. Общая формула карбоновых кислота 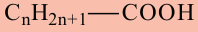 (за исключением муравьиной кислоты).
(за исключением муравьиной кислоты).
Номенклатура: На практике до настоящего времени популярны тривиальные названия одноосновных карбоновых кислот. В большинстве случаев эти названия указывает на источник, из которого впервые была получена данная карбоновая кислота. Например, первый представитель карбоновых кислот 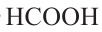 называется муравьиной кислотой, потому что его выделили из муравьев. Также, валериановая кислота была получена из корней валерианы.
называется муравьиной кислотой, потому что его выделили из муравьев. Также, валериановая кислота была получена из корней валерианы.
Для наименования карбоновых кислот по систематической номенклатуре к названию соответствующего алкана прибавляется слово «кислота».
Формула Тривиальная номенклатура Систематическая номенклатура
 муравьиная кислота метановая кислота
муравьиная кислота метановая кислота
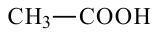 уксусная кислота этановая кислота
уксусная кислота этановая кислота
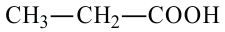 пропионовая кислота пропановая кислота
пропионовая кислота пропановая кислота
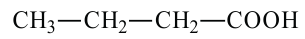 масляная кислота бутановая кислота
масляная кислота бутановая кислота
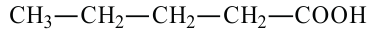 валериановая кислота пентановая кислота
валериановая кислота пентановая кислота
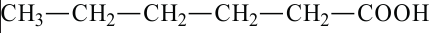 капроновая кислота гексановая кислота
капроновая кислота гексановая кислота
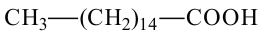 пальмитиновая кислота гексадекановая кислота
пальмитиновая кислота гексадекановая кислота
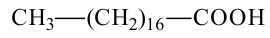 стеариновая кислота октадекановая кислота
стеариновая кислота октадекановая кислота
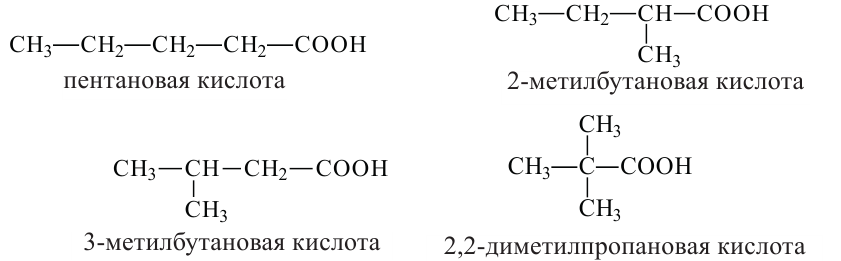
При наименовании карбоновой кислоты с разветвленной цепью выбирается самая длинная цепь, и нумеруют ее со стороны карбоксильной группы. Атом углерода карбоксильной группы будет считаться первым. Далее указывается номер углерода, в котором находится радикал, а потом название радикала. В конце указывается название основной цепи в соответствии с названием алкана и прибавляется слово «кислота».
Например,
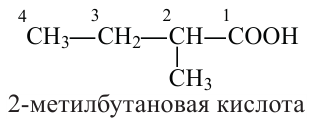
Изомерия: В карбоновых кислотах наблюдается изомерия углеродной цепи.
Методы получения: 1. В результате окисления спиртов сначала образуется альдегид, а потом карбоновая кислота. При этом число углеродов остаётся неизменным.
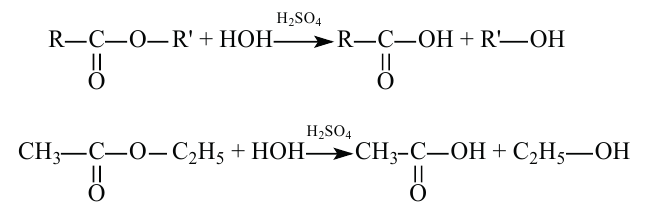
2.Карбоновые кислоты можно получить гидролизом сложных эфиров:
3. При воздействии сильных неорганических кислот на соли определенной карбоновой кислоты:

Физические свойства: Низшие представители карбоновых кислот при обычных условиях являются жидкостями, высшие карбоновые кислоты -жирные кислоты - нерастворимые в воде твердые вещества.
Химические свойства: Карбоновые кислоты, подобно неорганическим, обладают свойством образовывать соли, вступая в реакцию с металлами, с оксидами металлов и основаниями.
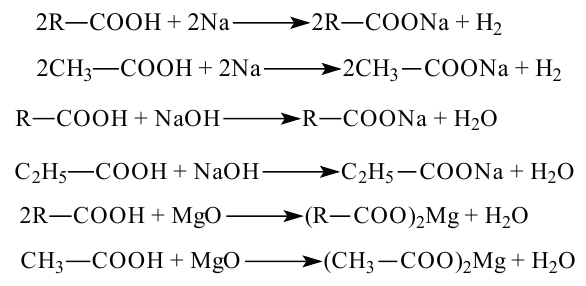
Карбоновые кислоты, вступая в реакцию со спиртами в присутствии серной кислоты, образуют сложные эфиры.
В муравьиной кислоте карбоксильная группа непосредственно связана с атомом водорода, поэтому в одно и то же время ее можно рассматривать и как альдегид. Муравьиная кислота вступает в реакцию «серебряного зеркала», которая свойственна альдегидам.
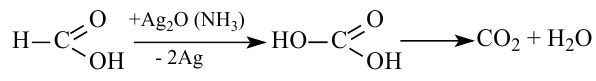
К реакциям, протекающим за счет замещения атома водорода, можно отнести взаимодействие с галогеном под воздействием солнечных лучей. При этом образуется галогенпроизводное кислоты, у которого один или несколько атомов водорода замещены на атом галогена
В результате взаимодействия высших карбоновых кислот с глицерином образуются жиры.
Простые эфиры. Получение и свойства
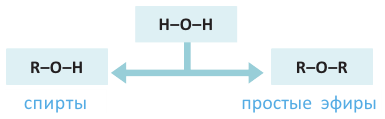
Вещества с общей формулой 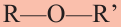 называются простыми эфирами. Простые эфиры можно рассматривать как производные молекул спиртов, в которых атом водорода гидроксилыюй группы замещен на углеводородный радикал, или как производные молекулы воды, в которых атомы водорода замещены на радикалы.
называются простыми эфирами. Простые эфиры можно рассматривать как производные молекул спиртов, в которых атом водорода гидроксилыюй группы замещен на углеводородный радикал, или как производные молекулы воды, в которых атомы водорода замещены на радикалы.
Номенклатура: По систематической (международной) номенклатуре простые эфиры рассматриваются как производные алкана, у которых один атом водорода замещен на алкоксигруппу  При этом за алкан принимается радикал с большим числом атомов углерода:
При этом за алкан принимается радикал с большим числом атомов углерода:
Например: 
Простые эфиры, в основном, именуются по рациональной номенклатуре, согласно которой к названию радикалов прибавляют слово «эфир».
Например,
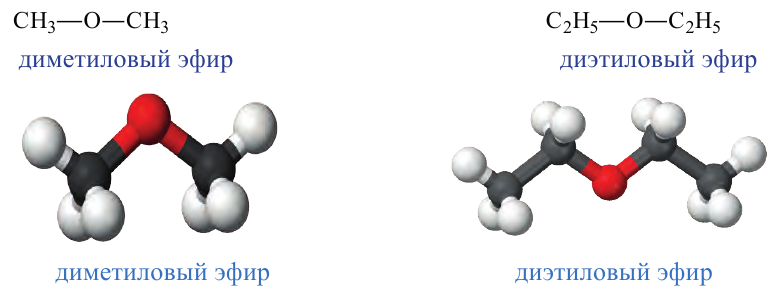
Изомерия: У простых эфиров изомерия наблюдается при изменении вида радикала. Например, метилпропиловый эфир, метилизопропиловый эфир, диметиловый эфир.
Эмпирическая формула простых эфиров одинакова с насыщенными одноатомными спиртами. Поэтому у них наблюдается межклассовая изомерия.
Например:

Способы получения: Диэтиловый эфир получается путём нагревания этилового спирта в присутствии серной кислоты:
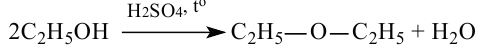
В промышленности простые эфиры получают путём пропускания паров спирта через катализатор. Например, для получения диметилового эфира пары метанола пропускают над катализатором 

Физические свойства: Диметиловый и этилметиловые эфиры являются газами, средние представители являются жидкостями, высшие представители - твёрдыми веществами.
Химические свойства: Эфиры являются инертными соединениями, не вступающими в реакцию при обычных условиях. Они не взаимодействуют с щелочами и с разбавленными растворами кислот, поэтому они используются в качестве растворителей в химических реакциях.
1. Простые эфиры расщепляются под воздействием концентрированной йодоводородной кислоты на спирт и галогеналканы:

Пример №2
Определите массовую долю (%) углерода в составе простого эфира, в составе которого имеется 16  -гибридных орбиталей.
-гибридных орбиталей.
Решение:
Известно, что все углероды в составе простого эфира, а также кислород находится в 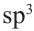 -гибридном состоянии. Каждая
-гибридном состоянии. Каждая 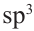 -орбиталь образована 4 гибридными орбиталями. Так мы можем найти сколько атомов у простого эфира с 16 гибридными орбиталями:
-орбиталь образована 4 гибридными орбиталями. Так мы можем найти сколько атомов у простого эфира с 16 гибридными орбиталями:
1 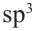 атома----------4 гибридных орбиталей
атома----------4 гибридных орбиталей
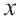 атомов----------16 гибридных орбиталей
атомов----------16 гибридных орбиталей 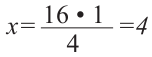 атомов
атомов
Если из 4 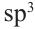 -гибридных атомов один является кислородом, то остальные 3 - атомами углерода. Значит, формула эфира
-гибридных атомов один является кислородом, то остальные 3 - атомами углерода. Значит, формула эфира 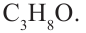 Теперь найдём массовую долю атомов углерода в его составе:
Теперь найдём массовую долю атомов углерода в его составе:
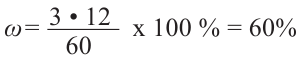
Ответ: 60%
Сложные эфиры. Получение и свойства. Применение
Сложным эфиром называют соединение, образованное в процессе взаимодействия кислот со спиртами, сопровождающийся с выделением молекулы воды.
Общая формула сложных эфиров представляется следующим образом: 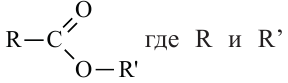 - радикалы углеводородов, одинаковых или разных.
- радикалы углеводородов, одинаковых или разных.
Номенклатура: Названия сложных эфиров образуются названием соответствующих кислот и добавлением слова «эфир» к названию радикала спиртов. Например:
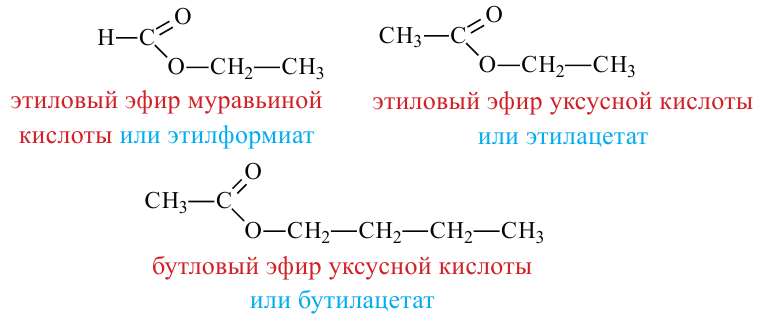
Согласно систематической номенклатуре, названия сложных эфиров образуются соединением названия радикала спирта и суффикса «оат», приставленного к названию кислоты. Например:
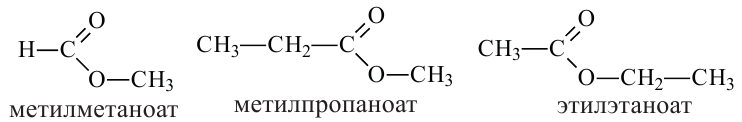
Так как эмпирические формулы сложных эфиров и карбоновых кислот одинаковы, они считаются межклассовыми изомерами.
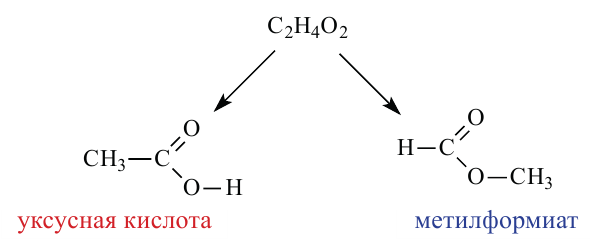
Получение: Сложные эфиры получают при взаимодействии карбоновых кислот со спиртами. При этом в качестве катализатора используют серную или соляную кислоту.
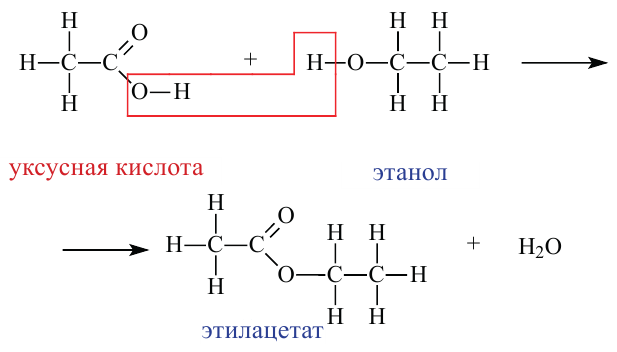
Реакции образования сложных эфиров из кислоты и спирта называются реакциями этерификации.
Физические свойства: Простейшие представители сложных эфиров являются жидкостями легче воды, летучие и обладающие приятным запахом. Температура кипения и плавления метиловых и этиловых эфиров низших карбоновых кислот ниже, чем у соответствующих карбоновых кислот.
Химические свойства: Важнейшее свойство сложных эфиров - это взаимодействие их с водой, т.е. гидролиз. Этот процесс протекает как в кислотной, так и в щелочной среде. Отличие в том, что кислотный гидролиз обратим, а щелочной является необратимым процессом. В результате гидролиза образуется соответствующая кислота и спирт:
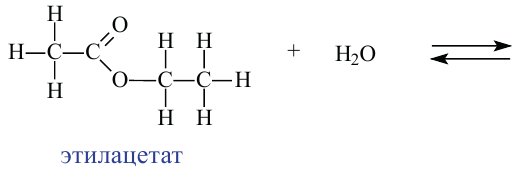
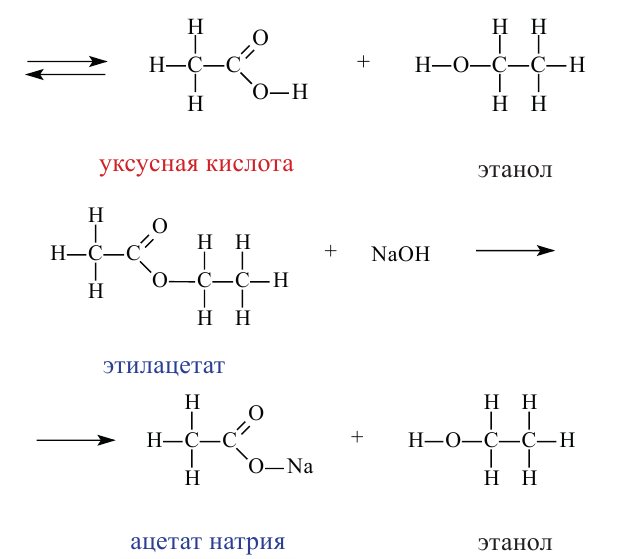
Применение: Обладая приятным запахом, сложные эфиры применяются в пищевой и парфюмерной промышленности. Они также используются в качестве добавок при производстве освежающих напитков, конфет и других пищевых продуктов. Некоторые из них применяются в качестве растворителя лаков.

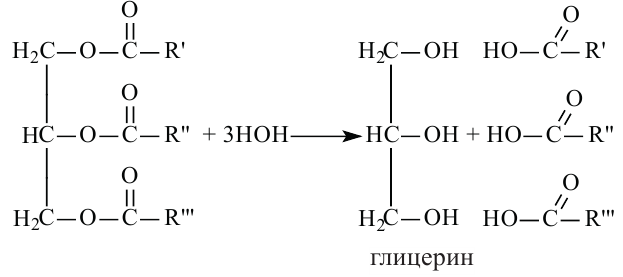
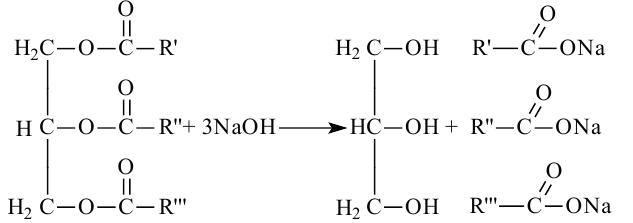
Жиры. Получение и свойства
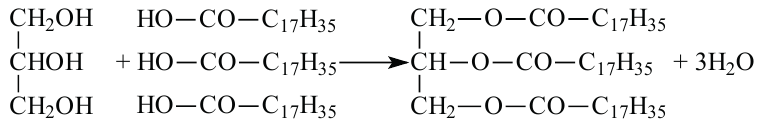
Жиры являются сложными эфирами глицерина и карбоновых кислот Глицерин, являясь трёхатомным спиртом, одновременно присоединяет три остатка карбоновы кислот.
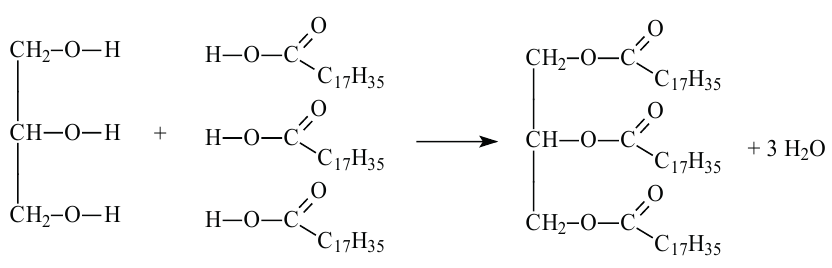
Жиры широко распространены в природе. Они являются важной составной частью животных и растительных организмов.
Животные жиры - это твёрдые жиры. В этих жирах глицерин присоединяет высшие предельные кислоты.
Растительные жиры являются жидкими. Их также называют маслами. Жидкие жиры образованы высшими непредельными кислотами 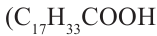 - олеиновая кислота,
- олеиновая кислота, 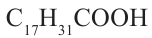 - линолевая кислота,
- линолевая кислота, 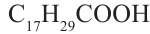 - линоленовая кислота). Их температура кипения и плавления ниже, чем у твёрдых жиров. Увеличение количества двойных связей в составе кислоты приводит к снижению температуры кипения и плавления жиров.
- линоленовая кислота). Их температура кипения и плавления ниже, чем у твёрдых жиров. Увеличение количества двойных связей в составе кислоты приводит к снижению температуры кипения и плавления жиров.
Жиры не растворимы в воде. Они, как и другие органические вещества, хорошо растворимы в органических растворителях. Примерами таких растворителей являются бензин и тетрахлорметан.


Химические свойства: Жиры считаются неотъемлемой частью рациона человека. При расщеплении жиров образуется вдвое больше энергии, чем при расщеплении углеводов или белков.
В организме жиры расщепляются под действием особых ферментов. Они расщепляются до своих составляющих - глицерина и карбоновых кислот - и в таком виде усваиваются организмом. Такое расщепление жиров является примером реакции гидролиза.
Гидролизом жиров пользуются в промышленных масштабах. В специальных автоклавах, под воздействием высокого давления и температуры, жиры расщепляются до глицерина и карбоновых кислот.
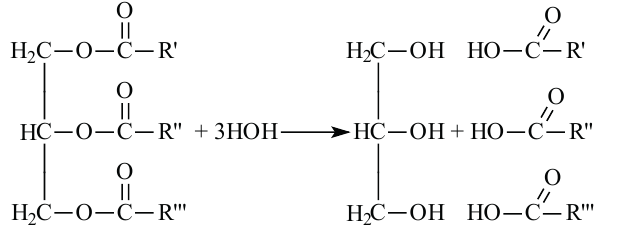
Расщепляя жиры в щелочной среде, наряду с глицерином, получаются мыла. В этом случае, сначала образуются глицерин и карбоновые кислоты. В составе смеси будет иметься также щелочь (например,  В результате реакции кислоты с щелочью образуется соль. Именно эта соль (натриевая соль карбоновой кислотой) называется мылом.
В результате реакции кислоты с щелочью образуется соль. Именно эта соль (натриевая соль карбоновой кислотой) называется мылом.
Натриевые мыла являются твёрдыми мылами. Из натриевых солей получают хозяйственное мыло. Соли карбоновой кислоты и натрия являются бесцветными и практически не имеют запаха. Цвет и приятный запах мыл получают путём добавления красителей и ароматизаторов.
Если в процессе гидролиза вместо гидроксида натрия использовать гидроксид калия, образуется жидкое мыло.
В промышленности спрос к твёрдым жирам огромен. По этой причине были переведон множество исследований по получению твердых жиров из жидких.
Как было сказано выше, в состав жидких жиров входят ненасыщенные карбоновые кислоты, в состав твердых же - насыщенные кислоты. Гидрированием жидких жиров (т.е. насыщением радикала ненасыщенных кислот) получаются твердые жиры.
Углеводы. Моносахариды. Получение и свойства
Углеводы широко распространены в природе и имеют огромное значение в жизни человека. Некоторые из них, такие как крахмал, глюкоза, сахароза являются основными питательными веществами, другие клетчатка или целлюлоза - входят в состав растений и придают им прочность и твердость. Помимо этого, они используются для получения ткани, бумаги и различных волокон.
Причина появления названия «углеводы» в том, что первые известные представители этого класса соответствовали общей формуле 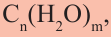 что, якобы, означало, они образованы из углерода и воды. Позднее были открыты другие представители углеводов, которые не соответствовали данной формуле.
что, якобы, означало, они образованы из углерода и воды. Позднее были открыты другие представители углеводов, которые не соответствовали данной формуле.
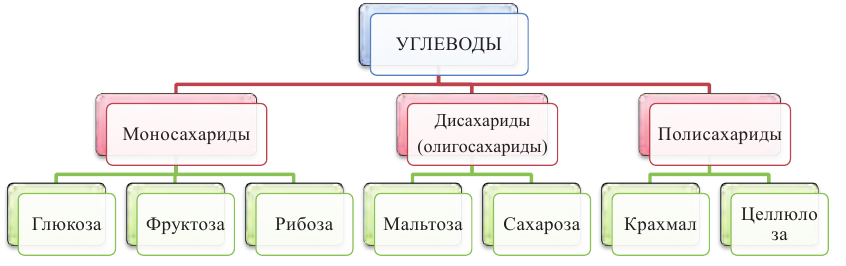
Классификация углеводов:
Углеводы, в зависимости от их строения, можно подразделить на моносахариды, дисахариды и полисахариды.
Углеводы, которые не подвергаются гидролизу, то есть не расщепляются на более простые углеводы, называются моносахаридами (глюкоза, фруктоза, рибоза). Во многих моносахаридах количество атомов углерода равно количеству атомов кислорода.
Углеводы, которые при гидролизе расщепляются на более простые углеводы, называются полисахаридами (крахмал, целлюлоза). Во многих полисахаридах количество атомов углерода не соответствует количеству атомов кислорода.
Углеводы, которые при гидролизе расщепляются на два моносахарида, называются дисахаридами (мальтоза, сахароза).
Общую классификацию углеводов можно представить в следующей схеме:
Моносахариды:
Моносахариды являются простейшими углеводами. В молекулах моносахаридов может содержаться от 3 до 10 атомов углерода. Название всех групп моносахаридов, а также название отдельных представителей оканчиваются на «оза». Например,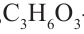 - триоза,
- триоза, 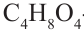 - тетроза,
- тетроза, 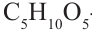 - пентоза,
- пентоза, 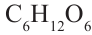 - гексоза,
- гексоза, 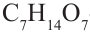 - гептоза.
- гептоза.
Свойства моносахаридов изучим на примере гексоз. Важнейшим из них является глюкоза.
Распространение в природе. Глюкоза в чистом виде встречается почти во всех органах зелёных растений, особенно много ее в виноградном соке, поэтому глюкозу иногда называют виноградным сахаром. Мед, в основном, представляет собой смесь глюкозы и фруктозы. В организме человека глюкоза содержится в мышцах, крови и в небольшом количестве во всех остальных тканях.
Строение глюкозы. Изучая химические свойства глюкозы, немецкий ученый Е. Фишер предложил формулу, в которой глюкоза представляется как многоатомный спирт и альдегид в одно и то же время, то есть альдегидоспирт. Молекулярная формула 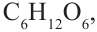 структурная формула:
структурная формула:
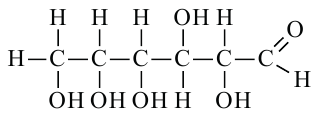
Нужно отметить, что помимо ациклической формы глюкозы есть циклическое ее строение, что подтверждается рядом реакций. Атомы углерода могут свободно вращаться вокруг о-связей. При этом альдегидная группа (1-й атом углерода) может приблизиться к гидроксильной группе пятого атома углерода. Отрицательно заряженный атом кислорода  группы связывается с положительно заряженным атомом углерода карбонильной группы, атом водорода гидроксильной группы переместится к отрицательно заряженному атому кислорода карбонильной группы, где образуется новая гидроксильная группа. В результате такой перегруппировки может образоваться циклическая молекула.
группы связывается с положительно заряженным атомом углерода карбонильной группы, атом водорода гидроксильной группы переместится к отрицательно заряженному атому кислорода карбонильной группы, где образуется новая гидроксильная группа. В результате такой перегруппировки может образоваться циклическая молекула.
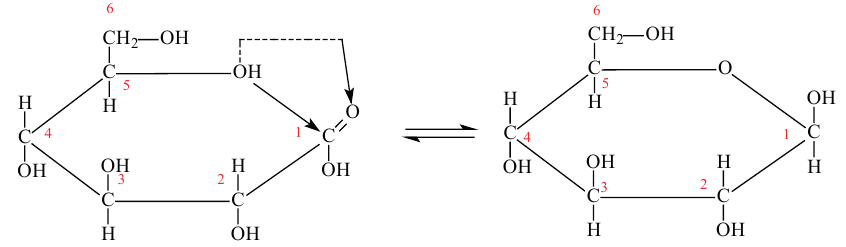
Молекулы глюкозы в циклической форме могут иметь разнообразную пространственную структуру:
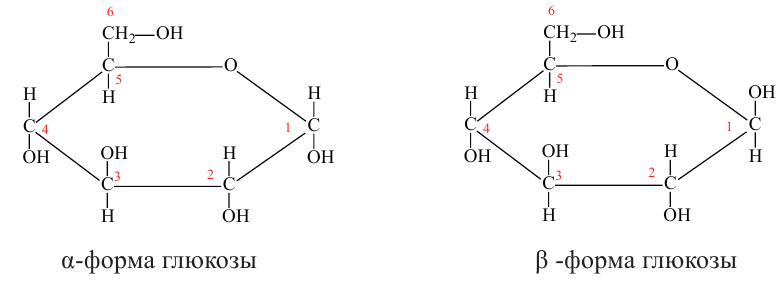
а)  -форма глюкозы - гидроксильные группы при первом и втором атомах углерода расположены по одну сторону кольца,
-форма глюкозы - гидроксильные группы при первом и втором атомах углерода расположены по одну сторону кольца,
б)  форма глюкозы - гидроксильные группы при первом и втором атомах углерода расположены по разные стороны кольца молекулы.
форма глюкозы - гидроксильные группы при первом и втором атомах углерода расположены по разные стороны кольца молекулы.
Получение:
1.A.M. Бутлеров синтезировал простейшие углеводы из формальдегида в присутствии гидроксида кальция:
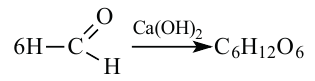
2. Углеводы в растениях образуются в процессе фотосинтеза под воздействием солнечной энергии и при участии пигмента хлорофилла из углекислого газа:
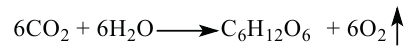
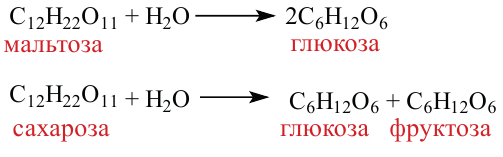
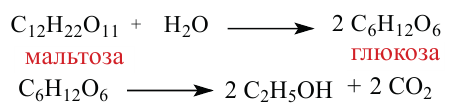
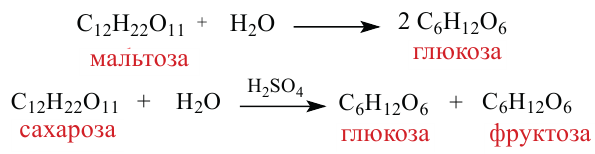
3. При гидролизе сахарозы образуются глюкоза и фруктоза:

4. В результате гидролиза мальтозы образуются две молекулы глюкозы:
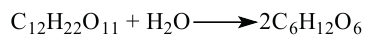
Физические свойства: Глюкоза - сладкое на вкус, бесцветное кристаллическое вещество, хорошо растворимое в воде.
Химические свойства: Глюкоза проявляет, ввиду своего строения, химическими свойствами, характерными для спиртов и альдегидов.
Как и альдегиды, глюкоза легко окисляется и дает реакцию «серебряного зеркала». Образовавшийся продукт называется глюконовой кислотой:

Для окисления альдегидной группы можно также использовать гидроксид меди (II):
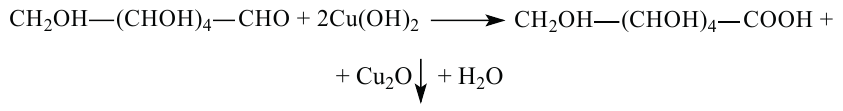
Глюкоза может восстановиться водородом, при этом восстанавливается альдегидная группа и образуется спирт (шестиатомный спирт - сорбит):

Глюкоза как многоатомный спирт реагирует с гидроксидом меди (II) и образует комплексные соединения.
Важнейшее химическое свойство моносахаридов - их брожение под воздействием ферментов микроорганизмов.
Спиртовое брожение:
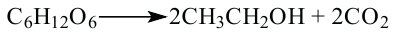
Применение: Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям, в результате которых освобождается необходимая для жизнедеятельности энергия. Упрощенно процесс окисления глюкозы в организме можно выразить следующим уравнением:
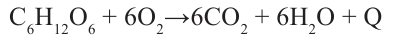
Этот процесс протекает ступенчато, и поэтому энергия выделяется медленно. Так как глюкоза легко усваивается организмом, ее используют в медицине в качестве укрепляющего средства. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников, и т.д.).
Фруктоза:
В молекуле фруктозы есть характерная для спиртов 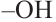 и характерная
и характерная
для кетонов 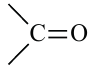 функциональные группы. И поэтому фруктоза -кетоноспирт.
функциональные группы. И поэтому фруктоза -кетоноспирт.
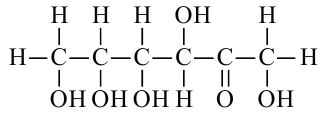
Наряду с глюкозой, фруктоза встречается в составе сладких фруктов, меда и в составе сахарного тростника (сахароза).
Фруктоза (фруктовый сахар 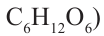 - бесцветное кристаллическое вещество, хорошо растворимое в воде.
- бесцветное кристаллическое вещество, хорошо растворимое в воде.
Пример №3
При синтезе глюкозы способом Бутлерова использовали вещество, содержащее 90  -гибридных орбиталей. Определите массу (г) образованного моносахарида.
-гибридных орбиталей. Определите массу (г) образованного моносахарида.
Решение:
Для этой реакции используют муравьиный альдегид и в его составе имеется 2  -гибридных атома, а значит 6
-гибридных атома, а значит 6 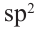 -гибридных орбиталей. Напишем уравнение реакции:
-гибридных орбиталей. Напишем уравнение реакции:
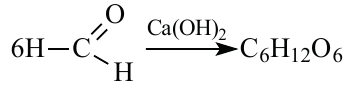
При этом из 6 молей метаналя образуется 1 моль глюкозы. Количество гибридных орбиталей в 6 молях метаналя равно  Учитывая это, составим пропорцию:
Учитывая это, составим пропорцию:
Из метаналя с 36  -гибридными орбиталями образуется 180 г глюкозы 90
-гибридными орбиталями образуется 180 г глюкозы 90 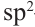 —гибридных орбиталей образуют
—гибридных орбиталей образуют  г глюкозы
г глюкозы
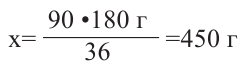
Ответ: 450 г глюкоза
Пример №4
С продуктами гидролиза мальтозы и сахарозы провели реакцию «серебряного зеркала». В результате образовалось 172,8 г осадка. Определите массу начальной смеси, если мольное соотношение веществ в ней было соответственно 1:2. Решение:
Напишем уравнение реакций:
 Учитывая, что реакцию «серебряного зеркала» даёт только глюкоза, найдем количество осадка из приведенного в условии соотношения:
Учитывая, что реакцию «серебряного зеркала» даёт только глюкоза, найдем количество осадка из приведенного в условии соотношения:
В сумме 4 моль глюкозы: 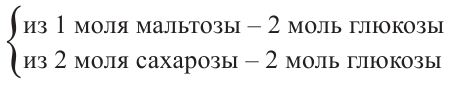
Из 4 молей глюкозы выпадет в осадок в два раза больше вещества, то есть 8 моль.
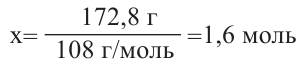
Затем найдем количество моль осадка: 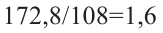 и составим пропорцию: Из 3 молей дисахаридов - 8 моль осадка
и составим пропорцию: Из 3 молей дисахаридов - 8 моль осадка
Из 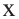 моль - 1,6 моль осадка
моль - 1,6 моль осадка
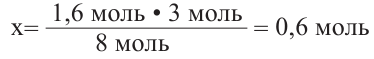
Значит, было 0,6 молей смеси дисахаридов. Чтобы найти массу смеси, нужно: 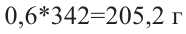
Ответ: 205,2 г.
Дисахариды. Полисахариды. Получение и свойства
Углеводы, которые при гидролизе образуют 2 молекулы моносахарида, называются дисахаридами. К ним относятся сахароза и мальтоза. Все дисахариды выражаются общей формулой 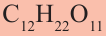
Дисахариды хорошо растворимы в воде, сладкие на вкус. Большинство из них хорошо кристаллизуются и имеют точную молекулярную массу. В природе широко распространены сахароза (тростниковый или свекольный сахар) и мальтоза (солодовый сахар).
При гидролизе дисахаридов могут образоваться одинаковые или разные моносахариды.
Сахароза называется тростниковым или свекольным сахаром. Она широко распространена в растительном мире. Сахароза является ценным питательным веществом и имеет большое значение в жизни человека.
Физические свойства: Чистая сахароза - бесцветное кристаллическое вещество сладкое на вкус, хорошо растворимое в воде.
Химические свойства: Важнейшее химическое свойство сахарозы -способность подвергаться гидролизу:
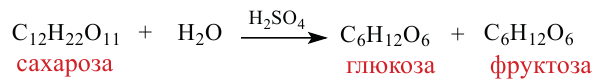
Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы. Можно определить образование глюкозы из сахарозы.
В раствор сахарозы сначала добавим несколько капель 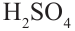 и начнем нагревать. Затем нейтрализуем кислоту щелочью, в раствор добавим
и начнем нагревать. Затем нейтрализуем кислоту щелочью, в раствор добавим 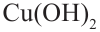 и нагреем раствор. В результате образуется красный осадок. Из этого можно сделать следующий вывод, что под воздействием серной кислоты сахароза гидролизуется и образует глюкозу, которая содержит альдегидную группу. Молекула, содержащая альдегидную группу, восстанавливает
и нагреем раствор. В результате образуется красный осадок. Из этого можно сделать следующий вывод, что под воздействием серной кислоты сахароза гидролизуется и образует глюкозу, которая содержит альдегидную группу. Молекула, содержащая альдегидную группу, восстанавливает 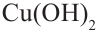 до образования красного осадка, то есть до образования
до образования красного осадка, то есть до образования 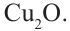
Мальтоза. При гидролизе одной молекулы мальтозы образуется две молекулы глюкозы.
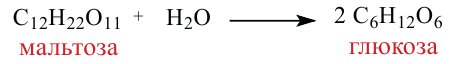
ПОЛИСАХАРИДЫ:
Полисахариды являются высокомолекулярными соединениями, которые широко распространены в природе и играют важную роль в жизни человека и животных. Полисахариды образованы из множества остатков моносахаридов. Примером полисахаридов являются крахмал и целлюлоза.
Крахмал: Крахмал  является природным полимером, масса этого полимера не определена точно. Из-за этого формула крахмала выражается, как и у других полисахаридов, в виде
является природным полимером, масса этого полимера не определена точно. Из-за этого формула крахмала выражается, как и у других полисахаридов, в виде 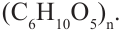
Так как при гидролизе крахмала образуется только глюкоза , то можно сделать вывод, что эти звенья являются остатками молекул глюкозы:
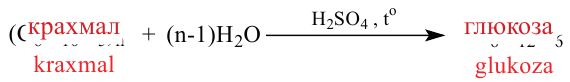
Доказано, что макромолекулы крахмала состоят из остатков молекул циклической 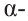 глюкозы. Процесс образования крахмала можно представить так:
глюкозы. Процесс образования крахмала можно представить так:
Образование крахмала основывается на реакции поликонденсации, т.е. из низкомолекулярного вещества - глюкозы - образуется высокомолекулярное вещество крахмал и образуется вода в качестве побочного продукта.
Физические свойства: Крахмал - белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер.
Химические свойства: Характерной реакцией крахмала является его взаимодействие с йодом. Если к охлажденному крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание. Этот процесс можно определить простым опытом. Так, например, если каплю раствора йода накапать на срез картофеля или ломтик белого хлеба, то появляется синее окрашивание.
Применение: Крахмал является ценным питательным продуктом. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергаются действию высокой температуры, то есть картофель варят, хлеб пекут. В этих условиях происходит частичный гидролиз крахмала и он становится растворимым в воде.
Целлюлоза. Целлюлоза  также является природным полимером, входит в состав всех растений и образует у них оболочку клетки. Ее название произошло от слова «sellula» - клетка. Целлюлоза составляет основную часть хлопкового волокна. Бумага, хлопчатобумажные ткани -это изделия из целлюлозы. Она также встречается в составе древесины.
также является природным полимером, входит в состав всех растений и образует у них оболочку клетки. Ее название произошло от слова «sellula» - клетка. Целлюлоза составляет основную часть хлопкового волокна. Бумага, хлопчатобумажные ткани -это изделия из целлюлозы. Она также встречается в составе древесины.
Целлюлоза, как и крахмал, является природным высокомолекулярным соединением. Общая формула целлюлозы и крахмала схожи, и состоят из звеньев глюкозы.
Эти полимеры отличаются друг от друга различным соединением остатков глюкозы. Если крахмал является важным пищевым продуктом для человека, то целлюлоза в этих целях не пригодна.
Физические свойства. Целлюлоза - волокнистое вещество без вкуса и запаха, нерастворимое в воде. Молекулярная масса целлюлозы очень огромна.

Химические свойства:
1. Целлюлоза не дает реакцию «серебряного зеркала» (не имеет альдегидную группу). Целлюлоза под действием кислот частично гидролизуется:
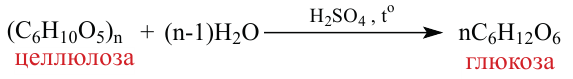
2. Целлюлоза горит. При этом образуется углекислый газ и вода:

Пример №5
Если приблизительная молекулярная масса крахмала равна 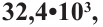 определите количество (моль) глюкозы, которое образуется при гидролизе данного крахмала.
определите количество (моль) глюкозы, которое образуется при гидролизе данного крахмала.
Решение задачи:
Известно, что количество глюкозы, которая образуется при гидролизе крахмала равна степени полимеризации этого крахмала. В свою очередь, чтобы найти степень полимеризации, следует массу полимера поделить на массу звена, составляющего этот полимер.
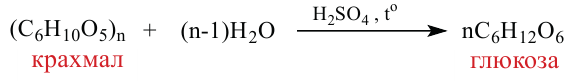
Структурная единица крахмала 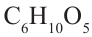 имеет массу равную 162 г/моль, используя массу из условия можно найти степень полимеризации
имеет массу равную 162 г/моль, используя массу из условия можно найти степень полимеризации 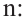
162 г/моль - масса 1 одной структурной единицы
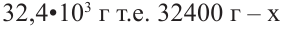 структурных единиц
структурных единиц
Итак, из такой массы крахмала образуется 200 моль глюкозы.
Ответ: 200 моль
Пример №6
Сколько (г) этанола можно получить при спиртовом брожении глюкозы, полученной из 2,5 моль мальтозы?
Решение задачи:
Сначала нужно уравнять реакцию, приведенную в условии задачи:
Как видим, из одной молекулы мальтозы образуются две молекулы глюкозы. В свою очередь, из одной молекулы глюкозы образуются две молекулы этилового спирта. Значит, из одной молекулы мальтозы можно получить 4 моль этилового спирта (или 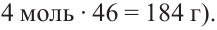 Используя эти данные, можно рассчитать, сколько этилового спирта можно получить из 2,5 моль мальтозы:
Используя эти данные, можно рассчитать, сколько этилового спирта можно получить из 2,5 моль мальтозы:
Из 1 моля мальтозы - 184 г этанола
Из 2,5 молей - 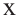 грамм
грамм
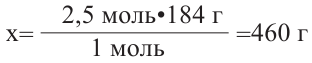
Ответ: 460 г.
Пример №7
Если из 2,5 моль смеси мальтозы и сахарозы получили 720 г глюкозы, то определите в каких мольных соотношениях были взяты начальные вещества.
Решение задачи:
Сначала напишем реакцию приведенных веществ с водой:
Если количество мальтозы выразить через 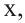 а сахарозы через
а сахарозы через 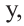 то количество глюкозы, образованное из этих веществ будет соответственно
то количество глюкозы, образованное из этих веществ будет соответственно 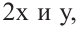 и их сумма равна
и их сумма равна 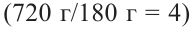 равна 4 молям. Используя все данные можно составить уравнение:
равна 4 молям. Используя все данные можно составить уравнение:
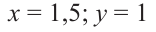
Известно, что мальтоза и сахароза являются изомерами, то есть их молекулярные массы одинаковы. Это значит их мольное соотношение равно массовому соотношению.
Ответ: 1,5:1
Кислород - содержащие органические соединения
Спирты и фенолы
Химический анализ древних сосудов периода неолита на территории Китая (провинция Хэнань) указывает на то, что в этих сосудах хранился алкоголь. Установлено, что еще за 6650-7000 лет до н.э. алкогольные напитки получали из винограда, меда, кукурузы и крахмала путем брожения (ферментации). Предполагается, что алкогольсодержащие напитки появились в Иране (Персии) за 5400 лет, Египте за 3150 лет, Мексике за 2000 лет до н.э. В настоящее время алкоголь, другими словами, спирты, применяются также в качестве горючего на некоторых видах транспорта.
Слово спирт происходит от латинского выражения spiritus vini ("дух вина").
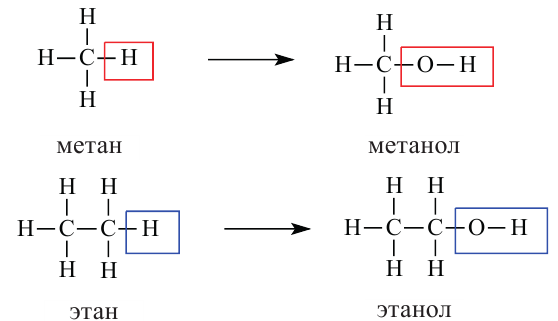
В X классе из органических соединений вы ознакомились только с углеводородами. В этом учебном году вы изучите кислород- и азотсодержащие производные углеводородов - органические соединения, в молекулах которых углеводородный радикал связан с функциональной группой (-ОН, -СНО, -NH2 и др.). Знакомство с этими соединениями мы начнем с гидроксилсодержащих органических соединений - спиртов и фенолов. В спиртах и фенолах функциональной группой является гидроксильная (-ОН) группа.

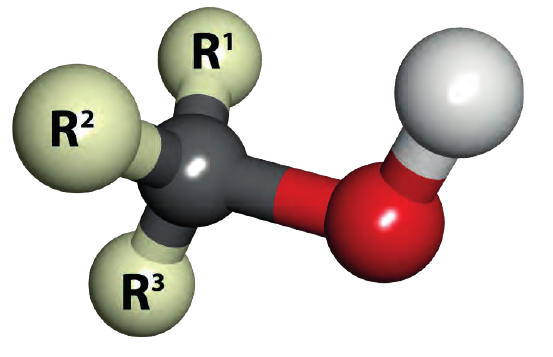
Спирты - это органические вещества, в молекулах которых одна или несколько гидроксильных групп соединены с углеводородным радикалом (но не арильным радикалом).
Спирты классифицируют по природе углеводородного радикала и числу гидроксильных групп.
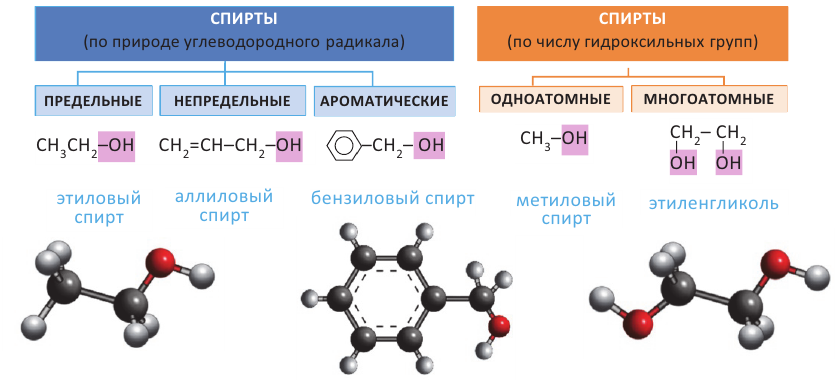
Предельные одноатомные спирты
Номенклатура и изомерия:
Со спиртами мы систематически встречаемся в быту, медицине и различных областях промышленности. Поэтому очень важно различать спирты как друг от друга, так и от других веществ, а также знать правила их наименования.
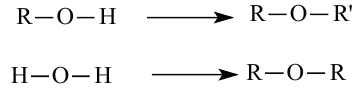
В молекулах предельных одноатомных спиртов алкильный радикал (R) связан с одной гидроксильной группой: R-OH. Поэтому формулы этих спиртов составляют путем замены в формуле алкана одного атома водорода на гидроксильную группу:

Состав предельных одноатомных спиртов выражается общей формулой CnH2n+1OH или CnH2n+2O 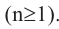
Пример №8
Вычисления, связанные с составом спиртов
| Предельный одноатомный спирт | Mr спирта | Массовое соотношение элементов (C,O) в молекуле |
| ROH | 46 | m(C):m(O)=? |
Решение:
Выразим Mr спирта числом атомов углерода в его молекуле (n) и найдем это число:
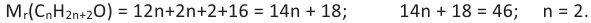
Таким образом, формула спирта будет С2Н6О или С2Н5ОН.
Тогда отношение масс углерода и кислорода в молекуле будет равно:
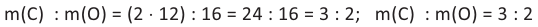
Номенклатура: Для названия нормальных (неразветвленных) предельных одноатомных спиртов по Международной номенклатуре к названию алкана, соответствующего числу атомов углерода в молекуле спирта, добавляется
окончание «-ол»:

Исторически метанол называли карбинолом или древесным спиртом, а этанол - винным спиртом.
Наименование алканолов с разветвленным строением углеродного скелета производится в следующей последовательности:
- Выбирается наиболее длинная углеродная цепь (главная цепь) молекулы, содержащая атом углерода, связанный с -ОН группой;
- Атомы углерода главной цепи нумеруются начиная с того конца, который ближе к -ОН группе;
- В названии указываются номера атомов углерода, несущих радикалы, число радикалов и названия этих радикалов;
- Присоединяя окончание "-ол" к названию алкана, соответствующего главной цепи молекулы спирта, указывают номер атома углерода, связанного с -ОН группой:
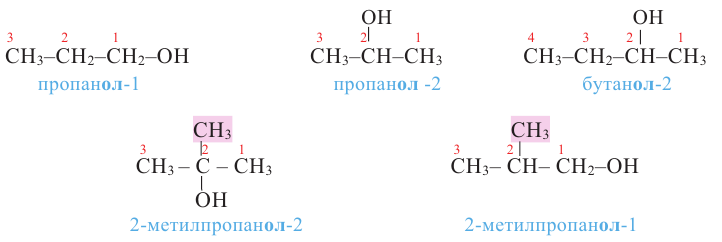
Названия предельных одноатомных спиртов составляют также из названия соответствующего радикала с добавлением слова "спирт":
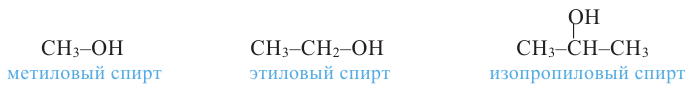
Изомерия: Для предельных одноатомных спиртов свойственна внутриклассовая и межклассовая структурная изомерия. Внутриклассовая структурная изомерия происходит по двум причинам: из-за различного строения углеродной цепи и различного положения -ОН группы в углеродной цепи.
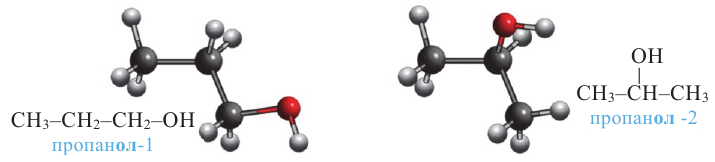
Внутриклассовая структурная изомерия начинается с пропанола. Изомерия в пропаноле обусловлена только положением -ОН группы в углеродной цепи:
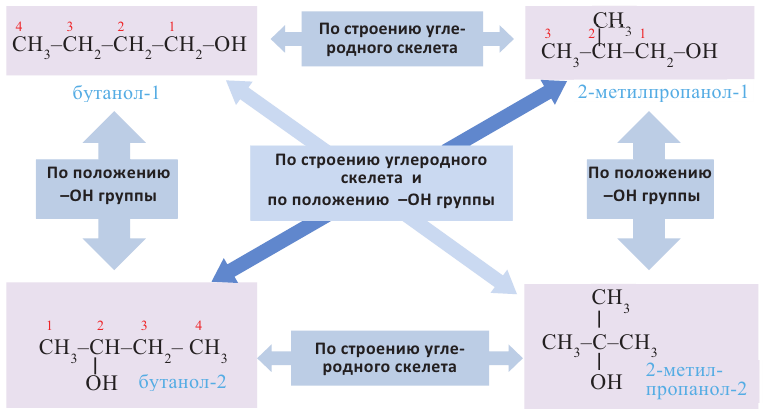
Начиная с бутанола внутриклассовая структурная изомерия обусловлена обеими причинами:
Простые эфиры и предельные одноатомные спирты имеют одну общую формулу - СnН2n+2О, поэтому между ними существует межклассовая изомерия. Например, этиловый спирт и диметиловый эфир являются межклассовыми изомерами:
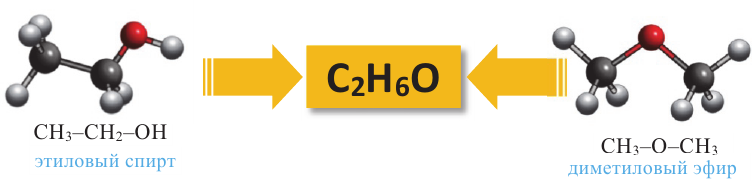
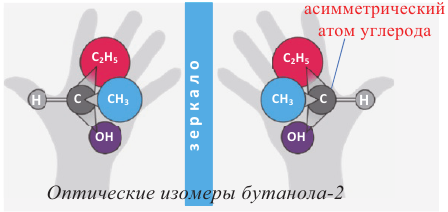
В алканолах оптическая изомерия начинается с бутанола-2. В его молекуле второй атом углерода связан с 4 различными атомами и группами атомов (-Н, -ОН, -СН3, -С2Н5), в результате чего молекула существует в виде двух оптических изомеров:
Примечание: На схеме атом Н и асимметрический атом углерода расположены в плоскости листа, -ОН и -С2Н5 группы направлены за плоскость листа, а -СН3 группа - к читателю.
Знаете ли вы... При замещении в молекуле воды одного из атомов водорода углеводородным радикалом «образуются» спирты, а при замещении обоих атомов водорода - простые эфиры:
Получение:
Этиловый спирт (биоэтанол) входит в состав экологически более чистого биотоплива.
В промышленности биоэтанол получают переработкой сырья растительного происхождения, к примеру, кукурузы (США) или сахарного тростника (Бразилия).

В природе спирты в свободном состоянии встречаются редко. Поэтому их получают, главным образом, синтетическим путем.
Метанол в промышленности получают из синтез-газа:
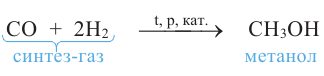
Метанол раньше получали пиролизом древесины
Этанол получают из сахаристых веществ, в составе которых содержится глюкоза или ее остатки:
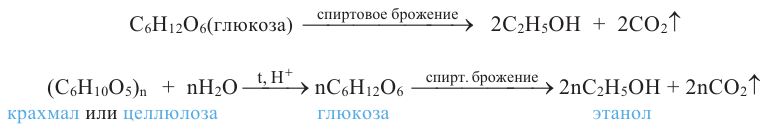
Вычисления, связанные с получением спиртов
Сколько м3 (н.у.) синтез-газа потребуется для получения 64 кг метанола, если выход спирта составляет 80% от теоретического? Mr(СН3ОН)=32.
Решение:
Найдем теоретически ожидаемую массу спирта, т.е. массу без потерь:
Если при 80%-м выходе получается 64 кг метанола, то при 100%-м выходе получится 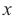 кг метанола.
кг метанола.
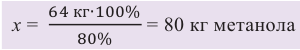
По уравнению реакции вычислим объем синтез-газа, необходимого для получения 80 кг метанола (н.у.):
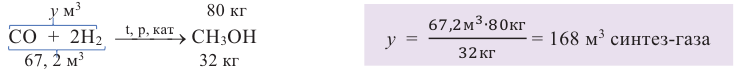
Таким образом, для получения 64 кг метанола с выходом 80% потребуется 168 м3 (н.у.) синтез-газа.
Получение этилового спирта из древесины (целлюлозы) является одним из важных методов, так как здесь используется дешевое сырье, непригодное для питания. Этиловый спирт, получаемый из целлюлозы, называется гидролизным спиртом.
В настоящее время в промышленности этиловый спирт получают также и каталитической гидратацией этилена:
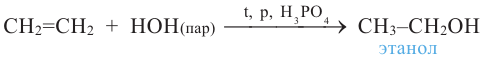
Гидратацией гомологов этилена получают вторичные и третичные спирты:

Марк Александрович Далин (1906- 1996) Азербайджанский нефтехимик
Всесторонне изучил гидратацию олефинов. Первый завод по производству этанола из этилена в бывшем СССР был построен по предложенной им технологической схеме.
Спирты, например, амиловые (пентиловые), получают в промышленности действием водного раствора щелочи на соответствующие алкилгалогениды:
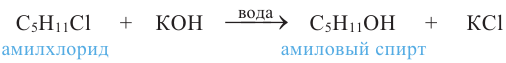
Амиловые спирты (С5Н11ОН) используют для получения сложных эфиров в производстве духов, а изоамиловый спирт (З-метилбутанол-1) - также для определения жирности молочных продуктов.
Первичные спирты можно получить гидрированием альдегидов, а вторичные спирты - гидрированием кетонов:
Строение и физические свойства:
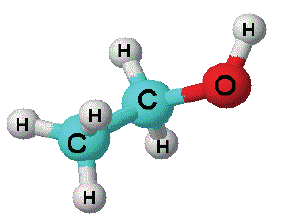
Строение: В молекулах алканолов атом кислорода наряду с атомами углерода находится в состоянии sp3 гибридизации. Поэтому в спиртах, например, в молекуле метанола, валентный угол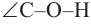 (108,6°) (с) близок к тетраэдрическому (109,5°) углу.
(108,6°) (с) близок к тетраэдрическому (109,5°) углу.
Однако, в отличие от атомов углерода, из четырех sp3 гибридных орбиталей атома кислорода лишь две принимают участие в образовании связей; на двух других орбиталях располагаются неподеленные электронные пары (а):
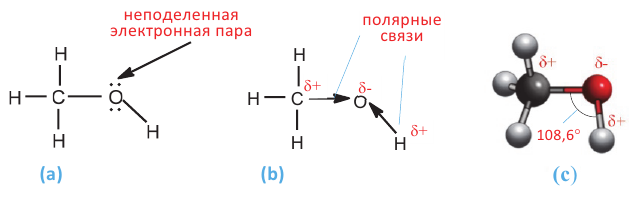
- (a) - неподеленные электронные пары атома кислорода в молекуле метанола
- (b) - полярные С-O и О-Н связи
- (c) - шаро-стержневая модель молекулы метанола
В молекулах спиртов связи О-Н и О-С - полярные. В обеих связях электроны смещены к атому кислорода (b). В О-Н связи, это смещение происходит в большей степени, в результате чего О-Н связь - относительно сильнополярная ковалентная связь.
Полярность этих двух связей обуславливает и полярность молекул спиртов.
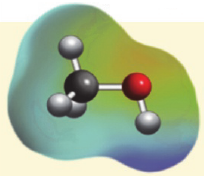
На карте электронной плотности молекулы метанола частичный отрицательный заряд (красная область) располагается вокруг атома кислорода, а частичный положительный заряд (синяя область) - вокруг атома Н гидроксильной группы.
Пример №9
Вычислите общее число атомов в молекуле предельного одноатомного спирта, содержащего (m+1) число атомов углерода.
Решение:
Заменив в формуле CnH2n+1OH n на m+1, выразим общее число атомов в молекуле через 
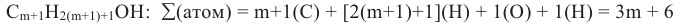
Наличие сильнополярной O-Н связи в молекуле спиртов проявляется в их физических и химических свойствах.
Физические свойства: Спирты, содержащие до 12 атомов углерода в молекуле - жидкости, а начиная с С12Н25ОН и далее это - твердые вещества. Температура кипения спиртов выше температуры кипения алканов с примерно равными молекулярными массами: например, температура кипения этанола 78°С, а пропана - минус 42°С.
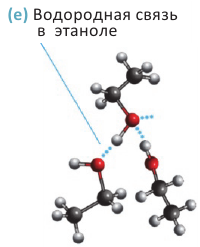
Высокая температура кипения спиртов объясняется наличием водородных связей между их молекулами (е). С увеличением размеров молекул силы притяжения между ними возрастают; поэтому с ростом относительной молекулярной массы температура кипения спиртов увеличивается:

Метанол, этанол и пропанол-1 с водой смешиваются в любых отношениях. Это связано с образованием водородных связей между молекулами спирта и воды в их водных растворах:
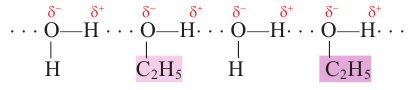
С ростом молекулярной массы растворимость спиртов в воде уменьшается. Начиная с октанола (С8Н17ОН), спирты практически нерастворимы в воде.
Все спирты легче воды. Метанол, этанол и пропанол-1 имеют специфический алкогольный запах. Метанол очень ядовит.
О силах, влияющих на агрегатное состояние вещества.
Силы притяжения между любыми неполярными молекулами являются Вандерваальсовыми силами. Именно благодаря их наличию, алканы, состоящие из неполярных молекул - пентан, гексан и др. при комнатной температуре находятся в жидком состоянии. Если вещество состоит из полярных молекул, то один из компонент Вандерваальсовых сил - диполь-дипольные взаимодействия возрастают, что отражается на температуре кипения вещества. Например, этан кипит при минус 89°С, в то время как формальдегид, имеющий такую же молекулярную массу, кипит при минус 21°С (то есть на 68°С выше). Эта разница в температурах кипения и обусловлена, главным образом, диполь-дипольным взаимодействием между полярными молекулами формальдегида.
Химические свойства и применение:
При систематическом приеме этилового спирта продукт его превращения, ацетальдегид, приводит к различным отрицательным последствиям и болезням, таким как ослабление деятельности мозга, цирроз печени и пр.
Большинство химических свойств спиртов обусловлено полярностью О-Н связи в их молекулах.
1. Действие на индикаторы. Водные растворы спиртов не изменяют цвет индикаторов.
2. Взаимодействие с металлами. Активные металлы (Na, К и др.) легко замещают водород О-Н группы спиртов. Органическое вещество, образующееся в результате реакции, называют алкоголятом:
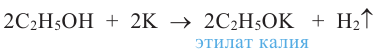
Знаете ли вы... Щелочные металлы со спиртами реагируют медленнее, чем с водой. Поэтому в химических лабораториях для уничтожения избытка металлического натрия, оставшегося после опытов, используют этиловый спирт.
Алкоголяты - твердые вещества. В водных растворах они, подвергаясь гидролизу, образуют спирт и щелочь:

По этой причине одноатомные предельные спирты не взаимодействуют с растворами щелочей. С твердыми щелочами они реагируют обратимо.
3. Взаимодействие с кислотами. Спирты взаимодействуют с органическими и неорганическими кислородсодержащими кислотами, образуя сложные эфиры, например:
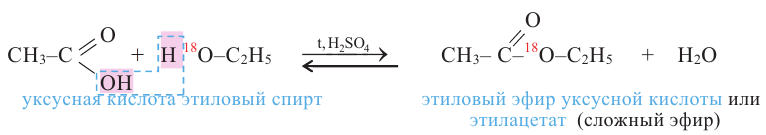
Эта реакция называется реакцией этерификации. Отщепление воды происходит с участием серной кислоты. При этом молекула воды образуется из -ОН группы карбоновой кислоты и атома водорода -ОН группы спирта.
4. Дегидратация спиртов в присутствии концентрированной серной кислоты. Спирты в присутствии концентрированной серной кислоты и в зависимости от температуры подвергаются внутримолекулярной и межмолекулярной дегидратации. При температуре выше 140°С протекает внутримолекулярная дегидратация и образуется алкен:
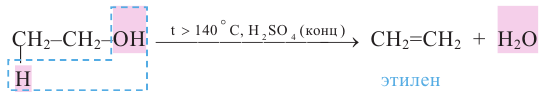
Согласно правилу Зайцева, при внутримолекулярной дегидратации вторичных и третичных спиртов атом водорода отщепляется, главным образом, от атома углерода с меньшим числом атомов водорода.
Пример №10
Какой алкен образуется, в основном, при дегидратации бутанола-2?
Решение:
Согласно правилу Зайцева, молекула воды образуется из -ОН группы и из атома водорода, главным образом, метиленовой (>СН2) группы:
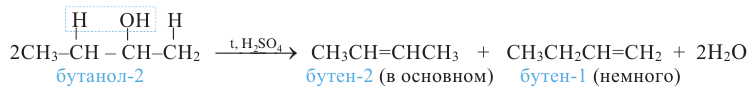
Поэтому в результате дегидратации бутанола-2 образуется в основном бутен-2.
Если температура ниже 140°С, то первичные и вторичные спирты подвергаются межмолекулярной дегидратации и образуются простые эфиры:
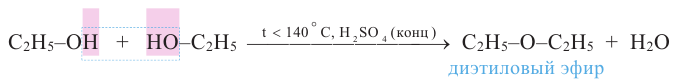
При межмолекулярной дегидратации двух разных спиртов (R1OH, R2OH) образуется смесь трех простых эфиров (R1-O-R1, R1-O-R2, R2-O-R2).
Диэтиловый эфир был получен в 1540 году алхимиком Валери Кордусом из этилового спирта в присутствии серной кислоты. По этой причине его назвали "серным эфиром". Начиная с середины XIX века его применяли в качестве наркоза и потому назвали также "медицинским эфиром".
Общая формула простых эфиров R1-O-R2. Если радикалы R1 и R2 одинаковы, то простой эфир называют симметричным, если разные - несимметричным или смешанным:
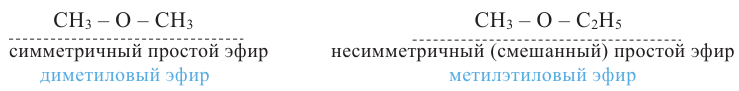
Из-за отсутствия в молекулах простых эфиров -ОН групп их молекулы не образуют между собой водородной связи. Поэтому температура кипения простых эфиров ниже, чем температура кипения спиртов с тем же числом атомов углерода.
Простые эфиры легче воды и в ней плохо растворяются. Они хорошо растворяют органические вещества. Многие из них приятно пахнут.
Простые эфиры (исключая их легкую воспламеняемость) - малореакционноспособные вещества.
5. Окисление предельных первичных и вторичных спиртов. Под действием слабых окислителей первичные спирты образуют альдегиды; например, этанол при нагревании с оксидом меди(II) окисляется в уксусный альдегид:
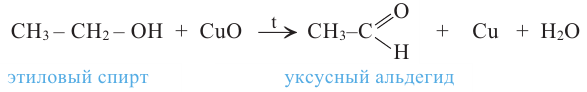
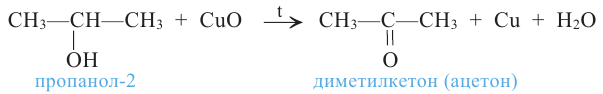
Вторичные спирты при окислении превращаются в кетоны:
Сильные окислители (KMnO4, К2Сr2О7 в присутствии концентрированной серной кислоты) окисляют этанол до уксусной кислоты. Т
Третичные спирты оксидом меди (II) не окисляются.
6. Реакции горения. Спирты вступают в реакцию горения. На воздухе этанол горит голубоватым пламенем:
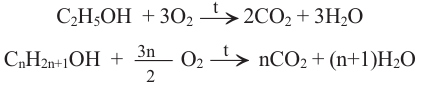
Пример №11
Для полного сгорания 1 моль какого предельного одноатомного спирта израсходуется 6 моль кислорода?
Решение:
Учитывая уравнение горения спирта 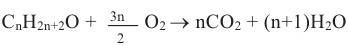 и условие задачи
и условие задачи 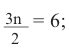 находим, что:
находим, что: 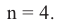
Значит формула спирта - С4Н9ОН.
7. Взаимодействие с галогеноводородами. В присутствии концентрированной серной кислоты спирты с галогеноводородами образуют алкилгалогениды:
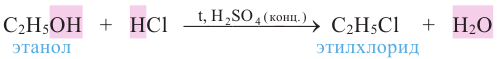
Применение: Метиловый спирт используют в качестве растворителя, а также во многих органических синтезах, например, в синтезе формальдегида, красителей и лекарственных препаратов.
Этиловый спирт (этанол) применяется в производстве синтетического каучука, пластмасс, духов, лекарств, лаков и алкогольных напитков, а также для консервации анатомических препаратов. Этанол применяется в производстве многих других органических соединений - диэтилового эфира, красителей, уксусной кислоты, бездымного пороха и др.
Смесь этанола с бензином применяют в качестве топлива в двигателях внутреннего сгорания. Этиловый спирт также используется в медицине - для дезинфекции кожи, приготовления настоев и экстрактов.
Технический спирт смешивают с плохо пахнущими или красящими веществами, чтобы его не употребляли вовнутрь. Такой спирт называют денатурированным спиртом (денатуратом).
Предельные многоатомные спирты
Этиленгликоль:
Для предотвращения перегрева двигателя автомобиля выше 85-90°С в качестве охлаждающей жидкости используют антифриз на основе этиленгликоля.
Названия двух- и трехатомных спиртов по Международной номенклатуре образуют из названия алкана, соответствующего самой длинной углеродной цепи, содержащей все -ОН группы спирта с добавлением окончания "диол" или "триол" и указанием положения -ОН групп в цепи цифрами. Атомы углерода главной цепи нумеруются, начиная с того конца, который ближе к одной из -ОН групп, например:
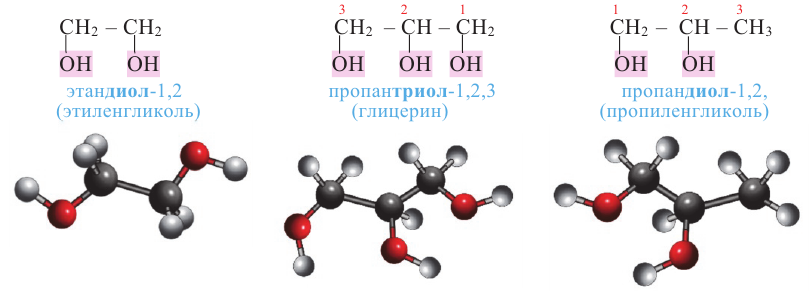
Этиленгликоль - простейший представитель предельных двухатомных спиртов (гликолей). Общая формула предельных двухатомных спиртов СnН2n(ОН)2 или СnН2n+2O2.
Получение: В лаборатории этиленгликоль можно получить окислением этилена раствором перманганата калия:
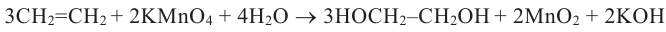
В промышленности этиленгликоль получают следующими способами:
- гидратацией оксида этилена:
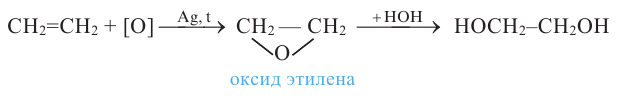
- каталитическим окислением этилена пероксидом водорода:
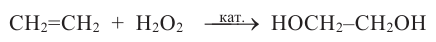
- гидролизом 1,2-дигалогенопроизводных этана в присутствии щелочи или соды:
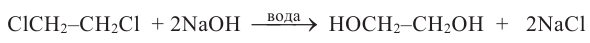
Физические свойства: Этиленгликоль - бесцветная сиропообразная, сладкая на вкус жидкость. Очень ядовитое вещество; замерзает при -13,2°С, кипит при +197,6°С. Высокая температура кипения и вязкость этиленгликоля обусловлена возникновением достаточно сильных межмолекулярных водородных связей между -ОН группами.
Этиленгликоль хорошо растворяется в воде и этаноле. Хорошая растворимость в этих растворителях связана с образованием водородных связей между молекулами этиленгликоля и воды, а также этиленгликоля и этанола.
Химические свойства: Этиленгликоль взаимодействует с щелочными металлами, щелочами, а также с органическими и неорганическими кислотами:
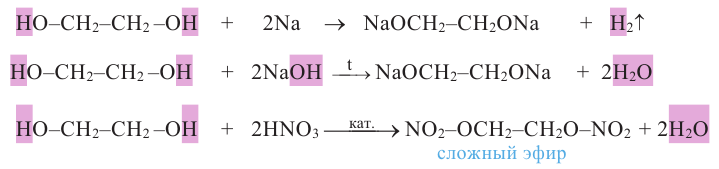
Пример №12
Нахождение молекулярной формулы многоатомных спиртов
Определите молекулярную формулу X.
| Предельный спирт | Число моль спирта | Число моль H2, образовавшегося при полном взаимодействии с Na | Масса полученного алкоголята натрия (г) |
| X | 0,2 | 0,2 | 21,2 |
Решение:
a. Образование 0,2 моль H2 из 0,2 моль спирта указывает, что исходный спирт - двухатомный спирт СnН2n(ОН)2. Вычислим из уравнения реакции молярную массу алкоголята натрия:
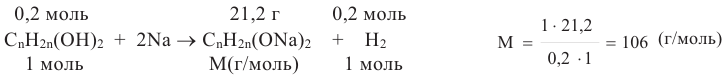
b. Выразим молярную массу алкоголята посредством n и отсюда найдем значение n:
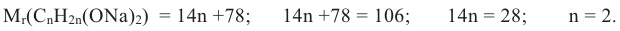
Значит, формула спирта C2H4(OH)2.
Этиленгликоль, в отличие от одноатомных спиртов, в щелочной среде с гидроксидом меди (II) образует ярко-синий раствор гликолята меди(II):
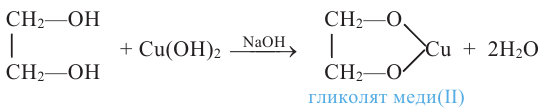
Эта реакция является качественной реакцией на многоатомные спирты.
Примечание. Продукт реакции - комплексное соединение меди (II), содержащее 2 остатка этиленгликоля. Здесь приведена его упрощенная формула.
Применение. Водные растворы этиленгликоля не замерзают при температурах ниже 0°С; например, 67%-ный водный раствор этиленгликоля замерзает лишь при минус 75°С. Поэтому они зимой применяются в качестве антифриза в радиаторах автомобилей, тракторов и др. механизмов.
Этиленгликоль используют в производстве волокна лавсана, растворителя диоксана, взрывчатых веществ, например, динитрогликоля.
Глицерин:
Глицерин, как увлажнитель и смягчитель применяется для очистки дыхательных путей, изготовления лекарственных препаратов, в кожевенном производстве, в производстве душистых веществ, различных настоев.
Глицерин [С3Н5(ОН)3] - простейший представитель предельных трехатомных спиртов, общая формула которых CnН2n-1(ОН)3 или СnH2n+2О3 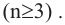
Получение. Глицерин получают гидролизом жиров в щелочной среде:
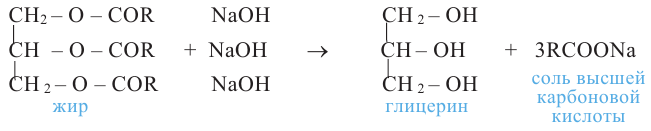
и окислением пропилена:
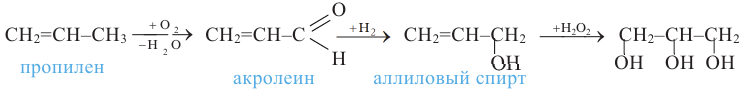
Физические свойства: Глицерин - бесцветная сиропообразная жидкость сладкого вкуса. Он гигроскопичный и с водой смешивается в любых соотношениях; замерзает при 17,9°С, кипит - +290°С. Не ядовит.
Химические свойства: Глицерин, как и этиленгликоль, реагирует с активными металлами, щелочами и кислотами. Как многоатомный спирт с гидроксидом меди (II) он образует ярко-синий раствор глицерата меди (II):
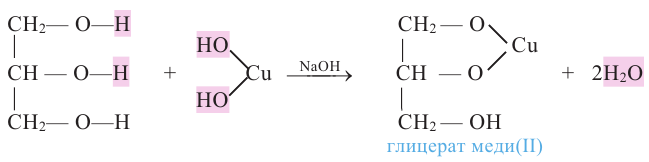
Эта реакция также является качественной реакцией для глицерина. Примечание. Продукт реакции - комплексное соединение меди (II), содержащее 2 остатка глицерина. В уравнении приведена его упрощенная формула.
В присутствии концентрированной серной кислоты глицерин с азотной кислотой образует сложный эфир - нитроглицерин (глицеринтринитрат):
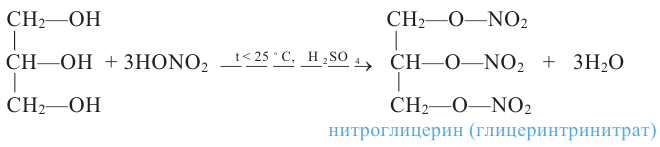
Нитроглицерин - тяжелая маслянистая бесцветная жидкость. Применяется как взрывчатое вещество. При нагревании или ударе взрывается:

Знаете ли вы.. Нитроглицерин - взрывчатое и лекарственное вещество

Нитроглицерин впервые был получен в 1847 году итальянским ученым Асканио Собреро. Довольно быстро его начали широко использовать как взрывчатое вещество при проведении водных каналов, туннелей, дорог, а также в военном деле. Однако чистый нитроглицерин имел недостаток: он часто и неожиданно взрывался. По этой причине его применение требовало больших предосторожностей. В 1865 году шведский химик Альфред Нобель выяснил, что нитроглицерин, поглощенный твердым адсорбентом, взрывался только при его поджигании. Эту смесь Нобель назвал динамитом.

1%-ный спиртовой раствор нитроглицерина используется в медицине при сердечно-сосудистых заболеваниях для расширения кровеносных сосудов.
По завещанию А. Нобеля, созданный им Нобелевский фонд, ежегодно премирует наиболее значимые открытия в области физики, физиологии или медицины, химии, литературы и экономики Нобелевской премией.
С жирными кислотами глицерин образует сложные эфиры (триглицериды). В природе глицерин встречается в виде триглицеридов в составе жиров.
Применение: Глицерин применяется для получения нитроглицерина и динамита. Его используют в парфюмерной промышленности в составе кремов, помад, зубных паст, где он выполняет функцию увлажнителя и смягчителя кожи, в кожевенном производстве для предотвращения высыхания кож, в производстве мыл, в текстильной промышленности для придания тканям эластичности и мягкости, в производстве некоторых смол и красителей.
Фенолы. Фенол
Получение, строение и физические свойства:
Фенол впервые был выделен из продуктов перегонки каменного угля (XIX в). Поскольку он был производным бензола (в то время бензол называли "фен"ом) и обладал кислотными свойствами его назвали "фениловой кислотой". Однако позже Ф. Жерар предложил называть его "фенол"ом.
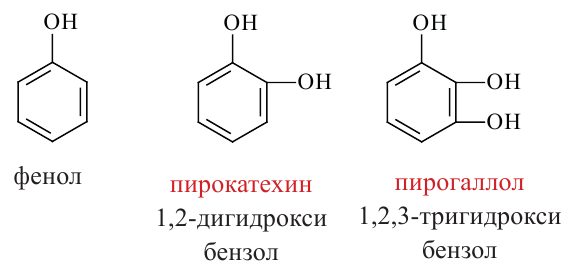
Фенол (C6H5-OH) - простейший представитель фенолов.
Фенолы - это производные ароматических углеводородов, в молекулах которых одна или несколько -ОН групп непосредственно связаны с атомами углерода бензольного кольца.
По числу -ОН групп различают одноатомные и многоатомные фенолы:
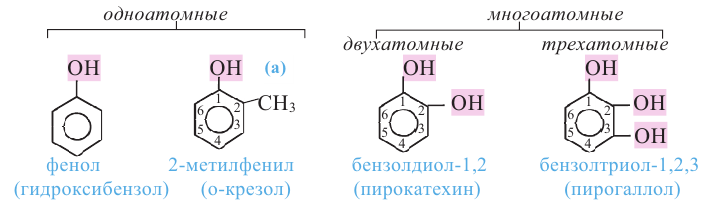
Орто-, мета- и пара-крезолы (2- 3- и 4-метилфенолы) также относятся к фенолам (а).
В фенолах нумерацию атомов углерода кольца начинают с углерода, связанного с -ОН группой, и продолжают в направлении ближайшего заместителя.
Среди фенолов наибольшее практическое значение имеет простейший из них - фенол (С6Н5ОН).
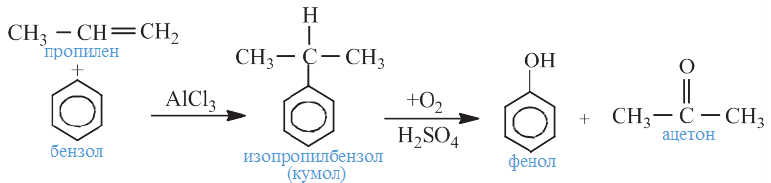
Получение: В промышленности фенол получают, в основном, 3-мя способами:
1) каталитическим окислением изопропилбензола ("кумольный способ"):
2) перегонкой каменноугольной смолы - продукта пиролиза каменного угля;
3) взаимодействием хлорбензола с гидроксидом натрия:
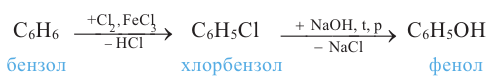
Физические свойства. Фенол - бесцветное, кристаллическое вещество с характерным запахом  В холодной воде он малорастворим, но при 70°С и выше растворяется в любых соотношениях. Он ядовит и на коже образует трудно заживающие раны.
В холодной воде он малорастворим, но при 70°С и выше растворяется в любых соотношениях. Он ядовит и на коже образует трудно заживающие раны.

Примечание. Из-за сильной полярности О-Н связи молекулы фенола образуют между собой сильные водородные связи. Поэтому фенол кипит при высокой температуре (182°С).
Синтезировал алкилфенолы, соли алкилфенолов и др. органические соединения, используемые в качестве присадок к смазочным, моторным и др. маслам, с целью улучшения их эксплуатационных свойств.
Строение молекулы: В молекуле фенола  электронная система бензольного кольца притягивает неподеленную электронную пару атома кислорода, уменьшая электронную плотность на нем. В результате атом кислорода еще сильнее притягивает электронную плотность О-Н связи к себе.
электронная система бензольного кольца притягивает неподеленную электронную пару атома кислорода, уменьшая электронную плотность на нем. В результате атом кислорода еще сильнее притягивает электронную плотность О-Н связи к себе.
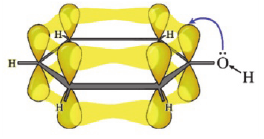
Эти смещения электронной плотности обуславливают следующие химические свойства фенола:
- в водном растворе отщепление водорода -ОН группы в виде протона облегчается (по сравнению с предельными спиртами) и фенол проявляет слабые кислотные свойства. По этой причине его водный раствор называют карболовой кислотой;
- атомы водорода, связанные с атомами углерода, расположенными в положениях 2,4,6-бензольного кольца, легче замещаются на атомы брома или нитрогруппы, чем атомы водорода в самом бензоле.
Химические свойства и применение:
Изделия из фенолформальдегидной смолы из-за их высокой механической прочности, электроизоляционных свойств и устойчивости к действию химических веществ широко используются в промышленности, быту, медицине и др. областях.
Химические свойства фенола обусловлены присутствием в его молекуле бензольного кольца и -ОН группы.
Химические свойства: Реакции гидроксильной группы. Фенол реагирует с металлическим натрием и калием. При этом образуются металлические производные фенола - феноляты:
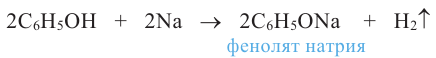
Фенол проявляет слабые кислотные свойства. Поэтому, в отличие от одноатомных предельных спиртов, он реагирует с растворами щелочей:
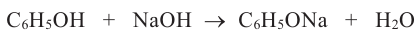
Поскольку фенол более слабая кислота, чем угольная, то последняя вытесняет фенол из его солей - фенолятов:
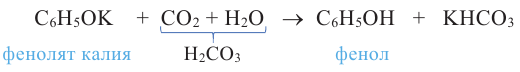
Реакции бензольного кольца. Из-за влияния -ОН группы на бензольное кольцо фенол, в отличие от бензола, без нагревания вступает в реакцию замещения с бромной водой (ур. а) и азотной кислотой (ур. b). По реакции а образуется 2,4,6-трибромфенол, а по реакции b - 2,4,6-тринитрофенол:
Влияние гидроксильной группы на бензольное кольцо проявляется и в реакции взаимодействия фенола с формальдегидом. Так, если бензол не реагирует с формальдегидом, то фенол при комнатной температуре вступает с формальдегидом в реакцию поликонденсации, образуя фенолформальдегидную смолу:
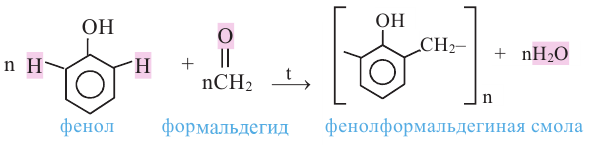
В 1872 году немецкий химик А.Байер реакцией фенола с формальдегидом получил смолообразный продукт. Впоследствии голландский ученый Л.Бакеланд разработал промышленный способ получения этого вещества. С 1912 года фенолформальдегидная смола производится под названием бакелит.
Пример №13
Завершите схемы и назовите вещества X и Y.

Решение:

Применение: Фенол широко применяется для производства красителей, лекарств, взрывчатых веществ (пикратов -солей пикриновой кислоты), фенолформальдегидных пластмасс.
Фенопласты, благодаря их хорошим механическим и электроизоляционным свойствам, а также химической инертности, применяются для изготовления ступенек эскалаторов метрополитенов, тормозных колодок вагонов. Кроме того, из них изготавливают корпуса электрических счетчиков, утюгов и двигателей, телефонов и фотоаппаратов, ручек кухонной утвари (ножей, кастрюль, газовых плит и др.), а также шахматные фигуры, камни шашек, домино и др.
Антисептические свойства растворов фенола ранее использовались для дезинфекции.
Определяют фенол по образованию фиолетовой окраски при действии па его раствор раствором FeCl3:
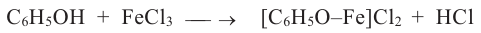
Влияние фенола и его производных на окружающую среду:
Фенол - ядовитое вещество; он повреждает центральную нервную и сердечно-сосудистую системы человека, почки. Фенол оказывает вредное влияние на животных и растения.
Фенол и его производные широко используются в промышленности и быту. Они также являются многотоннажными продуктами химической и нефтехимической промышленности. Поэтому фенол и его производные в составе промышленных и бытовых сточных вод загрязняют грунтовые воды, почву и атмосферу.
Из сточных вод, содержащих большие количества фенола, фенол удаляется в основном окислением. Для этих целей в качестве окислителей используют оксид хлора(IV), кислород воздуха, оксид марганца(IV), электрический ток и др.
Окисление фенола оксидом марганца(IV) описывается уравнением:
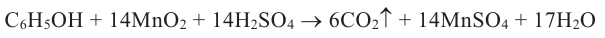
Из сильнозагрязненных сточных вод фенол удаляют и посредством адсорбентов, например,активированного угля.
Выводы:
- Спирты и фенолы - гидроксилсодержащие органические соединения.
- В первичных спиртах атом углерода, связанный с -ОН группой, соединен только с одним атомом углерода, во вторичных спиртах - с двумя, а в третичных спиртах - с тремя атомами углерода.
- Окончание "ол" в названии вещества указывает на присутствие в его составе -ОН группы.
- Число -ОН групп в молекуле спиртов и фенолов определяет их атомность.
- В предельных одноатомных спиртах структурная изомерия обусловлена изомерией углеродной цепи и положением -ОН группы в цепи.
- Предельные одноатомные спирты с диалкилсодержащими простыми эфира-ми образуют межклассовую изомерию (кроме метанола).
- Этанол в промышленности получают каталитической гидратацией этилена, а также из глюкозы или из сахаристых веществ, содержащих остатки глюкозы.
- Метанол, в основном, получают из синтез-газа.
- Наличие межмолекулярной водородной связи в спиртах - причина того, что первые представители спиртов при обычных условиях не являются газами.
- Из-за наличия водородной связи между молекулами спирта и воды, первые три представителя спиртов с водой смешиваются в любых соотношениях.
- Аллиловый спирт - непредельный, бензиловый спирт-ароматический спирт.
- Спирты и их водные растворы не изменяют цвет индикаторов.
- Металлические производные спиртов называются алкоголятами. Они подвергаются гидролизу.
- Спирты подвергаются внутримолекулярной (кроме метанола) и межмолекулярной дегидратации.
- Спирты вступают в реакцию этерификации.
- При окислении первичных спиртов образуются альдегиды, а вторичных спиртов - кетоны.
- Этиленгликоль - двухатомный, глицерин - трехатомный спирт.
- Предельные одноатомные спирты от двухатомных спиртов можно отличить с помощью гидроксида меди(II).
- При межмолекулярной дегидратации спиртов образуются простые эфиры.
- Простые эфиры в химическом отношении малоактивны.
- Полярность О-Н связи в феноле больше, чем в спиртах.
- Фенол, в отличие от предельных одноатомных спиртов, реагирует с щелочами.
- Фенол, по сравнению с бензолом, легче вступает в реакцию замещения с бромом и азотной кислотой.
- Фенол можно определить хлоридом железа(III).
- Метанол, этиленгликоль и фенол - очень ядовитые соединения.
Альдегиды
В 1782 году известный шведский ученый-химик К. Шееле, окисляя этиловый спирт, получил наряду с уксусной кислотой, вещество с резким запахом. В 1825 году немецкий ученый Ю. Либих выделил из смеси продуктов окисления этанола вещество состава С2Н4О, который содержал на 2 атома водорода меньше, чем в исходном спирте. Поэтому он назвал это вещество Alkohol dehydrogenatus- "спирт, потерявший водород", или кратко "альдегид".
Альдегиды относятся к широко распространенной группе душистых веществ. Сегодня невозможно найти природное душистое вещество, не содержащее альдегиды. Поэтому, открытие альдегидов сыграло большую роль в развитии производства душистых веществ.
В настоящее время первый представитель гомологического ряда альдегидов - формальдегид - широко применяется в производстве пластмасс и медицинских препаратов, красителей, а также для уничтожения насекомых.
Слово альдегид составлено из слов "алкоголь" и "дегидрирование".
Альдегиды, также как и спирты и фенолы, относятся к кислородсодержащим органическим соединениям.
Функциональной группой альдегидов является альдегидная группа:
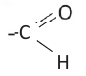 или
или 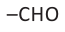
Альдегиды - органические соединения, в молекулах которых альдегидная группа соединена с углеводородным радикалом.
Только в муравьином альдегиде альдегидная группа соединена не с углеводородным радикалом, а с атомом водорода:

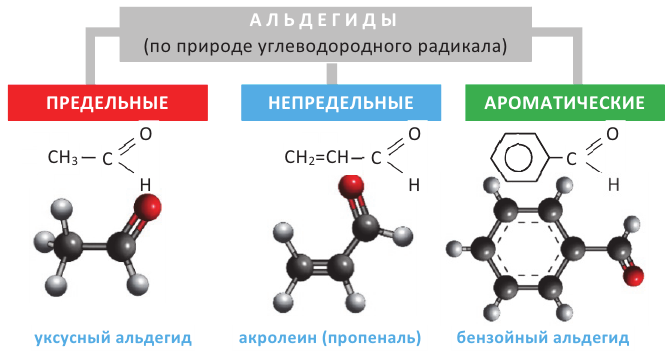
Группу >С=0 называют карбонильной группой.
Карбонильная группа является функциональной группой кетонов.
Кетоны - органические соединения, в молекулах которых два углеводородных радикала соединены с карбонильной группой. Например:

Альдегиды
Номенклатура и изомерия:
Вам известно, почему метанол называют древесным спиртом, а этанол - винным спиртом. Первые два представителя альдегидов же называются муравьиным и уксусным альдегидом.
Формулы предельных альдегидов составляют путем замены одного атома водорода в формуле соответствующего алкана на альдегидную группу:

Общую формулу альдегидов выражают в виде CnH2n+1CHO  или СnH2nО
или СnH2nО  (В первой формуле "n" обозначает число атомов углерода в радикале R, а во второй - в молекуле в целом).
(В первой формуле "n" обозначает число атомов углерода в радикале R, а во второй - в молекуле в целом).
Номенклатура. Согласно Международной номенклатуре, названия альдегидов неразветвленного строения образуют из названия алкана, соответствующего самой длинной углеродной цепи, содержащей атом углерода альдегидной группы, с добавлением окончания "аль":
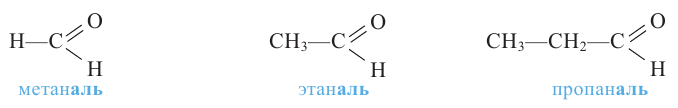
Для названия альдегидов разветвленного строения выбирается главная углеродная цепь, включающая в себя и атом углерода альдегидной группы. Главная углеродная цепь нумеруется, начиная с атома углерода - СНО группы. В названии альдегида указывают номер углерода, несущего радикал, название радикала и добавляют окончание "аль" к названию алкана, соответствующего основной углеродной цепи.
Пример №14
Назовите альдегиды а и b по Международной номенклатуре.

Решение:

По рациональной номенклатуре альдегиды называют как производные уксусного альдегида; например, вышеприведенный 2-метилпропаналь называется как диметилуксусный альдегид. Однако, этот способ применяется редко.
Тривиальные названия альдегидов производят от тривиальных названий карбоновых кислот, в которые они превращаются при окислении, например, муравьиный альдегид, уксусный альдегид, пропионовый альдегид и др.
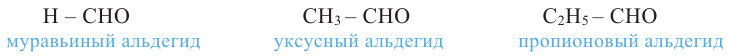
Изомерия: Внутриклассовая структурная изомерия альдегидов обусловлена строением углеродной цепи, к которой присоединена альдегидная группа, и начинается с четвертого представителя гомологического ряда:

Предельные альдегиды и кетоны с одинаковым числом атомов углерода образуют межклассовую изомерию:
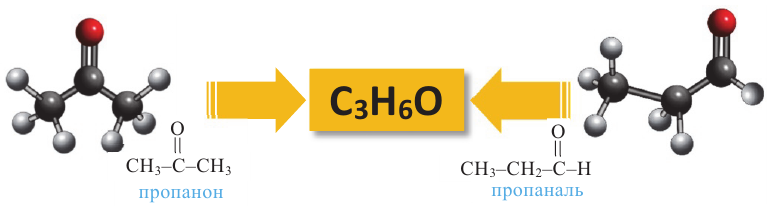
У альдегидов оптическая изомерия начинается с 2-метилбутаналя. В ее молекуле третичный атом углерода связан с четырьмя разными атомами и атомными группами (-Н, -СН3, -СНО, -С2Н5), в результате чего она существует в виде двух оптических изомеров:
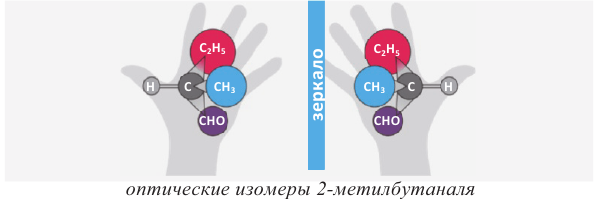
Названия кетонов по Международной номенклатуре образуют из названия алкана, соответствующего самой длинной углеродной цепи, содержащей атом углерода С=O группы, с добавлением окончания "-он":

Начиная с кетона состава С5Н10О указывают и номер атома углерода, связанного с атомом кислорода. Нумерация цепи начинается с того конца, к которому ближе 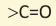 группа:
группа:
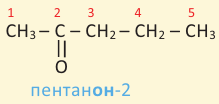
По рациональной номенклатуре к названиям радикалов, связанных  группой, добавляют слово "кетон"; при этом название меньшего радикала указывают вначале:
группой, добавляют слово "кетон"; при этом название меньшего радикала указывают вначале:
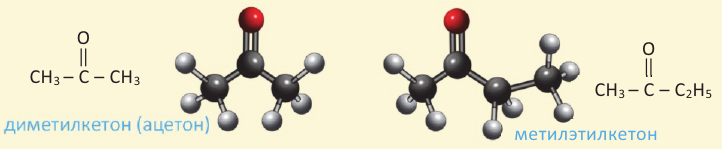
В кетонах межклассовая изомерия начинается с первого представителя гомологического ряда, а внутриклассовая - с третьего (С5Н10О).
Получение, строение и физические свойства:
Для консервации анатомических препаратов, а также для обработки хирургических инструментов, с целью их дезинфекции, используют формалин.
Альдегиды получают следующими способами.
1. Окисление или дегидрирование первичных спиртов. Альдегиды можно получить окислением первичных спиртов:
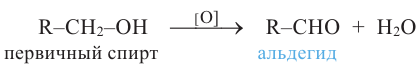
Например, при пропускании воздуха и паров этанола над раскаленной медной сеткой, покрытой пленкой оксида меди (II), образуется ацетальдегид:
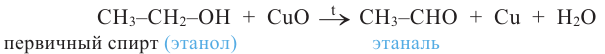
В промышленности каталитическим окислением метанола кислородом воздуха получают формальдегид:
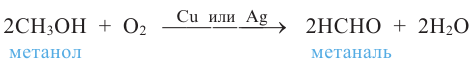
При пропускании паров первичных спиртов над катализатором (Сu, Ag или Pt) при 200-300°С спирты дегидрируются с образованием альдегидов:
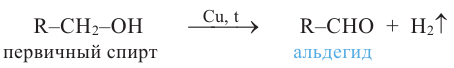
При окислении одноатомных вторичных спиртов R1CH(OH)R2 образуются кетоны:
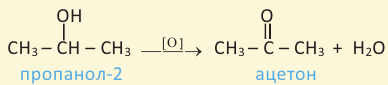
2. Окисление углеводородов. В промышленности каталитическим окислением метана кислородом воздуха получают формальдегид:
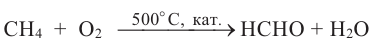
Для предотвращения окисления формальдегида в муравьиную кислоту смесь метана и воздуха пропускают через реакционную зону с большой скоростью.
Каталитическим окислением этилена получают ацетальдегид:
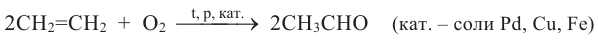
3. Гидратация ацетилена. В промышленности ацетальдегид получают также каталитической гидратацией ацетилена по реакции Кучерова:
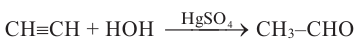
При гидратации гомологов ацетилена образуются кетоны:
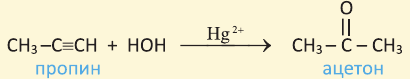
В промышленности ацетон получают сухой перегонкой древесины, окислением изопропилбензола и пропанола-2.
Строение: Электронное строение альдегидов на примере молекулы формальдегида приведено ниже:
Электронное строение молекулы формальдегида (а) и образование 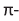 связи (b).
связи (b).
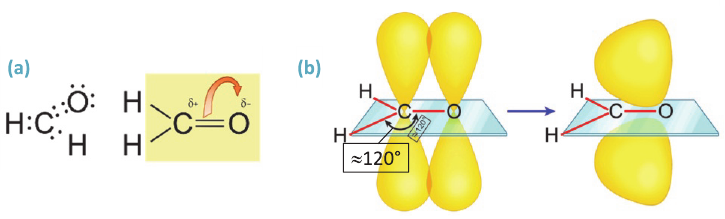
В альдегидной группе атом углерода находится в состоянии sp2-гибридизации. Три  связи атома углерода, направленные под углом 120° относительно друг друга, расположены в одной плоскости (а). По этой причине молекула формальдегида имеет плоское строение, р-орбиталь атома углерода, не участвующего в гибридизации путем бокового перекрывания с р-орбиталью атома кислорода, образует
связи атома углерода, направленные под углом 120° относительно друг друга, расположены в одной плоскости (а). По этой причине молекула формальдегида имеет плоское строение, р-орбиталь атома углерода, не участвующего в гибридизации путем бокового перекрывания с р-орбиталью атома кислорода, образует  связь между углеродом и кислородом. Из-за более высокой электроотрицательности атома кислорода более подвижное
связь между углеродом и кислородом. Из-за более высокой электроотрицательности атома кислорода более подвижное 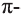 электронное облако двойной С=0 связи смещается от атома углерода в сторону атома кислорода. В результате на атоме кислорода появляется частичный отрицательный заряд
электронное облако двойной С=0 связи смещается от атома углерода в сторону атома кислорода. В результате на атоме кислорода появляется частичный отрицательный заряд 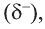 а на атоме углерода - положительный
а на атоме углерода - положительный 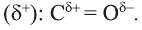
Поляризация С=0 связи наглядно видна на карте электронной плотности молекулы формальдегида: частичный отрицательный заряд (красная область) располагается вокруг атома кислорода, а частичный положительный (синяя область) - вокруг атома углерода.
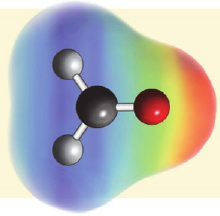
Примечание. На карте электронной плотности двойную С=0 связь указывают одним стержнем.
Поляризация 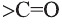 связи в альдегидах проявляется в их физических и химических свойствах.
связи в альдегидах проявляется в их физических и химических свойствах.
Физические свойства: Из-за отсутствия в составе альдегидов -ОН группы их молекулы не образуют между собой водородные связи. Поэтому температура кипения альдегидов ниже температуры кипения спиртов и карбоновых кислот с тем же числом атомов углерода в молекуле.
Первый представитель гомологического ряда альдегидов - формальдегид -газообразное вещество, следующие - жидкости, а высшие - твердые вещества.
Формальдегид и ацетальдегид хорошо растворяются в воде. С ростом молекулярной массы растворимость альдегидов в воде уменьшается; бутаналь в воде практически не растворим.
Запах альдегидов различный. Например, формальдегид имеет неприятный запах; у высших альдегидов приятный запах, поэтому они широко используются в парфюмерии.
Разработал способы получения новых представителей альдегидов, кетонов и спиртов, пригодных для применения в качестве синтетических душистых веществ.
Формальдегид - бесцветный газ с резким запахом, очень ядовит; его 40%-ный водный раствор называют формалином.
Ацетальдегид - легколетучая 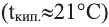 бесцветная жидкость с резким запахом; ядовита.
бесцветная жидкость с резким запахом; ядовита.
Ацетон - бесцветная, горючая жидкость с характерным запахом. Он в воде хорошо растворим; кипит при температуре 56°С. Хорошо растворяет жиры, смолы и другие вещества; поэтому является одним из наиболее широко применяемых растворителей.
Химические свойства и применение:
Мебельные гарнитуры, изготовленные из прессованных древесных опилок и фенолформальдегидной смолы, обычно содержат до 0,01% формальдегида. Формальдегид, постепенно испаряющийся с поверхности этой мебели, представляет определенную опасность для человека.
Химические свойства: Альдегиды из-за наличия в их молекулах полярной С=O связи являются реакционноспособными веществами. Для них характерны реакции окисления и присоединения.
I. Реакции окисления. Альдегиды при нагревании с раствором оксида се-ребра (I) в аммиачной воде 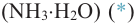 окисляются в соответствующие карбоновые кислоты. При этом ионы
окисляются в соответствующие карбоновые кислоты. При этом ионы 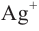 восстанавливаются до металла, который в виде блестящего слоя осаждается на стенках пробирки (а), например:
восстанавливаются до металла, который в виде блестящего слоя осаждается на стенках пробирки (а), например:
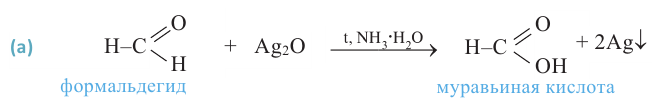
Эта реакция называется реакцией "серебряного зеркала" и используется для определения альдегидов (качественная реакция альдегидов).
* - из-за нерастворимости Ag2O в воде обычно используют раствор оксида серебра (I) в аммиачной воде (реактив Толленса).
Примечание: Поскольку в реакции "серебряного зеркала" аммичная вода берется в избытке, то карбоновая кислота образуется в виде аммонийной соли.
Альдегиды окисляются также и под действием свежеосажденного гидроксида меди (II). При этом вначале образуется желтый осадок гидроксида меди (I), который при слабом нагревании разлагается до оксида меди (I) красного цвета (b):
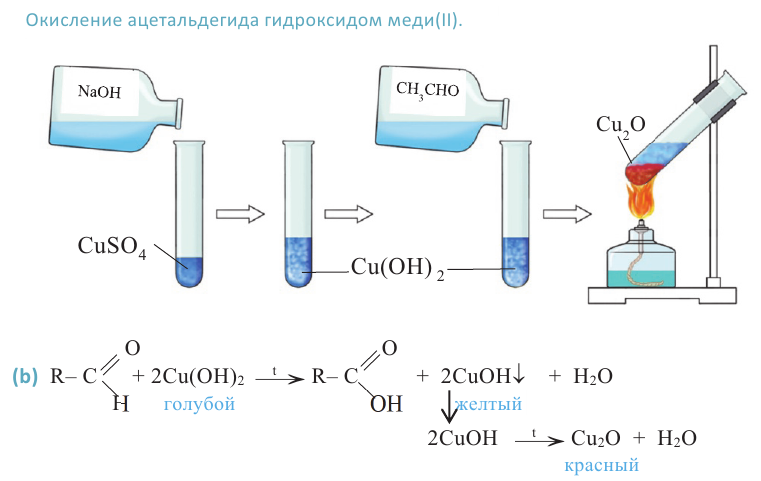
Эта реакция также является характерной реакцией альдегидов и применяется для их определения (качественная реакция альдегидов).
Общее уравнение горения альдегидов и кетонов (СnН2nО) выражают следующим образом:
Альдегиды окисляются даже кислородом воздуха. Поэтому при длительном хранении альдегиды держат в запаянной посуде в атмосфере азота.
В отличие от альдегидов, кетоны не окисляются ни гидроксидом меди (II), ни по реакции "серебряного зеркала ".
II. Реакции присоединения. Реакции присоединения к альдегидам и кетонам происходят в результате разрыва  связи в карбонильной группе.
связи в карбонильной группе.
При гидрировании альдегидов образуются первичные спирты, а кетонов - вторичные спирты.
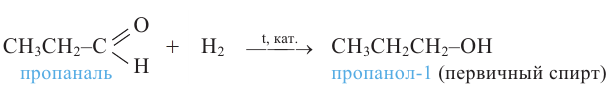
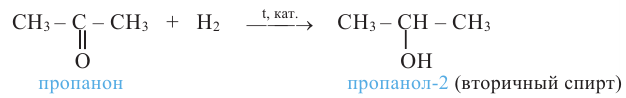
Пример №15
На основе схемы реакций назовите альдегид по Международной номенклатуре.

Решение:

Согласно условию: 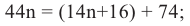 отсюда n = 3.
отсюда n = 3.
Значит, формула альдегида - СН3СН2СНО, а название - пропаналь.
Альдегиды присоединяют вещества с полярными молекулами типа Н-Х, например, воду, аммиак и др. При этом атом водорода полярной молекулы присоединяется к атому кислорода, а остальная часть к атому углерода 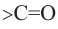 группы:
группы:
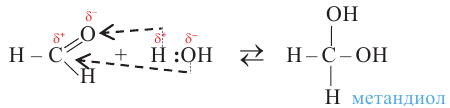
Формальдегид с аммиаком образует уротропин (гексаметилентетраамин) циклического строения:
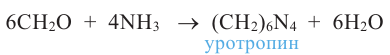
Уротропин используется в медицине в составе ряда лекарств; под названием "сухой спирт" он иногда применяется как топливо в химической лаборатории.
III. Реакции полимеризации и поликонденсации. Первые представители альдегидов легко вступают в реакции полимеризации; например, формальдегид полимеризуется, образуя полиформальдегид неразветвленного строения:
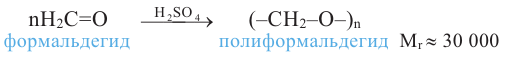
Изделия из полиформальдегида из-за их твердости заменяют изделия из металла.
При n = 8 - 100 полиформальдегид называют параформальдегидом или параформом. При нагревании параформ деполимеризуется, заново образуя формальдегид.
Формальдегид образует также и тример - триоксиметилен, твердое вещество. Триоксиметилен выпускают в виде таблеток под названием "сухой спирт". Туристы и альпинисты используют его как топливо при приготовлении пищи. С этой же целью используется и тетрамер ацетальдегида - метальдегид.
Поликонденсацией формальдегида с фенолом получают фенолформальдегидную смолу, имеющую важное практическое значение:
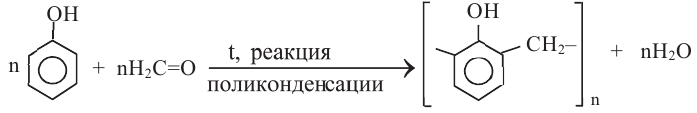
Ацетальдегид - продукт окисления этанола в организме.
Когда человек употребляет пиво, вино или любой другой алкогольный напиток, этанол, накапливаясь в печени, подвергается метаболизму. На 1-й стадии метаболизма этанол под действием фермента алкогольдегидрогеназы окисляется в ядовитый ацетальдегид. На второй стадии ацетальдегид под влиянием фермента альдегиддегидрогеназы превращается в уксусную кислоту. Если алкоголь употреблять часто и в больших количествах, то печень оказывается не в состоянии полностью обезвреживать образующийся ацетальдегид, в результате чего организм отравляется, а человек со временем серьезно заболевает.
Применение: Формальдегид используется в производстве полиформальдегида, фенолформальдегидных, карбамидформальдегидных и др. смол, а также красителей, лекарств (уротропин) и взрывчатых (гексоген) веществ.
Формалин используют для дубления кож, хранения биопрепаратов, дезинфекции зданий и хирургических инструментов, протравливания семян перед посевом.
Из уксусного альдегида получают главным образом уксусную кислоту, трихлоруксусный альдегид (хлораль ССl3СНО), пластмассы, лекарства.
Как растворитель ацетон используют в производстве лаков, искусственного шелка, бездымного пороха, кинопленки и др., а также как сырье в синтезе многих органических веществ (хлороформа, йодоформа и др.).
Из-за приятного запаха кетоны с относительно большими молекулами (например, дифенилкетон С6Н5СОС6Н5) применяются во многих парфюмерных композициях, а также для ароматизации мыл.
Выводы:
- Альдегиды и кетоны - карбонилсодержащие органические соединения.
- В названии вещества окончание "аль" указывает на принадлежность его к альдегидам, а окончание "-он" - кетонам.
- В предельных альдегидах внутриклассовая структурная изомерия обусловлена только строением углеродной цепи.
- Предельные альдегиды образуют межклассовую изомерию с кетонами.
- Альдегиды образуются при окислении первичных спиртов.
- В промышленности формальдегид получают каталитическим окислением метана.
- В промышленности ацетальдегид получают каталитическим окислением этилена и каталитической гидратацией ацетилена.
- Из альдегидов только молекула формальдегида имеет плоское строение.
- Альдегиды и кетоны - полярные вещества, поэтому первые представители их гомологического ряда в воде хорошо растворяются.
- Формальдегид - бесцветный ядовитый газ с резким запахом.
- Ацетальдегид - бесцветная легколетучая ядовитая жидкость с резким запахом.
- 40%-ный водный раствор формальдегида называют формалином.
- Акролеин - непредельный, а бензойный альдегид - ароматический альдегид.
- Молекулы альдегидов не образуют между собой водородной связи.
- Альдегиды вступают в реакции окисления и присоединения.
- Взаимодействие альдегидов с раствором оксида серебра (I) в аммиачной воде называют реакцией "серебряного зеркала".
- Реакцию "серебряного зеркала" и взаимодействие альдегидов со свежеосажденным гидроксидом меди (II) используют для определения альдегидов.
- При длительном хранении жидкие альдегиды окисляются кислородом воздуха.
- При восстановлении предельных альдегидов водородом образуются первичные спирты.
- Альдегиды присоединяют вещества с полярными молекулами (воду, аммиак и др.).
- Параформ образуется в результате полимеризации формальдегида.
- Поликонденсацией формальдегида с фенолом получают фенолформальдегидную смолу.
- Формалин используют для дубления кож, хранения биопрепаратов, дезинфекции зданий и хирургических инструментов.
- Кетоны не вступают в реакцию"серебряного зеркала" и не взаимодействуют со свежеосажденным гидроксидом меди (II).
Карбоновые кислоты и их производные
Слово"карбоксил" образовано из названий двух групп - карбонильной и гидроксильной.
Карбоновые кислоты, также как спирты и альдегиды, относятся к кислородсодержащим органическим соединениям. В карбоновых кислотах функциональной группой является карбоксильная группа:
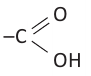 или
или 
Карбоновые кислоты - это органические соединения, в молекулах которых углеводородный радикал соединен с одной или несколькими карбоксильными группами.
Среди карбоновых кислот только в муравьиной кислоте карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода:
Карбоновые кислоты классифицируют по природе углеводородного радикала и числу карбоксильных групп:
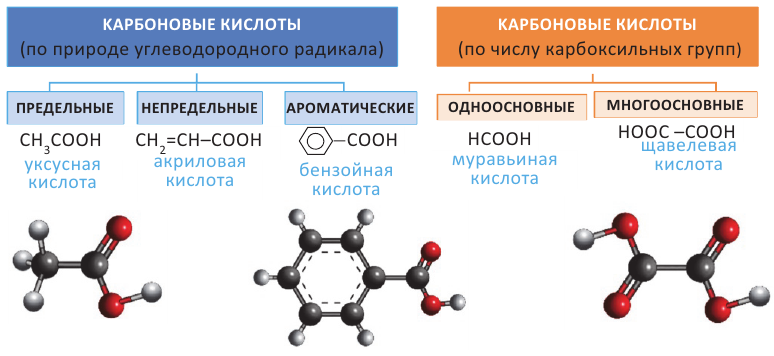
Одноосновные карбоновые кислоты
Номенклатура и изомерия:
Карбоновые кислоты широко распространены в природе. В состав коровьего масла входит остаток масляной кислоты, в состав лимона -лимонная кислота, а в состав козьего масла - остаток капроновой кислоты ("карrо-означает коза").
Состав предельных одноосновных карбоновых кислот выражают общей формулой CnH2n+1COOH 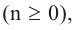 CnH2nO2
CnH2nO2 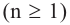 или RCOOH. (В первой формуле "n" обозначает число атомов углерода в радикале R, а во второй формуле - в молекуле в целом).
или RCOOH. (В первой формуле "n" обозначает число атомов углерода в радикале R, а во второй формуле - в молекуле в целом).
Пример №16
Выразите молярную массу предельной одноосновной карбоновой кислоты (X) молярной массой алкена (m), в молекуле которого содержится столько же атомов углерода.
Решение:
Выразим молярные массы кислоты и алкена посредством числа атомов углерода - 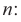
Молярная масса алкена (г/моль):
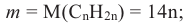
Молярная масса кислоты (г/моль):
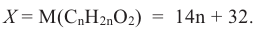
В выражении молярной массы кислоты 14n заменим на
Номенклатура: По Международной номенклатуре названия карбоновых кислот неразветвленного строения образуют из названия алкана, соответствующего углеродной цепи, содержащей атом углерода -СООН группы с добавлением окончания -овая и слова кислота (табл.).
Предельные одноосновные карбоновые кислоты и их названия
| Карбоновые кислоты | Название по Международной номенклатуре | Тривиальные названия | |
| HCOOH | H-COOH | Метановая кислота | Муравьиная кислота |
| СН3СООН | СНз-СООН | Этановая кислота | Уксусная кислота |
| С2Н5СООН |
CH3-CH2-COOH | Пропановая кислота | Пропионовая кислота |
| С3Н7СООН |
СН3-(СН2)2-СООН | Бутановая кислота | Масляная кислота |
| С4Н9СООН | СН3-(СН2)3-СООН | Пентановая кислота | Валериановая кислота |
| C5H11COOH | СН3-(СН2)4-СООН | Гексановая кислота | Капроновая кислота |
| С6H13СООН | СН3-(СН2)5-СООН | Гептановая кислота | Энантовая кислота |
| С15Н13СООH | СН3-(СН2)14-СООН | Гексадекановая кислота | Пальмитиновая кислота |
| С16Н13СООH | СН3-(СН2)15-СООН | Гептадекановая кислота | Маргариновая кислота |
| С17Н35СООH | СН3-(СН2)16-СООН | Октадекановая кислота | Стеариновая кислота |
Примечание: Названия пропионовой и стеариновой кислот происходят от греческих слое, остальные названия - от латинских.
Если радикал, связанный с карбоксильной группой, имеет разветвленное строение, то выбирают главную углеродную цепь, включающую атом углерода карбоксильной группы. Атомы углерода главной цепи нумеруются, начиная с атома углерода -СООН группы. В названии кислоты указывают номер углерода, несущего радикал, называют радикал, затем алкан, соответствующий главной цепи, и добавляют окончание -овая и слово кислота:

Изомерия: Поскольку нумерация атомов углерода главной цепи начинается с атома углерода -СООН группы, то у карбоновых кислот внутриклассовая структурная изомерия обусловлена только строением углеродной цепи, например:
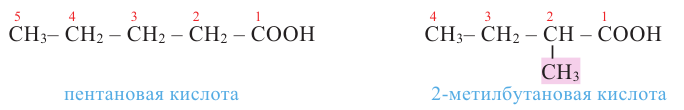
Предельные карбоновые кислоты образуют межклассовую изомерию со сложными эфирами, содержащими алкильные радикалы. В сложных эфирах муравьиной кислоты вместо одного из радикалов содержится атом Н, например:
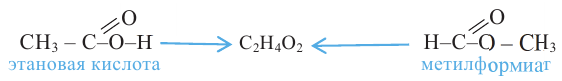
У предельных одноосновных карболовых кислот оптическая изомерия начинается с 2-метилбутановой кислоты. В ее молекуле третичный атом углерода связан с четырьмя различными атомами и группами атомов (-Н, -СН3, -С2Н5, -СООН). Поэтому она существует в виде двух оптических изомеров:
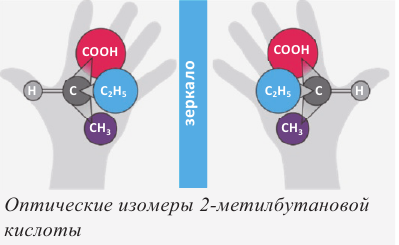
Получение:
Уксусная кислота - первая карбоновая кислота, полученная и использованная в виде "уксуса" еще 4 тысячи лет тому назад в древнем Египте.
В лаборатории карболовые кислоты можно получить действием серной кислоты на соль соответствующей кислоты:
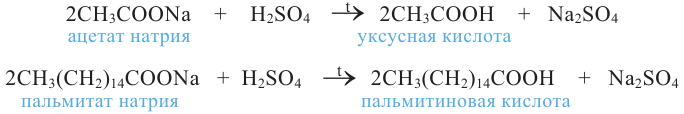
В настоящее время в промышленности карбоновые кислоты получают окислением первичных спиртов, альдегидов и алканов:
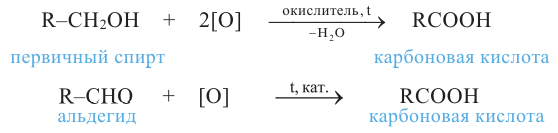
Например, масляную кислоту получают окислением бутилового спирта или масляного альдегида:
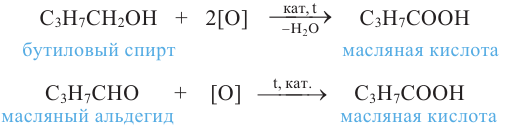
Каталитическим окислением алканов, содержащих в молекуле 28-36 атомов углерода, получают органические кислоты, содержащие 14-18 атомов углерода в молекуле, например:
Эти кислоты используются в производстве мыл.
Муравьиную и уксусную кислоты получают и другими способами.
Пример №17
При окислении 80 г альдегида было получено 92,8 г предельной одноосновной карбоновой кислоты. Определите молекулярную формулу кислоты.
Решение:
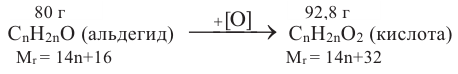
На основе схемы реакции можно сказать, что масса кислоты, образующейся при окислении 1 моль альдегида, на 16 г больше массы альдегида.
По условию задачи увеличение массы составляет 92,8 - 80 = 12,8 г. На этом основании составляем пропорцию и вычисляем молярную массу кислоты:
при образ. 92,8 г кислоты масса увелич. на 12,8 г
при образ. 1 моль (М) кислоты масса возрастет на 16
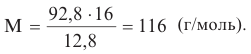
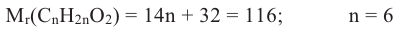
Значит, формула кислоты С5Н11СООН.
Строение и физические свойства:
Вследствие наличия межмолекулярных водородных связей уксусная кислота при температуре 16,6°С превращается в кристаллы, подобные кристаллам льда, а в парообразном состоянии существует в виде димерных молекул.
Электронное строение карбоксильной группы: Электронное строение карбоксильной группы и смещение электронной плотности в ней приведены на схемах a и b:

Из схемы b видно, что в карбоксильной группе частично положительно заряженный атом углерода карбонильной группы 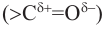 посредством С-O связи притягивает к себе электронную плотность О-Н связи. Это усиливает полярность О-Н связи по сравнению со спиртами и фенолом, в результате чего отщепление атома водорода в виде иона Н+ в водном растворе кислоты облегчается. По этой причине карбоновые кислоты (в особенности первые члены гомологического ряда) по сравнению со спиртами, водой и фенолом проявляют более сильные кислотные свойства.
посредством С-O связи притягивает к себе электронную плотность О-Н связи. Это усиливает полярность О-Н связи по сравнению со спиртами и фенолом, в результате чего отщепление атома водорода в виде иона Н+ в водном растворе кислоты облегчается. По этой причине карбоновые кислоты (в особенности первые члены гомологического ряда) по сравнению со спиртами, водой и фенолом проявляют более сильные кислотные свойства.
Поляризация в карбоксильной группе ясно видна на карте электронной плотности молекулы уксусной кислоты: частичный отрицательный заряд (красная область) расположен, главным образом, вокруг кислородного атома  группы, а частичный положительный заряд (синяя область) -вокруг водородного атома ОН группы.
группы, а частичный положительный заряд (синяя область) -вокруг водородного атома ОН группы.
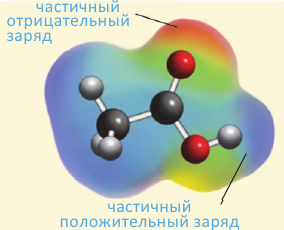
Примечание. На карте электронной плотности С=O связь изображают одним стержнем.
Полярность связей С=O, С-0 и О-Н в карбоксильной группе определяет физические и химические свойства карбоновых кислот.
Физические свойства: Первые 9 (НСООН - С8Н17СООН) представителей предельных одноосновных карбоновых кислот жидкости с резким запахом.
Молекулы карбоновых кислот так же, как и молекулы спиртов, образуют между собой водородные связи (с). В карбоновых кислотах эта связь прочнее; например, муравьиная и уксусная кислоты за счет водородной связи даже в парообразном состоянии находятся в виде димерных молекул d:

Поэтому карбоновые кислоты кипят при более высокой температуре, чем спирты, альдегиды, кетоны и эфиры, имеющие примерно такие же молекулярные массы, как и кислоты.
Карбоновые кислоты образуют водородные связи и с молекулами воды. Поэтому первые представители карбоновых кислот в воде хорошо растворимы.
Примечание: Карбоновые кислоты образуют водородные связи с водой как с участием атома кислорода карбонильной группы, так и атомов кислорода и водорода гидроксильной группы.
С ростом размера радикала R растворимость кислот в воде уменьшается. После нонановой (пеларгоновой) кислоты (СН3-(СН2)7-СООН) следующие карбоновые кислоты - это твердые вещества, нерастворимые в воде.
Как правило, кислоты с разветвленным строением кипят при более низкой температуре, чем кислоты с неразветвленным строением.
Химические свойства и применение:
Для удаления накипи в водонагревательных приборах, стиральных машинах часто применяют лимонную и уксусную кислоты.
Многие химические свойства карбоновых кислот обусловлены присутствием в их молекулах карбоксильной группы.
Химические свойства. Кислотные свойства: Карболовые кислоты слабые электролиты. В водных растворах они частично диссоциируют и поэтому окрашивают лакмус в красный цвет:
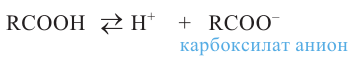
В ряду предельных одноосновных карбоновых кислот муравьиная кислота является самой сильной. Далее, с ростом молярной массы кислот, кислотные свойства уменьшаются.
Кислотные свойства галогенопроизводных карбоновых кислот возрастают с ростом электроотрицательности галогена и числа его атомов в молекуле:
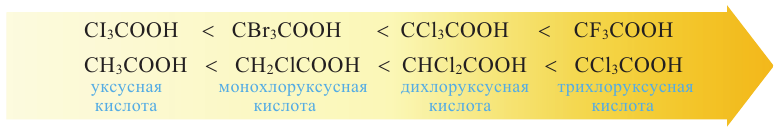
Пример №18
Почему метановая кислота самая сильная в ряду предельных одноосновных карбоновых кислот?
Объяснение: За исключением метановой кислоты (Н-СООН) во всех членах ряда карбоксильная группа связана с алкильным радикалом (R): R-COOH. Поскольку алкильный радикал имеет электронодонорные свойства, то он отталкивает электронную плотность связи 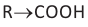 в направлении атома углерода, увеличивая тем самым электронную плотность на связи О-Н, по сравнению с метановой кислотой (схема а). В результате связь О-Н упрочняется и в водном растворе отщепление водорода в виде иона от молекулы RCOOH затрудняется:
в направлении атома углерода, увеличивая тем самым электронную плотность на связи О-Н, по сравнению с метановой кислотой (схема а). В результате связь О-Н упрочняется и в водном растворе отщепление водорода в виде иона от молекулы RCOOH затрудняется:
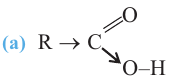
Углеводородный радикал (R) уменьшает кислотные свойства
Карбоновые кислоты взаимодействуют с активными металлами, щелочами, основными оксидами, с солями более слабых кислот и аммиаком:
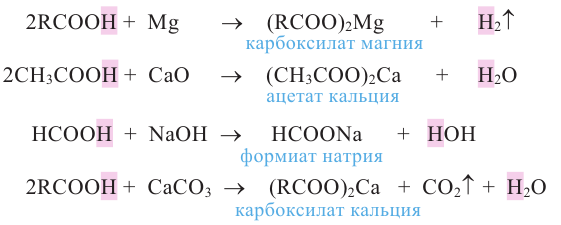
При действии дегидратирующих веществ карбоновые кислоты, за исключением муравьиной кислоты, превращаются в соответствующие ангидриды:
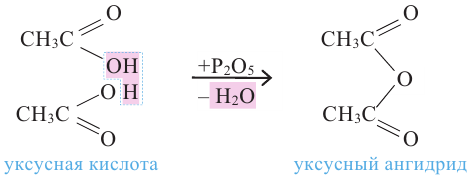
Реакции этерификации: Карбоновые кислоты в присутствии серной кислоты реагируют со спиртами, образуя сложные эфиры, например:
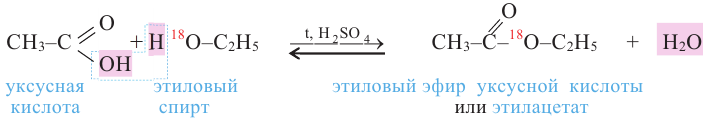
Такой тип реакций называют реакциями этерификации. Вода в реакции образуется из -ОН группы карбоновой кислоты и атома Н (-ОН) группы спирта.
Замещение атомов водорода в углеводородном радикале:
В карбоновых кислотах атомы водорода углеродного атома, связанного непосредственно с карбоксильной группой, легко замещаются атомами хлора или брома:
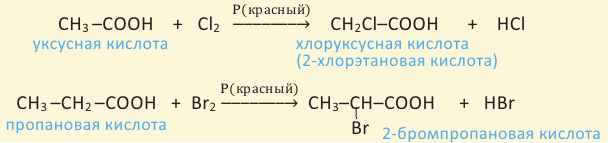
Муравьиную кислоту в промышленности получают каталитическим окислением метана:
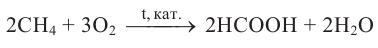
Ее получают также действием разбавленной серной кислоты на формиат натрия, полученный взаимодействием оксида углерода (II) с гидроксидом

Знаете ли вы... В природе муравьиная кислота встречается в выделениях муравьев, в крапиве и еловых иглах. Жжение кожи крапивой обусловлено действием содержащейся в ее соке муравьиной кислоты.
Муравьиная кислота - бесцветная жидкость с резким запахом, кипит при 101°С. С водой она смешивается в любых соотношениях. На коже образует ожоги. По ряду свойств муравьиная кислота отличается от других карбоновых кислот:
- В гомологическом ряду она самая сильная кислота; по степени диссоциации близка к ортофосфорной кислоте (кислотам средней силы).
- Муравьиная кислота и ее соли, в отличие от других карбоновых кислот, окисляются оксидом серебра (I) и гидроксидом меди (II):
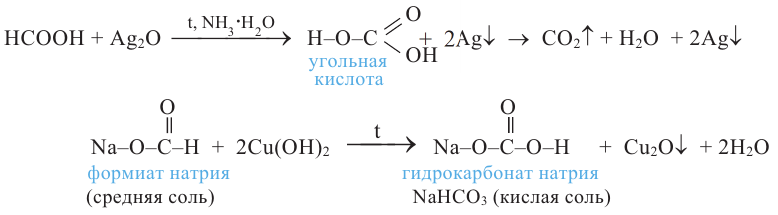
3. Разложением муравьиной кислоты в лаборатории получают монооксид углерода (II):
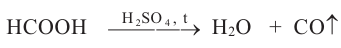
Применение: Муравьиная кислота применяется в качестве восстановителя при синтезе органических соединений, а также для получения щавелевой кислоты. Кроме того, она применяется в пищевой промышленности для консервирования и дезинфекции, при крашении тканей и бумаги, в медицине под названием муравьиный спирт для лечения ревматизма (муравьиный спирт -1,25%-ный спиртовой раствор муравьиной кислоты). Ее сложные эфиры используются в качестве растворителей и душистых веществ.
Уксусную кислоту получают несколькими способами; например, каталитическим окислением уксусного альдегида и бутана:
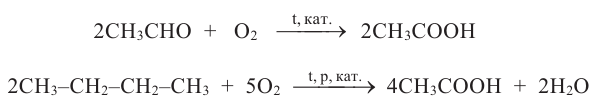
Второй способ экономически более выгодный.
Ее получают и окислением этанола в присутствии катализатора или бактерий:
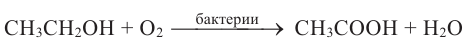
Уксусную кислоту получают также взаимодействием метанола с оксидом углерода (II) и из продуктов пиролиза древесины:
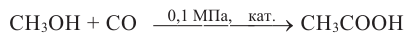
Уксусная кислота - бесцветная жидкость с резким запахом. Ниже +16,6°С она превращается в похожую на лед массу. Поэтому ее иногда называют "ледяной" уксусной кислотой. Смешивается с водой в любых соотношениях. Ее 3-5%-ный водный раствор называют уксусом ("столовый уксус"), а 70-80%-ный раствор -"уксусной эссенцией".
Применение: Уксусная кислота применяется в производстве пластмасс, красителей (индиго), лекарств (аспирин, фенацетин), ацетатного волокна, негорючей кино- и фотопленок, пропускающих ультрафиолетовые лучи стекол и др.
Соли уксусной кислоты применяются при крашении тканей, ацетат свинца (II) - в качестве белой краски. Ацетат меди (II) и некоторые производные уксусной кислоты, например, натриевая соль 2,4-дихлорфеноксиуксусной кислоты (b) применяются в сельском хозяйстве в качестве гербицидов в борьбе с сорняками.
Уксусная кислота применяется при консервировании овощей, а ее эфиры - в кондитерской промышленности и в производстве духов.
В быту под названием "столовый уксус" (с) она используется как приправа к пище.

Уксусную кислоту можно отличить по характерному запаху.
Предельные и непредельные высшие карбоновые кислоты:
Одни из веществ, которые составляют наш ежедневный рацион, - это жиры. Как вам известно из жиров подсолнечное, оливковое и др. масла - жидкие, сливочное, козье и др. масла -твердые вещества.

В молекулах высших карбоновых кислот, как правило, содержатся от 10-ти до 20-ти атомов углерода. Многие из них в виде сложных эфиров глицерина входят в состав жиров. Высшие карбоновые кислоты, образующие жиры, называют жирными кислотами.
Жирные кислоты подразделяются па предельные и непредельные. В молекуле непредельных жирных кислот содержится минимум одна двойная С=С связь.
Особенности жирных кислот:
- В неразветвленной цепи молекул жирных кислот содержится четное число, как правило от 10-ти до 20-ти атомов углерода.
- В природе (в виде триглицеридов) наиболее распространены пальмитиновая, стеариновая и олеиновая кислоты.
- Остатки непредельных жирных кислот в составе жиров встречаются, главным образом, в форме цис-изомера.
- Если не считать С=С связь в непредельных кислотах, то в молекулах жирных кислот, кроме карбоксильной группы, нет других функциональных групп.
- Температура плавления непредельных жирных кислот ниже, чем температура плавления предельных жирных кислот, содержащих столько же атомов углерода. С ростом числа С=С связей в молекулах жирных кислот температура их плавления уменьшается.
К предельным жирным кислотам относятся пальмитиновая (С15Н31СООН) и стериновая (С17Н35СООН) кислоты, а к непредельным - олеиновая (С17Н33СООН), линолевая (С17Н31СООН) и линоленовая (С17Н29СООН) кислоты. Пальмитиновая (гексадекановая) и стеариновая (октадекановая) кислоты.
(а) Шаро-стержневая модель молекулы пальмитиновой кислоты
Обе кислоты вступают в реакции, характерные для предельных карбоновых кислот, например:
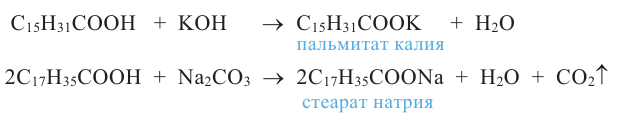
Соли пальмитиновой и стеариновой кислот называются, соответственно, папьмитатами и стеаратами. Их натриевые и калиевые соли являются основными компонентами мыл.
Смесь пальмитиновой и стеариновой кислот применяется для изготовления * стеариновых свеч.
Высшие карболовые кислоты получают гидролизом жиров (стр. 107) и каталитическим окислением парафинов (стр. 78).
Примечание. Кальциевые и магниевые соли высших карбоновых кислот в воде не растворимы.
Непредельные карбоновые кислоты:
Олеиновая кислота - непредельная одноосновная карбоновая кислота, содержащая в молекуле одну С=С связь:
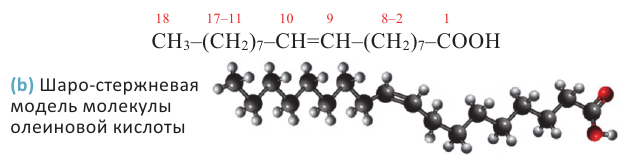
Олеиновая кислота относится к гомологическому ряду непредельных карбоновых кислот с общей формулой CnH2n-1COOH  Поскольку в их молекулах содержится карбоксильная группа и С=С связь, то они проявляют свойства как кислот, так и непредельных углеводородов.
Поскольку в их молекулах содержится карбоксильная группа и С=С связь, то они проявляют свойства как кислот, так и непредельных углеводородов.
Олеиновая кислота с основаниями образует соли, а со спиртами - сложные эфиры. Как непредельное соединение она вступает в реакции присоединения:
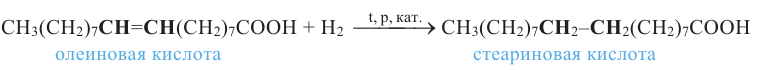
Олеиновая кислота является цис-изомером кислоты состава С17Н33СООН. Транс-изомер этой кислоты называют элаидииовой кислотой. В отличие от жидкой олеиновой кислоты, элаидиновая кислота при обычных условиях (20°С) - твердое вещество и в природе в составе жиров не встречается.
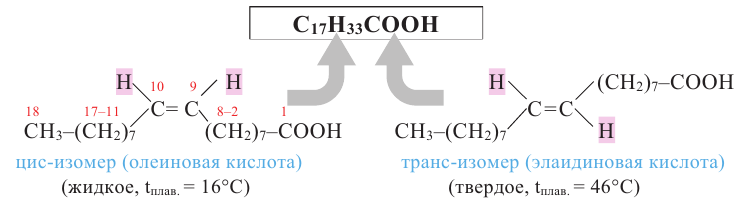
Молекулы линолевой (С17Н31ООН) и линоленовой (С17Н29СООН) кислот содержат, соответственно, две и три С=С связи. Обе кислоты, вместе с олеиновой кислотой, в виде сложных эфиров глицерина входят в состав растительных жиров - оливкового, подсолнечного, кукурузного и миндального масел.
Пример №19
Почему предельные жирные кислоты, имеющие строение (а), при комнатной температуре - твердые вещества, а непредельные кислоты, имеющие строение (b), - жидкости?
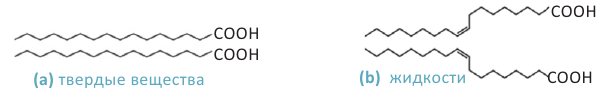
Решение:
Углеродные цепи соседних молекул предельных жирных кислот располагаются параллельно и плотнее друг к другу (а). Поэтому силы притяжения между такими молекулами большие, и чтобы их расплавить, требуется более высокая температура. Между цис-изомерами непредельных жирных кислот (b) силы притяжения действуют лишь между короткими сегментами цепи и по этой причине они слабые. Поэтому чтобы расплавить кислоты строения (b), требуется меньшая энергия (меньшая температура), и они при обычных условиях, в основном, - жидкости.
Первый представитель непредельных карбоновых кислот - акриловая (пропеновая) кислота СН2=СН-СООН. Ее полимеризацией получают полиакриловую кислоту.
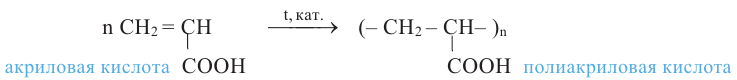
Присоединение полярных молекул типа НХ (HCl, НВr, НОН и др.) к акриловой кислоте происходит против правила Марковникова, например:
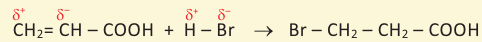
Двухосновные карбоновые кислоты
Молекулы двухосновных карбоновых кислот содержат две карбоксильные группы. В зависимости от природы углеводородного радикала различают предельные, непредельные и ароматические двухосновные карбоновые кислоты.

Из двухосновных предельных карбоновых кислот в средней школе вы ознакомитесь с щавелевой и адипиновой, а из ароматических - терефталевой.
Получение: Ниже приведены схемы реакций получения щавелевой, адипиновой и терефталевой кислот:
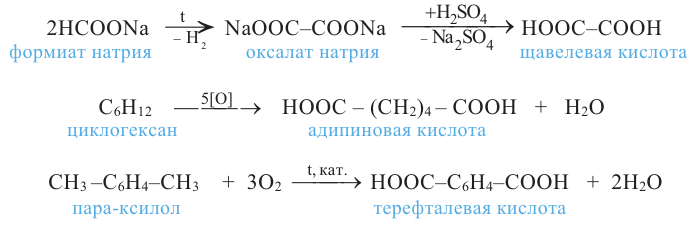
Физические свойства: Двухосновные карбоновые кислоты - кристаллические вещества белого цвета. Первые представители алкандикарбоновых кислот хорошо растворяются в воде, спирте и эфире.

Химические свойства: Двухосновные карбоновые кислоты, как и одноосновные, вступают в реакции с металлами, щелочами, спиртами. В зависимости от числа карбоксильных групп, участвующих в реакции, образуются средние или кислые соли, полные или неполные сложные эфиры, например:
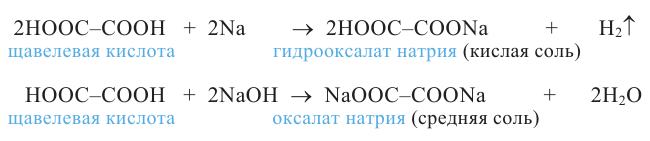
При нагревании двухосновные карбоновые кислоты подвергаются декарбо-ксилировапию (выделяют СO2). В ходе этого процесса щавелевая кислота превращается в муравьиную кислоту. При нагревании в присутствии серной кислоты щавелевая кислота разлагается с образованием трех оксидов:
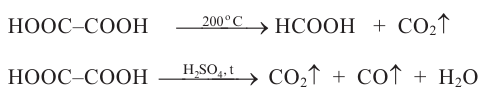
Двухосновные карбоновые кислоты сильнее соответствующих одноосновных кислот. Щавелевая кислота самая сильная из карбоновых кислот.
Применение: Щавелевая кислота применяется при отбеливании тканей, очистке металлов от ржавчины, для удаления накипи и т.д. Адипиповая кислота используется при синтезе волокна нейлона, а терефталевая кислота - для получения лавсанового волокна.
Сложные эфиры
Номенклатура и изомерия:
Сложные эфиры широко применяются в производстве фруктовых соков и кондитерских изделий.

Сложные эфиры - это органические соединения, образующиеся при взаимодействии карбоновых кислот со спиртами:
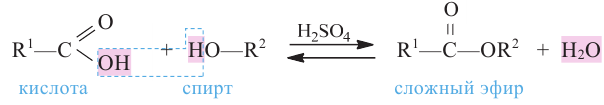
Реакция образования сложных эфиров называется реакцией этерификации.
В формуле радикалы R1 и R2 могут быть одинаковыми или разными (в сложных эфирах муравьиной кислоты R1 = Н). Группа -СОО- является функциональной группой сложных эфиров.
Сложные эфиры, образованные предельными карбоновыми кислотами и предельными одноатомными спиртами, имеют общую формулу СnН2nO.
В реакцию этерификации вступают и неорганические кислородсодержащие кислоты:
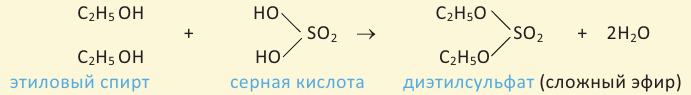
Номенклатура: При названии сложного эфира к названию радикала спирта, образующего эфир, в одном случае к латинскому корню названия кислоты добавляют окончание "-ат", в другом - к Международному названию кислоты добавляют -"-оат" например:

По рациональной номенклатуре к названию соответствующей кислоты и спирта прибавляют слово "эфир", например, НСОО-СН3 метиловый эфир муравьиной кислоты, СН3СОО-С2Н5 этиловый эфир уксусной кислоты.
Пример №20
Структурные формулы и номенклатура сложных эфиров
Назовите сложные эфиры тремя способами.

Решение:
Выделив радикалы спирта (—С2Н5, - СН2-С2Н5), назовем эфиры тремя способами:
а.
- 1. этилпропионат
- 2. этилпропаноат
- 3. этиловый эфир пропионовой кислоты
b.
- 1. пропилацетат
- 2. пропилэтаноат
- 3. пропиловый эфир уксусной кислоты
Изомерия: Сложные эфиры и одноосновные предельные кислоты имеют одну и ту же общую формулу СnН2nO2  Поэтому они между собой образуют межклассовую изомерию, как на примере метилформиата и уксусной кислоты:
Поэтому они между собой образуют межклассовую изомерию, как на примере метилформиата и уксусной кислоты:
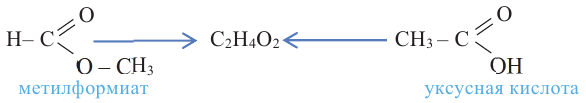
Внутриклассовая изомерия обусловлена несколькими причинами:
а) положением -СОО- группы в углеродной цепи:
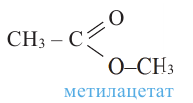 и
и 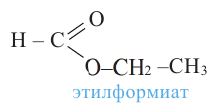
b) строением радикалов остатков кислоты и спирта. Например, изомерия нижеприведенных эфиров обусловлена строением радикалов в остатке спирта:
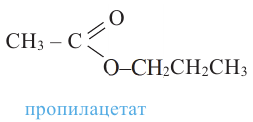 и
и 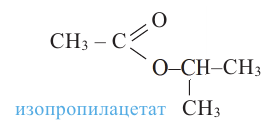
Сложные эфиры содержатся в составе цветов, ягод, плодов и фруктов. Специфический запах растений и фруктов обусловлен именно присутствием в их составе сложных эфиров (а, b, с).
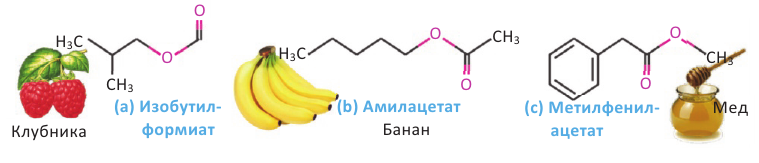
Сложные эфиры высших карбоновых кислот с высшими одноатомными спиртами - это воскообразные вещества.
Растительные и животные воски. Из-за большой относительной молекулярной массы растительные и животные воски при обычных условиях - твердые вещества; например, сложный эфир 1-триаконтилпальмитат - основной компонент пчелиного воска:
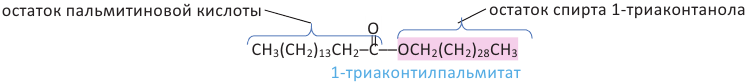
- - Воски выполняют защитную функцию для растений и животных.
- - Многие воски применяются как косметические средства, свечи и мази.
- - В отличие от восков растительного и животного происхождения, парафиновые воски состоят из высокомолекулярных алканов.
Получение и свойства:
Сложные эфиры как приправы являются наиболее многочисленными пищевыми добавками. В настоящее время известно более тысячи таких синтетических и природных приправ. Основная их часть - концентраты и экстракты, полученные из приятно пахнущих душистых растений.
Природные сложные эфиры выделяют из растений методом экстракции органическими растворителями. Однако, большинство из них получают реакцией этерификации:
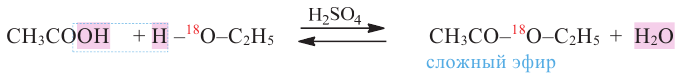
Некоторые особенности реакции этерификации: 1) В реакции вода образуется из -ОН группы карбоновой кислоты и атома водорода -ОН группы спирта; 2) реакция этерификации - обратимая реакция. 3) реакция проводится в присутствии концентрированной серной кислоты.
Для смещения равновесия в сторону образования эфира согласно принципу Ле Шателье надо выполнить следующее:
- a) в реакции спирт или кислоту следует взять в избытке;
- b) удалить эфир из реакционной среды методом дистилляции или образующуюся воду связать посредством водоотнимающих веществ;
Сложные эфиры получают также взаимодействием спиртов с ангидридами кислот (а) и спиртов со сложными эфирами (b):
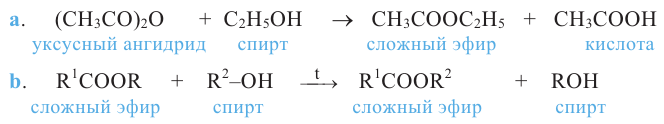
Последняя реакция (b) называется переэтерификацией сложных эфиров.
Физические свойства: Низкомолекулярные сложные эфиры одноосновных предельных карбоновых кислот - летучие жидкости, растворимые в воде; они легче воды. Из-за отсутствия в молекуле -ОН группы водородная связь между молекулами сложных эфиров не образуется. Сложные эфиры кипят при более низкой температуре, чем изомерные им карболовые кислоты.
Многие из сложных эфиров имеют приятный фруктовый запах.
Химические свойства: Химические свойства сложных эфиров обусловлены легкостью разрыва в их молекулах сложноэфирной связи (R1CO-OR2); например, при действии на сложные эфиры водой происходит их гидролиз и образуются соответствующие кислота и спирт:
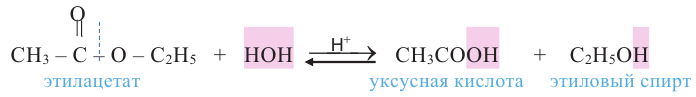
При проведении гидролиза в щелочной среде реакция становится необратимой и завершается образованием спирта и соли карбоновой кислоты
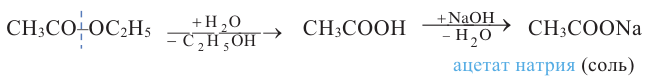
или
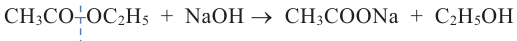
Гидролиз - важнейшее свойство сложных эфиров. Простые эфиры гидролизу
не подвергаются.
Применение: Сложные эфиры используются как растворители.
Сложные эфиры, наряду с другими душистыми веществами, в виде фруктовых эссенций применяются в производстве фруктовых соков, прохладительных напитков, кондитерских изделий, а также в качестве душистых веществ в парфюмерии.
Непредельные сложные эфиры - метилакрилат СН2=СН-СООСН3 и метилметакрилат  - используются в производстве пластмасс.
- используются в производстве пластмасс.
Например, полиметилакрилат используется в производстве искусственной кожи и клея, а полиметилметакрилат - органического стекла - плексигласа (а), зубных протезов, часовых стекол и др.

Жиры
Независимо от происхождения, агрегатного состояния и состава важнейшая функция жиров в организме человека состоит в обеспечении организма энергией.

Жиры - это сложные эфиры глицерина и, главным образом, высших одноосновных карбоновых кислот. Их общее название триглицериды.
Жиры образуют главным образом пальмитиновая, стеариновая и олеиновая кислоты. Триглицерид стеариновой кислоты впервые был получен взаимодействием глицерина со стеариновой кислотой (1854 г; М.Бертло):
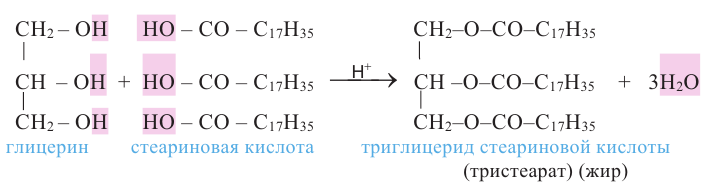

М. Бертло (1827-1907) Французский химик
Синтезировал большое число органических соединений (этиловый спирт, муравьиную кислоту, жиры и др.).
Классификация и строение: По происхождению жиры подразделяют на растительные и животные, по агрегатному состоянию - на твердые и жидкие, по составу - на состоящие в основном из остатков предельных и непредельных высших карбоновых кислот.
Твердые жиры образуют, в основном, предельные пальмитиновая (С15Н31СООН) и стеариновая (С17Н35СООН) кислоты. Жидкие жиры (масла) образуют непредельные - олеиновая (С17Н33СООН), линолевая (С17Н31СООН) и линоленовая (С17Н29СООН) кислоты.
Обычно в состав триглицеридов входят остатки не одной, а разных кислот. Такие жиры называются смешанными жирами:
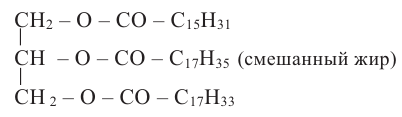
Знаете ли вы Линолевая и линоленовая кислоты (незаменимые кислоты) не могут быть синтезированы в организме. Поэтому они поступают в организм вместе с пищей.
Иногда в состав жиров входят и низкомолекулярные карбоновые кислоты; например, в состав коровьего масла входит сложный эфир масляной кислоты (С3Н7СООН).
Физические свойства: Жиры легче воды и в воде не растворяются. Они хорошо растворяются в органических растворителях, например, в бензоле, гексане и др. Природные твердые жиры представляют смесь различных триглицеридов, поэтому они плавятся не при постоянной температуре, а в некотором интервале температур.
Как правило, животные жиры (коровье масло, козий жир, бараний жир и др.) бывают твердыми, а растительные жиры (масла) (подсолнечное, оливковое, кукурузное) - жидкими. Однако, также известны жидкие жиры животного происхождения (рыбий жир) и твердые жиры растительного происхождения (пальмовое масло).
В чистом состоянии жиры - вещества без цвета, запаха и вкуса. Вкус, цвет и запах жиров обусловлены другими растворенными в них веществами; например, желтый цвет маргарина обусловлен каротином, добавляемым в процессе приготовления маргарина.
Химические свойства: Жиры подвергаются гидролизу. В результате гидролиза образуются глицерин и карбоновые кислоты:
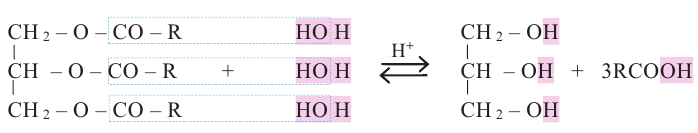
Жиры, принимаемые в виде пищи, в пищеварительных органах под действием фермента липазы подвергаются гидролизу. Из продуктов гидролиза -глицерина и высших карбоновых кислот - под влиянием других ферментов синтезируются характерные для данного организма новые жиры.
Гидролиз жиров - обратимый процесс. При проведении гидролиза в присутствии щелочи или соды гидролиз становится необратимым:
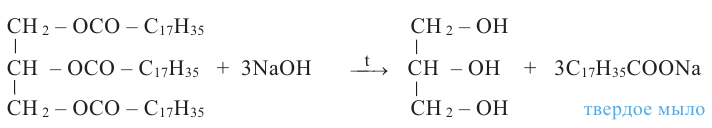
Так как раньше этим способом получали мыло, гидролиз жиров в щелочной среде называют омылением жиров.
При гидрировании С=С связей, входящих в состав жидких жиров, масла превращаются в твердые жиры:
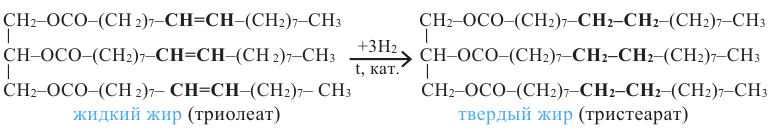
Эта реакция используется в промышленности для получения маргарина из растительных масел. Маргарин состоит из смеси гидрированного масла, животного жира, молока и других веществ (соли, сахара, витаминов и др).
Знаете ли вы... Транс-жирные кислоты. Транс-изомеры жирных кислот встречаются и в природных продуктах, и в пищевых продуктах, производимых в промышленности. Обычно их содержание в природных мясных и молочных продуктах составляет 5-8%. В промышленных продуктах транс-жиры появляются в ходе гидрирования жидких масел; например, при производстве маргарина образуется около 20-30% транс-жиров (при полном гидрировании образующееся масло бывает слишком твердым). Употребление транс-жиров в пищу создает почву для сердечно-сосудистых и злокачественных заболеваний, а также для заболеваний печени и сахарного диабета. Поэтому Всемирная организация здравоохранения (ВОЗ) запретила использование промышленных продуктов, содержащих транс-жиры, или строго ограничила их применение.
На этикетках многих пищевых продуктов имеется указание об отсутствии транс-жиров в их составе.
Применение: В промышленности жиры используются для получения глицерина, карбоновых кислот, мыла.
Жиры, как составная часть пищи, играют важную роль в жизнедеятельности. Они являются основным источником энергии организма. Энергия, получаемая организмом при окислении жиров, примерно в 2 раза больше энергии, § образующейся при окислении углеводов или белков:
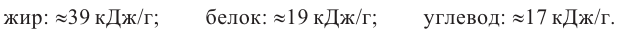
Мыла и синтетические моющие средства
Мыло изготовливали еще за 2800 лет до н.э. в Шумере и Вавилоне. Согласно древним записям, мыло готовили кипячением смеси кунжутного масла, щелочи, воды и сока лайма (цитрусовое растение).

Мыло:
Мыла - это натриевые и калиевые соли высших карбоновых кислот.
Обычное мыло состоит из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли составляют основную часть твердого мыла, а калиевые соли - жидкого мыла. Калиевые соли, по сравнению с солями натрия, в воде лучше растворимы, и по этой причине они обладают большей моющей способностью.
В настоящее время карбоновые кислоты, необходимые для производства мыл, получают в основном окислением парафинов нефти:
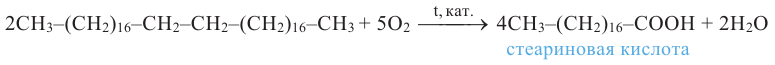
Соли, составляющие основную часть жидких и твердых мыл, можно получить следующими реакциями:
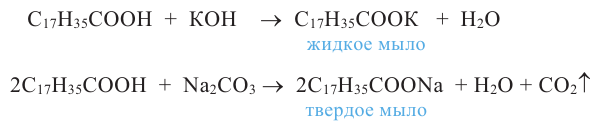
Добавляя глицерин, красители, душистые и антисептические вещества, а также растительные экстракты к полученным солям, получают мыло.
В жесткой воде мыло плохо пенится, так как кислотные остатки, входящие в состав мыл, вместе с содержащимися в жесткой воде ионами Са2+ и Mg2+ образуют осадки. Как следствие, моющая способность мыл уменьшается:
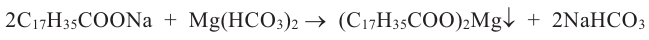
С другой стороны, образующаяся при гидролизе мыла щелочная среда, влияя на ткань, ухудшает ее качество. Поэтому в быту и на производстве, наряду с мылами, используют и синтетические моющие вещества, которые лишены этих недостатков.
Синтетические моющие вещества:
Синтетические моющие вещества - это натриевые соли кислых сложных эфиров, образованных высшими одноатомными спиртами и серной кислотой.
В общем виде образование синтетических моющих веществ можно представить следующими двумя уравнениями:
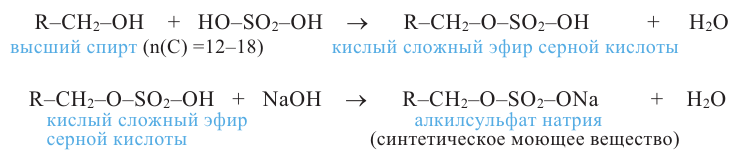
Обычно в молекулах высших спиртов R представляет собой углеводородный радикал предельного, ароматического и др. углеводорода, имеющий неразветвленное строение.
Пример №21
Какая часть пальмитат иона имеет сродство к воде, а какая - к жирам?
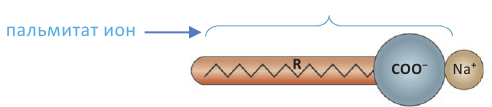
Решение:
В воде "молекула" пальмитата натрия диссоциирует на пальмитат ион и ион натрия. Отрицательно заряженная карбоксильная группа пальмитат иона, притягивая полярные молекулы воды к себе, проявляет сродство к воде.
Незаряженный и неполярный углеводородный радикал (R) пальмитат иона, пытаясь удалиться от полярных молекул воды, будет стремиться к контакту с жирами, имеющими неполярное строение. Поэтому углеводородный радикал мыла имеет сродство к жирам и в процессе стирки непосредственно участвует в удалении жировых частиц с поверхности изделия.
Формулы мыла и синтетических моющих веществ в общем виде можно представить следующим образом:
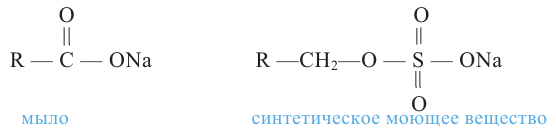
Синтетические моющие вещества также имеют недостатки. В отличие от мыл, они после использования в природных условиях не разлагаются, оказывая тем самым вредное воздействие на окружающую среду и, в частности, приводя к уничтожению флоры и фауны.
Синтетические моющие вещества используются вместе с некоторыми добавками - стабилизаторами пен, отбеливателями и др.
Как моют мыла.
В водной среде "молекулы" мыла (напр., RCOONa) диссоциируют на ион Na+ и анион кислотного остатка. Поскольку гидрофильные полярные карбоксильные группы аниона RCOO- гидратируются молекулами воды, а их радикалы R являются гидрофобными, то кислотные остатки RCOO- собираются, образуя мыльные мицеллы, как показано на схеме (а).
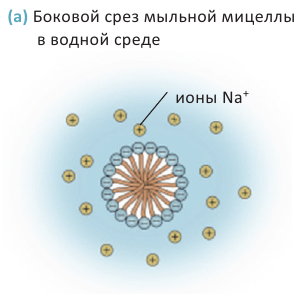
При стирке загрязненного изделия (ткани) углеводородный радикал мыла, проникая в загрязнение (жиры, пятна нефти), состоящее из неполярных веществ, отщепляет и "растворяет" их в себе (b). Поскольку мыльные частицы (b) смачиваются в воде, то они легко смываются при стирке водой.
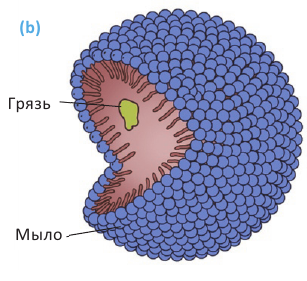
Обычно для стирки изделий из шерсти и шелка рекомендуют использовать порошки, не содержащие в своем составе соду и другие вещества с щелочными свойствами.
При стирке тканей из хлопка и льна рекомендуется применять моющие порошки, содержащие в своем составе соду, силикат натрия и полифосфат натрия, так как эти ткани устойчивы к щелочной среде.
Выводы:
- Карбоновые кислоты, сложные эфиры, жиры и мыла - органические соединения, содержащие -СOO- группу.
- Основность карбоновой кислоты определяется числом карбоксильных групп в ее молекуле.
- Предельные одноосновные карбоновые кислоты образуют межклассовую изомерию со сложными эфирами.
- Уксусную кислоту получают каталитическим окислением уксусного альдегида и бутана.
- В промышленности муравьиную кислоту получают каталитическим окислением метана.
- В промышленности высшие карбоновые кислоты получают каталитическим окислением алканов, содержащих в молекуле 28-36 атомов углерода.
- Более высокая температура кипения предельных одноосновных карбоновых кислот, по сравнению со спиртами с тем же числом атомов углерода, обусловлена более прочными водородными связями в случае кислот.
- Первые представители ряда предельных карбоновых кислот с водой смешиваются в любых соотношениях, так как их молекулы образуют водородные связи с молекулами воды.
- Акриловая кислота - непредельная, бензойная кислота - ароматическая кислота.
- Первые представители карбоновых кислот являются слабыми электролитами; их растворы окрашивают синюю лакмусовую бумагу в красный цвет.
- Соли уксусной кислоты называются ацетатами, муравьиной - формиатами.
- Муравьиная кислота - самая сильная в гомологическом ряду, и, в отличие от других членов ряда, вступает в реакцию "серебряного зеркала".
- Пальмитиновая, стеариновая и олеиновая кислоты - высшие жирные кислоты.
- Высшие жирные кислоты с глицерином образуют сложные эфиры.
- Натриевые соли пальмитиновой и стеариновой кислот - основная составная часть твердого мыла, калиевые соли - жидкого мыла.
- Непредельные жирные кислоты плавятся при более низкой температуре, чем предельные жирные кислоты с тем же числом атомов углерода.
- Щавелевая и терефталевая кислоты - двухосновные кислоты.
- Реакция этерификации - обратимая реакция.
- Важнейшее химическое свойство сложных эфиров - гидролиз.
- Жиры - сложные эфиры глицерина и высших карбоновых кислот.
- Животные жиры - обычно твердые вещества, растительные жиры, в основном - жидкие вещества.
- Омыление - гидролиз жиров в присутствии щелочи (или соды).
- Гидрирование растительных масел используется в производстве маргарина.
- Синтетические моющие вещества - это натриевые соли кислых сложных эфиров высших одноатомных спиртов с серной кислотой.
Углеводы (сахариды)
Углеводы являются широко распространенными веществами, особенно в растительном мире. 80% сухого вещества растений приходится на долю углеводов, в то время как в животных организмах их содержится около 2% сухой массы. В организме человека углеводы выполняют прежде всего энергетическую функцию: при окислении глюкозы выделяется необходимая для жизнедеятельности организма энергия. Глюкоза образуется в организме при гидролизе дисахаридов и крахмала. Кроме того, галактоза и фруктоза также превращаются (в печени) в глюкозу. Поэтому в крови из моносахаридов содержится только глюкоза (около 0,1%). 60% глюкозы в крови расходуется на деятельность головного мозга человека. Считается, что содержание крахмала в пище древних людей способствовало развитию мышления, что и привело к эволюции.
В промышленности превращения углеводов лежат в основе процессов брожения, химического превращения древесины, изготовления тканей и бумаги. В настоящее время большой интерес к углеводам связан с возможностью синтеза искусственных полимеров на основе крахмала и целлюлозы, которые после использования легко разлагаются микроорганизмами в природных условиях, не загрязняя окружающую среду.
"Углевод" - означает "гидратированный угле род" (гидрат углерода).
Углеводы - это органические вещества, содержащие гидроксильные группы, а также альдегидную или карбонильную группу. Название углеводы связано с тем, что первые изученные их представители по составу, как бы соответствовали соединениям углерода и воды - Cn(H2O)m (n и 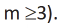 Однако, впоследствии стало известно, что существуют и углеводы, которые по составу не отвечают этой формуле, но по свойствам относятся к этому классу веществ, например, С6Н12О5 - рамноза, С5Н10О4 - дезоксирибоза и др. Несмотря на это, название "углеводы" все еще сохранилось за ними.
Однако, впоследствии стало известно, что существуют и углеводы, которые по составу не отвечают этой формуле, но по свойствам относятся к этому классу веществ, например, С6Н12О5 - рамноза, С5Н10О4 - дезоксирибоза и др. Несмотря на это, название "углеводы" все еще сохранилось за ними.
Углеводы подразделяют на моносахариды, дисахариды и полисахариды:
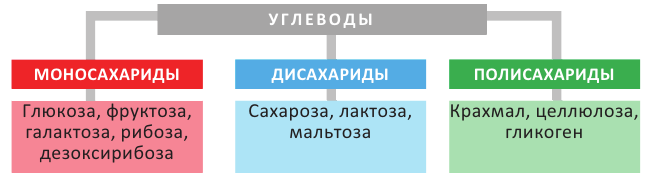
Моносахариды, содержащие альдегидную группу, называются альдозами, кетонную группу - кетозами. По числу атомов углерода в молекуле моносахариды подразделяются на триозы (n = 3), тетрозы (n = 4), пентозы (n = 5), гексозы (n = 6) и т.д.; например, глюкоза -это альдогексоза, а фруктоза - кетогексоза:
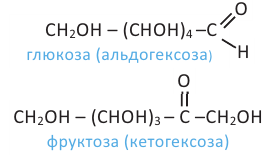
Рибоза [С5Н10О5] и дезоксирибоза [С5Н10О4] относятся к пентозам.
Несмотря на то, что формулы формальдегида (СН2О), уксусной кислоты [C2(H20)2] и некоторых других органических соединений соответствуют формуле Cn(H20)m, однако по ряду свойств они отличаются от углеводов.
Моносахариды
Глюкоза: строение и физические свойства:
Примерно половина энергии, необходимой для деятельности человека, производится за счет превращений глюкозы, растворенной в крови.
В природе глюкоза содержится в виноградном соке, меде, спелых фруктах и ягодах. В организме человека глюкоза, наряду с мышцами, содержится в крови (около 0,1%) и в меньшем количестве во всех тканях. Образуется при фотосинтезе растений:
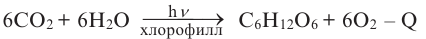
Получение: Глюкоза впервые была синтезирована из формальдегида (А. Бутлеров, 1861):
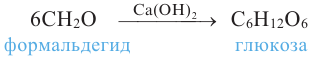
В промышленности глюкозу получают гидролизом крахмала или целлюлозы:
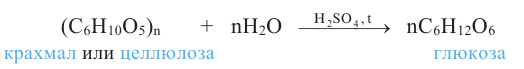
Примечание: В нашей республике глюкозу получают из промежуточных продуктов обработки кукурузы на Огузском заводе но производству глюкозы.
Изомерия: Глюкоза имеет несколько изомеров. Два из них называются фруктозой и галактозой.
Физические свойства: Глюкоза - белое кристаллическое вещество со сладким вкусом, хорошо растворимое в воде и малорастворимое в спирте. Из водного раствора она выделяется в виде кристаллогидрата 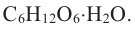
Строение: Молекула глюкозы в водном растворе существует в трех изомерных формах - пятиатомного альдегидоспирта и в двух циклических - 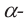 и
и  формах. В неразветвленной углеродной цепи молекулы альдегидоспиртовой £ формы содержится 5 -ОН и одна альдегидная группы:
формах. В неразветвленной углеродной цепи молекулы альдегидоспиртовой £ формы содержится 5 -ОН и одна альдегидная группы:
В каждой из циклических форм глюкозы также содержится 5 -ОН групп, но альдегидная группа отсутствует:
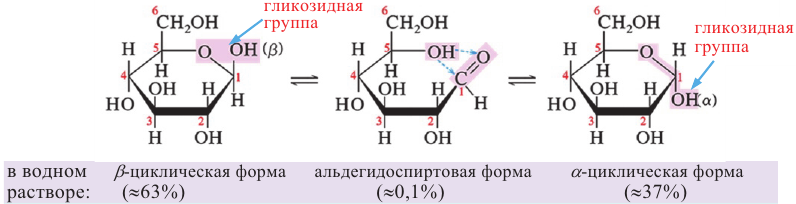
Альдегидоспиртовая и две циклические формы молекулы глюкозы (атомы углерода кольца не показаны)
В водном растворе глюкозы альдегидоспиртовая форма присутствует в очень малом количестве 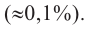 В
В  циклической форме -ОН группы, связанные с С1 и C2 атомами углерода, расположены по одну сторону цикла молекулы, а в
циклической форме -ОН группы, связанные с С1 и C2 атомами углерода, расположены по одну сторону цикла молекулы, а в 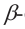 форме - по обе стороны цикла.
форме - по обе стороны цикла.
В кристаллическом состоянии глюкоза находится в 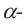 циклической форме. В водном же растворе она существует, в основном, в
циклической форме. В водном же растворе она существует, в основном, в 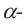 и
и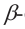 формах, которые посредством альдегидоспиртовой формы с большой скоростью превращаются друг в друга.
формах, которые посредством альдегидоспиртовой формы с большой скоростью превращаются друг в друга.
Процесс взаимного превращения 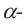 и
и 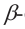 форм глюкозы называется таутомерией,
форм глюкозы называется таутомерией,  и
и формы - таутомерами. В растворах таутомеры находятся в динамическом равновесии.
формы - таутомерами. В растворах таутомеры находятся в динамическом равновесии.
Глюкоза: химические свойства и применение:
Одной из наиболее частых процедур в биохимических лабораториях является определение глюкозы в крови, моче или в других биологических жидкостях. С этой целью используется фермент глюкозооксидаза.
Реакции альдегидной группы глюкозы:
Восстановление глюкозы. В присутствии катализатора глюкоза восстанавливается водородом, образуя шестиатомный спирт - сорбит:
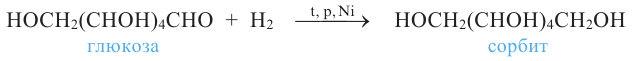
Знаете ли вы ... Сладость сорбита составляет 60% сладости обычного сахара; сорбит используют в качестве сахарозаменителя для больных диабетом.
Окисление глюкозы: Глюкоза при действии оксида серебра (I) и при слабом нагревании с гидроксидом меди (II) окисляется в глюконовую кислоту. Обе реакции подтверждают наличие альдегидной группы в молекуле глюкозы:
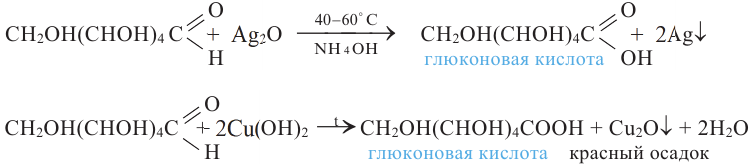
Поскольку в этих реакциях углевод восстанавливает окислитель, то подобные углеводы называют восстанавливающими сахарами.
В организме в результате постадийного окисления глюкозы выделяется энергия, необходимая для жизнедеятельности живых существ.
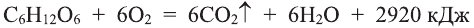
Определение количества глюкозы в биологических жидкостях (крови, моче, и т.д.).
В ходе теста фермент глюкозооксидаза превращает глюкозу в глюконовую кислоту:
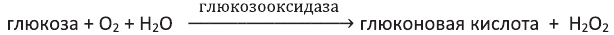
Образующийся пероксид водорода окисляет предварительно добавленный в систему бесцветный 2-метиланилин в окрашенный продукт:
Цветовые оттенки раствора позволяют определить количество глюкозы в образце.
Реакции гидроксильных групп глюкозы:
С активными металлами глюкоза образует сахараты типа алкоголятов; это подтверждает наличие в ее молекуле -ОН группы:
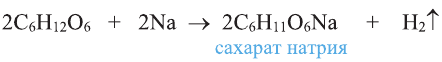
С гидроксидом меди (II) глюкоза образует ярко-синий раствор сахарата меди (II), что подтверждает наличие нескольких -ОН групп в ее молекуле:
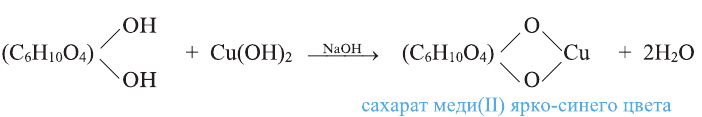
Образование сложного эфира - пептаацетилглюкозы при взаимодействии глюкозы с уксусным ангидридом (или уксусной кислотой) указывает на наличие в ее молекуле 5 -ОН групп:
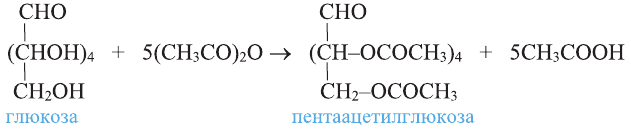
Реакция гликозидной -ОН группы (образование гликозидов):
B циклических формах глюкозы атом водорода -ОН группы, связанной с первым атомом углерода является более подвижным, чем атомы Н других 4-х -ОН групп. Например, глюкоза со спиртами реагирует только с участием этой -ОН группы, образуя гликозиды:
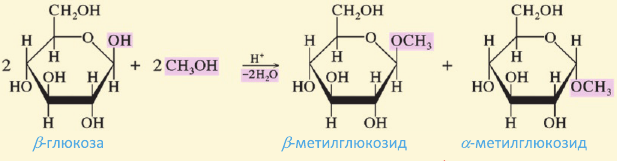
По этой причине-ОН группу, связанную с атомом углерода 1С, называют гликозидной.
Специфические свойства глюкозы:
Под действием ферментов глюкоза подвергается спиртовому (а), масляно-кислому (b) и молочнокислому (с) брожению:
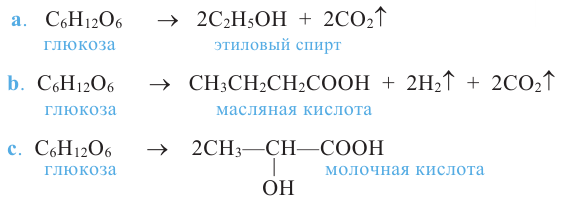
Применение: Глюкоза - легкоусвояемое питательное вещество. Поэтому в медицине ее используют при консервации крови, а также как средство для укрепления организма. Она используется в текстильной промышленности при нанесении узоров на ткани, в кондитерской промышленности, а также при синтезе витамина С (аскорбиновой кислоты). На практике брожением глюкозы получают этиловый спирт (а).
Фруктоза, рибоза и дезоксирибоза:
Фруктоза, называемая также и плодовым сахаром, является уникальным A питательным веществом, которое может принимать любой из нас. В отличие от глюкозы, фруктоза медленно всасывается в кишечнике, однако быстро расщепляется. В это время выделяется много энергии.

A Фруктоза:
Фруктоза (С6Н12О6: плодовый сахар), являясь изомером глюкозы, вместе с ней встречается в сладких фруктах. Она слаще сахарозы в 1,5 раза и глюкозы в 3 раза. Большая сладость меда связана с присутствием в его составе фруктозы. В отличие от глюкозы, фруктоза - пятиатомный кетоноспирт:
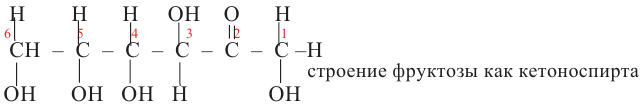
В растворе фруктоза также существует в циклических  и
и  формах:
формах:
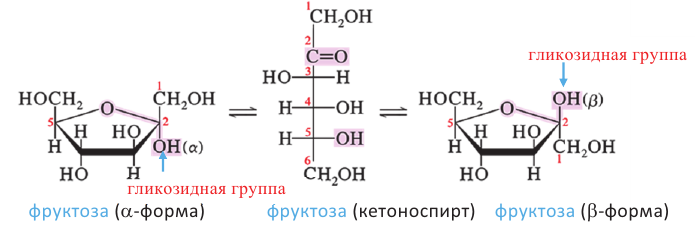
Как и многоатомные спирты, она реагирует с активными металлами, основаниями [Си(ОН)2, Са(ОН)2 и др.], образуя сахараты типа алкоголятов, а с кислородсодержащими кислотами -сложные эфиры. Поскольку в ее составе нет альдегидной группы, она, в отличие от глюкозы, не реагирует с оксидом серебра (I) и гидроксидом меди (II).
Под действием сильных окислителей фруктоза окисляется, образуя щавелевую и винную кислоты.
Другой изомер глюкозы называют галактозой. Она отличается от глюкозы только по расположению в пространстве атома Н и -ОН группы при четвертом атоме углерода (4С) цикла:
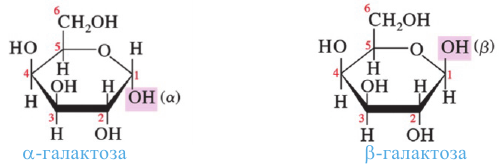
Рибоза (С5Н10О5) и дезоксирибоза (С5Н10О4) - представители пентоз. В альдегидоспиртовой форме рибоза - четырехатомный, а дезоксирибоза - пятиатомный альдегидоспирт.

В молекуле дезоксирибозы у 2-го атома углерода вместо -ОН группы расположен атом водорода. По этой причине состав дезоксирибозы (С5Н10О4) не соответствует общей формуле углеводов - Cn(H2O)m.
Как многоатомные альдегидоспирты, рибоза и дезоксирибоза окисляются по реакции "серебряного зеркала" и под действием гидроксида меди (II) восстанавливаются водородом, с гидроксидом меди (II) также образуют сахараты ярко-синего цвета, а с карболовыми кислотами - сложные эфиры.
При восстановлении рибозы водородом образуется пятиатомный спирт - рибит, а при окислении - рибоновая кислота:
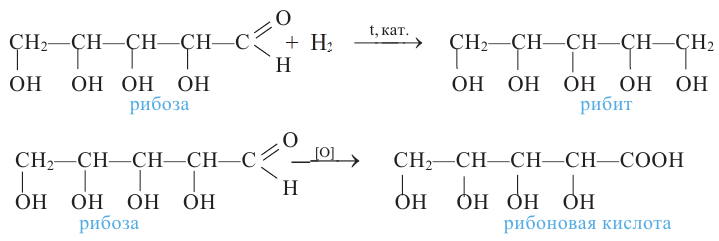
Рибоза входит в состав рибонуклеиновых кислот (РНК), а дезоксирибоза -дезоксирибонуклеиновых кислот (ДНК). В составе нуклеиновых кислот рибоза и дезоксирибоза находятся в  циклической форме.
циклической форме.
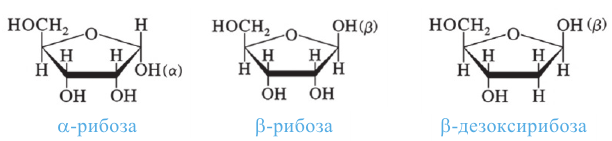
Дисахариды. Сахароза
Свекла, предназначенная для корма животных, содержит 1,3% сахарозы, и поэтому для производства сахара невыгодна.
Еще в 1747 г. в Европе для удовлетворения потребности в сахаре селекционеры начали создавать новые сорта свеклы, содержащей много сахара. Выращиваемая в настоящее время сахарная свекла содержит более 20% сахарозы.
В молекулах сахарозы, мальтозы и лактозы два остатка моносахаридов соединены друг с другом гликозидной связью.
Нахождение в природе: Сахароза (С12Н22О11) содержится в основном в соке сахарной свеклы (12-20%) и сахарного тростника (14-26%). Поэтому ее называют также свекловичным сахаром и тростниковым сахаром. Она содержится также в спелых плодах многих фруктов и овощей.
Получение: Сахарозу выделяют из сахарного тростника и сахарной свеклы. Для этого свеклу мелко нарезают и обрабатывают горячей водой. При этом сахароза из состава свеклы растворяется и переходит в раствор. В раствор, наряду с сахарозой, переходят также и различные органические кислоты, белки и красящие вещества. Для осаждения этих примесей раствор обрабатывают известковым молоком. При этом сахароза с гидроксидом кальция образует сахарат кальция состава 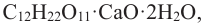 растворимый в воде (1). Далее для осаждения избытка гидроксида кальция из раствора и кальция, содержащегося в составе сахарата кальция, в раствор пропускают углекислый газ (2,3):
растворимый в воде (1). Далее для осаждения избытка гидроксида кальция из раствора и кальция, содержащегося в составе сахарата кальция, в раствор пропускают углекислый газ (2,3):
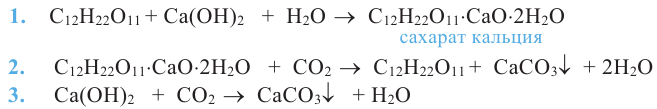
Путем фильтрации раствор отделяют от осадка, в условиях вакуума испаряют воду и содержащуюся в нем сахарозу выделяют методом кристаллизации. Если сахароза недостаточно чиста, ее заново растворяют в воде, раствор пропускают через активированный уголь, испаряют и повторно кристаллизуют. После кристаллизации содержание сахара в растворе может достигать 50%. Такой раствор называют мелассой. Меласса используется в производстве этанола, лимонной кислоты, молочной кислоты и др.
Примечание: В нашей республике, на Имишлинском сахарном заводе сахарозу получают из сахарной свеклы.
Строение: Молекула сахарозы состоит из остатков  глюкозы и
глюкозы и  фруктозы. В образовании молекулы сахарозы участвуют гликозидные -ОН группы каждого моносахарида, в результате чего глюкоза и фруктоза, выделяя 1 молекулу воды, соединяются друг с другом посредством кислородного мостика:
фруктозы. В образовании молекулы сахарозы участвуют гликозидные -ОН группы каждого моносахарида, в результате чего глюкоза и фруктоза, выделяя 1 молекулу воды, соединяются друг с другом посредством кислородного мостика:
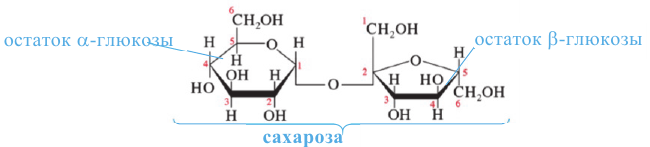
Физические свойства: Сахароза (обычный сахар) - белое кристаллическое вещество, намного слаще чем глюкоза, в воде хорошо растворяется; плавится при температуре, равной 160°С.
Химические свойства: Сахароза в присутствии ионов Н+ подвергается гидролизу, образуя глюкозу и фруктозу:
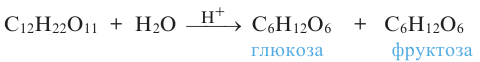
Как многоатомный спирт, сахароза с активными металлами и гидроксидами металлов [(Са(ОН)2, Си(ОН)2)] образует сахараты; например, с гидроксидом меди (II) образует ярко-синий раствор сахарата меди (II):
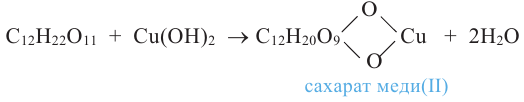
Поскольку в ее молекуле отсутствует альдегидная группа, она не окисляется по реакции "серебряного зеркала" и гидроксидом меди (II) (т.е. она их не восстанавливает).
При горении сахарозы образуются углекислый газ и вода:

Мальтоза и лактоза:
Мальтоза и лактоза - изомеры сахарозы.
Мальтоза (солодовый сахар) - один из промежуточных продуктов гидролиза крахмала. Ее молекула состоит из двух остатков молекулы глюкозы, и потому при гидролизе образуется две молекулы глюкозы:
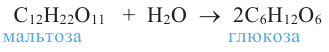
Лактоза (молочный сахар) содержится в материнском молоке (5-8%) и коровьем молоке (4-6%). При ее гидролизе образуются глюкоза и галактоза:
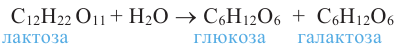
Строение молекул мальтозы и лактозы:
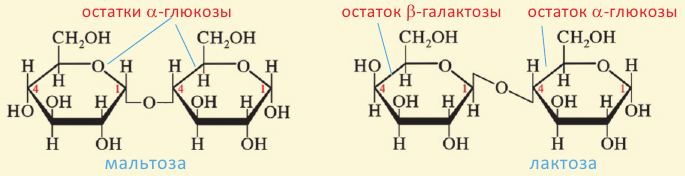
В одном из остатков моносахарида молекул мальтозы и лактозы сохраняется одна гликозидная -ОН группа. Поэтому эти дисахариды, в отличие от сахарозы, в водном растворе могут образовывать альдегидную группу и, как следствие, окисляясь, превращаются в соответствующую кислоту.
Таким образом, дисахариды - мальтоза и лактоза, как и глюкоза, рибоза и дезоксирибоза, относятся к восстанавливающим углеводам.
Применение. Сахароза применяется в основном как питательный продукт и в кондитерской промышленности. Ее гидролизом получают искусственный мед.
Полисахариды
Крахмал:
В процессе созревания фруктов содержание крахмала в нем, как правило, уменьшается; например, в неспелых бананах содержание крахмала - 18%, а в спелых - 2%, в неспелом яблоке - 4-5%, а в спелом -1%.
Крахмал [(С6Н10О5)n] и целлюлоза в растительном мире широко распространенные полисахариды. Молекулы крахмала, целлюлозы, а также полисахарида гликогена состоят из большого числа остатков глюкозы, соединенных между собой гликозидной связью.
Крахмал накапливается в картофеле  пшенице
пшенице  рисе
рисе  и в корнях растений.
и в корнях растений.
Получение: Крахмал получают в основном из картофеля, риса и кукурузы. С этой целью из размельченного продукта крахмал вымывается на сите водой. Из суспензии крахмала, прошедшей через сито в виде "картофельного молока", крахмал осаждают методом отстаивания, раствор фильтруют и оставшийся крахмал высушивают.
Строение: Крахмал - природный полимер состава (С6Н10О5)n, состоящий из остатков  глюкозы. Его макромолекула образуется в результате реакции поликонденсации продукта фотосинтеза -
глюкозы. Его макромолекула образуется в результате реакции поликонденсации продукта фотосинтеза -  глюкозы (а):
глюкозы (а):
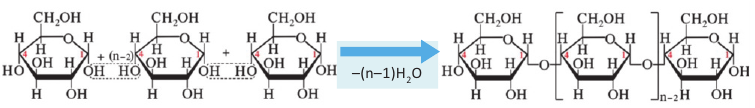
(а) получение крахмала неразветвленного строения (амилозы) поликонденсацией  глюкозы
глюкозы
Крахмал состоит из смеси двух полисахаридов - амилозы, неразветвленного строения (b), и амилопектина, разветвленного строения (c). В большинстве случаев крахмал содержит примерно 20-25% амилозы и 75-80% амилопектина. Молекулы амилозы скручены в форме спирали (b, d).
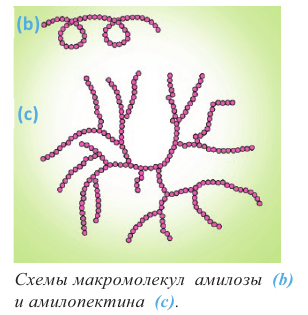
Из схемы а видно, что образование крахмала происходит с участием -ОН групп глюкозы, расположенных в положениях 1,4. Другими словами, В реакции поликонденсации Схемы макромолекул амилозы (b) участвуют гликозидные -ОН группы. По этой и амилопектина (с). причине в растворе в С6Н10О5 звеньях макромолекулы крахмала не могут образоваться альдегидные группы, и потому крахмал не восстанавливает оксид cepeбpa (I) и гидроксид меди (II).
Разветвление в амилопектине происходит за счет 1,6-гликозидных связей.
Физические свойства: Крахмал - белый порошок без вкуса, нерастворимый в холодной воде. В горячей воде набухает, образуя крахмальный клейстер.
Химические свойства: 1. Под действием ферментов или при нагревании с кислотами крахмал подвергается гидролизу. Конечный продукт гидролиза - глюкоза. В промышленности глюкозу получают этим путем:
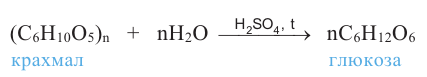
В зависимости от условий гидролиз крахмала может протекать ступенчато, с образованием промежуточных продуктов:
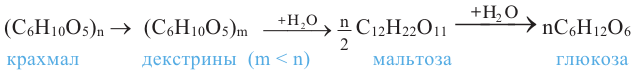
2. Качественной реакцией па крахмал является образование синего окрашивания при действии на него йода (I2). В этом процессе молекулы йода проникают в пустоты, образованные молекулами амилозы при их скручивании в спираль (d). При нагревании окраска исчезает, так как молекулы йода покидают пустоты, а при охлаждении синее окрашивание вновь появляется - молекулы I2 повторно входят в пустоты (в закрытой системе).
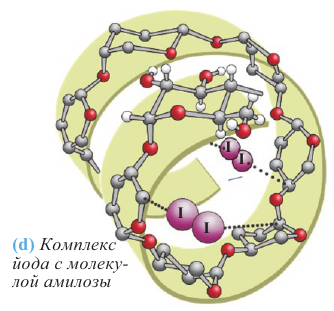
За счет -ОН групп крахмал образует сложные эфиры, однако, ОНИ не имеют практического применения.
Применение: Крахмал, как питательный продукт, удовлетворяет потребность человека в углеводах. В организме в результате гидролиза крахмала (точнее, продуктов его частичного гидролиза - декстринов) образуется глюкоза. Часть глюкозы усваивается организмом, а избыток ее превращается в гликоген (животный крахмал) и откладывается в печени как резервное вещество.
Из крахмала получают декстрины, патоку (смесь декстринов с глюкозой), используемые в производстве карамельных изделий, а также глюкозу и этанол. Он используется для приготовления клея, накрахмаливания белья, в бумажной и полиграфической промышленности. На его основе приготавливают антибиотики, витамины, присыпки, капсулы для лекарств и др.
Гликоген:
В отличие от крахмала - резервного полисахарида растений, гликоген (е) - резервное вещество для организма животных и человека. По составу он одинаков с крахмалом: (С6Н10O5)n. Однако макромолекулы гликогена имеют большую относительную молекулярную массу и более разветвленное строение.

В организме нормально развитого человека содержится около 350 г гликогена, равномерно распределённого в мышцах и печени. При возникновении потребности организма в глюкозе гликоген подвергается гидролизу, образуя глюкозу.
При термической обработке картофеля и хлеба химические превращения, происходящие с крахмалом, придают продуктам обработки больший вкус, а продукты превращения еще легче подвергаются гидролизу.
Целлюлоза:
Целлюлоза - наиболее распространенное в природе органическое вещество. В отличие от крахмала, целлюлоза в растениях встречается в виде волокон.

Целлюлоза [(С6Н10O5)n], по сравнению с крахмалом, более распространенный углевод. Она образует стенки всех растительных клеток; в древесине содержится около 50%, а в волокнах хлопка и фильтровальной бумаге -порядка 98% целлюлозы.
Получение: Целлюлозу выделяют из хлопка, древесины, тростника и др. Из древесины ее выделяют, в основном, сульфитным способом: измельченная древесина под давлением и в щелочной среде нагревается с раствором гидросульфита кальция Ca(HSO3)2. При этом все вещества, имеющиеся в древесине, кроме самой целлюлозы, переходят в раствор. Раствор фильтруют, а отделившуюся целлюлозу высушивают.
Строение: Целлюлоза, как и крахмал, - природный полимер состава (С6Н10O5)n. Однако они имеют ряд различий. Так, средняя относительная молекулярная масса целлюлозы больше молекулярной массы крахмала и достигает значения в несколько миллионов. В отличие от крахмала, макромолекулы целлюлозы имеют только неразветвлённое строение. По этой причине макромолекулы целлюлозы, располагаясь образуют волокна (льна, хлопка и др.) (а).

Наконец, макромолекулы целлюлозы состоят не из остатков 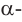 глюкозы, как в крахмале, а из остатков
глюкозы, как в крахмале, а из остатков 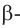 глюкозы. Поэтому образование макромолекулы целлюлозы можно представить следующим образом:
глюкозы. Поэтому образование макромолекулы целлюлозы можно представить следующим образом:
(b) образование целлюлозы поликонденсацией 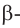 глюкозы
глюкозы
Неразветвлённое строение молекулы целлюлозы и ее образование из остатков 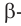 глюкозы приводит к существенному отличию в их свойствах: если крахмал - питательный продукт, то целлюлоза для этой цели не пригодна.
глюкозы приводит к существенному отличию в их свойствах: если крахмал - питательный продукт, то целлюлоза для этой цели не пригодна.
Учитывая наличие трех -ОН групп в каждой структурной единице С6Н10O5, формулу целлюлозы можно представить и в следующем виде:
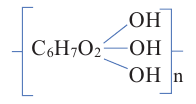 или
или 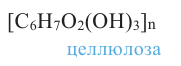
Мr(волокна льна) 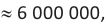 Мr(волокна хлопка)
Мr(волокна хлопка) 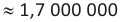
Гидролиз целлюлозы в живых организмах протекает с участием фермента 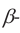 глюкозидазы. Поскольку этот фермент присутствует в пищеварительной системе только жвачных животных, то целлюлоза не переваривается в организме нежвачных животных и человека.
глюкозидазы. Поскольку этот фермент присутствует в пищеварительной системе только жвачных животных, то целлюлоза не переваривается в организме нежвачных животных и человека.
Организм человека переваривает из полисахаридов только крахмал и гликоген.
Физические свойства: Целлюлоза - белое твердое волокнистое вещество, не растворимое в воде и обычных растворителях (спирте, эфире, ацетоне). Нерастворимость целлюлозы и механическая прочность ее волокон обусловлены возникновением большого числа водородных связей между макромолекулами, имеющими неразветвлённое строение.
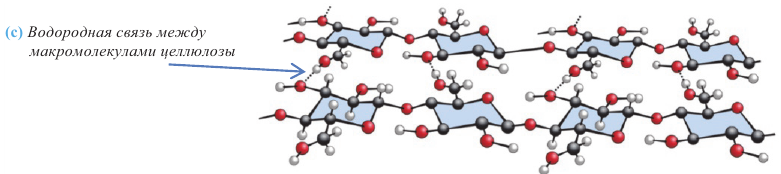
Однако, целлюлоза хорошо растворяется в растворе гидроксида меди (I) в аммиачной воде - реактиве Швейцера.
Химические свойства: При нагревании с разбавленными кислотами целлюлоза подвергается гидролизу, образуя глюкозу:
Гидролиз целлюлозы также протекает постадийно.
В присутствии концентрированной серной кислоты с концентрированной азотной кислотой образует сложные эфиры - моно-, ди- и тринитроцеллюлозу:
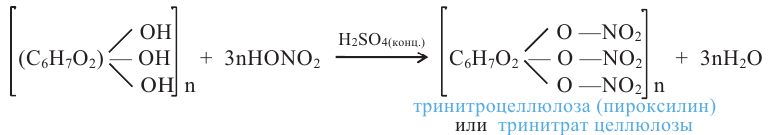
Тринитроцеллюлоза используется как мощное взрывчатое вещество и в изготовлении бездымного пороха. В технике продукт на основе тринитроцеллюлозы называют пироксилином, а на основе динитроцеллюлозы - коллоксилином. Из коллоксилина изготавливают коллодиум, применяемый в медицине, а из смеси коллоксилина с камфорой - целлулоид.
С уксусной кислотой или с уксусным ангидридом целлюлоза образует сложные эфиры - моно-, ди- и триацетилцеллюлозу. Они используются в производстве ацетатного шелка, негорючей фотопленки и органического стекла, пропускающего ультрафиолетовые лучи.
Из целлюлозы получают вискозный шелк и целлофан. Оба продукта по составу состоят из целлюлозы. Однако в отличие от обычной целлюлозы, в нитях вискозного шелка и в целлофане макромолекулы расположены в одном направлении. Это достигается в ходе ряда химических и физических превращений. При пропускании конечного раствора, называемого вискозой, через мелкие отверстия фильеры получают нити вискозного шелка, а через узкие длинные щели - целлофан.
Поскольку в составе целлюлозы отсутствует альдегидная группа, то она, как и крахмал, не вступает в реакцию "серебряного зеркала". Целлюлоза хорошо горит:
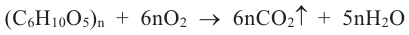
При сильном нагревании в отсутствии воздуха целлюлоза разлагается -подвергается пиролизу. При пиролизе образуются древесный уголь, вода и органические вещества - метан, метанол, уксусная кислота, ацетон и др. В виде льна и хлопка целлюлоза используется в производстве тканей. Большое ее количество расходуется на производство бумаги и этилового спирта.
Выводы:
- Большинство углеводов - природные полимеры с общей формулой Cn(H2O)m.
- Углеводы подразделяются на моносахариды, дисахариды и полисахариды.
- Моносахариды - углеводы, не подвергающиеся гидролизу.
- Дисахариды - углеводы, при гидролизе которых из одной молекулы образуются две молекулы моносахаридов.
- Полисахариды - углеводы, при гидролизе которых из одной молекулы образуется много молекул моносахарида.
- Окончание "-оза" в названии вещества означает его принадлежность к углеводам.
- Фруктоза и галактоза - изомеры глюкозы.
- В растворе глюкоза существует в форме пятиатомного альдегидоспирта, а также в
 и
и  циклических формах.
циклических формах. - Явление превращения
 и
и 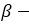 форм глюкозы друг в друга называется таутомерией, а
форм глюкозы друг в друга называется таутомерией, а 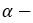 и
и 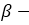 формы - таутомерами.
формы - таутомерами. - В кристаллическом состоянии глюкоза находится в циклической
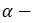 форме.
форме. - Под действием оксида серебра (I) или при слабом нагревании с гидроксидом меди (II) глюкоза окисляется в глюконовую кислоту.
- В щелочной среде глюкоза с гидроксидом меди (II) образует ярко-синий раствор сахарата меди (II).
- В зависимости от условий глюкоза подвергается брожению и превращается в этиловый спирт, масляную кислоту и молочную кислоту.
- Фруктоза - пятиатомный кетоноспирт; она не окисляется оксидом серебра (I) и гидроксидом меди (II).
- В молекуле сахарозы остатки
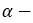 глюкозы и
глюкозы и 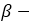 фруктозы соединены между собой гликозидной связью.
фруктозы соединены между собой гликозидной связью. - Сахароза не окисляется оксидом серебра (I) и гидроксидом меди (II).
- Мальтоза, лактоза, а также глюкоза, рибоза и дезоксирибоза относятся к восстанавливающим углеводам.
- Крахмал, целлюлоза и гликоген - полисахариды.
- Крахмал состоит из остатков
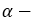 глюкозы, а целлюлоза -
глюкозы, а целлюлоза - 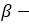 глюкозы.
глюкозы. - Макромолекулы крахмала имеют как разветвленное, так и неразветвлённое строение.
- Макромолекулы крахмала неразветвлённого строения называются амилозой, а разветвленного строения - амилопектином.
- В горячей воде крахмал образует крахмальный клейстер.
- Под действием йода крахмал окрашивается в синий цвет.
- Целлюлоза - биополимер неразветвлённого строения.
- Целлюлоза хорошо растворяется в растворе гидроксида меди (II) в аммиачной воде.
- Сложные эфиры целлюлозы находят широкое применение.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |