
Кипение жидкостей в физике - формулы и определение с примерами
Содержание:
Кипение жидкостей:
Вы уже знаете, что испарение жидкости без притока теплоты при любой температуре приводит к ее охлаждению. А как будет идти испарение, если жидкости непрерывно передавать энергию (теплоту)?
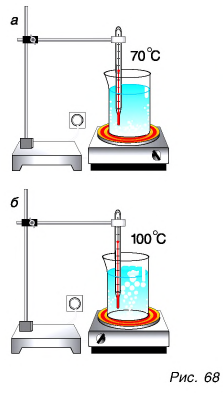
Проведем опыт. Поставим на электроплитку стакан с водой (рис. 68, а). По термометру будем следить за изменением температуры воды в стакане. Температура воды сначала растет. На дне стакана появляется множество маленьких пузырьков. Их размеры постепенно увеличиваются, так как вода испаряется внутрь пузырьков и давление пара в пузырьках при нагревании повышается. Пузырьки отрываются ото дна и стенок и движутся вверх. А что дальше? Если давление пара внутри пузырька больше, чем над жидкостью, то у поверхности он разрывается, и пар выходит наружу. При этом температура воды близка к 100 °C и практически не меняется. А все большее число пузырьков поднимается и лопается у поверхности, выбрасывая пар в атмосферу. Вода кипит (рис. 68, б).

Что такое кипение
Кипение — это процесс парообразования, идущий при постоянной температуре но всему объему жидкости. Действительно, любой пузырек можно рассматривать как сосуд с паром внутри жидкости (рис. 69). С поверхности его стенок идет испарение и обратный процесс — возврат молекул в жидкость, т. е. конденсация.
При кипении температура жидкости не меняется. По ведь энергия (от нагретой плитки) жидкостью поглощается. На что же она расходуется? Энергия, полученная жидкостью, идет на превращение ее в пар (газ), т. е. на преодоление сил притяжения между молекулами жидкости.

При обратном процессе — переходе пара в жидкость (рис. 70), или конденсации, это же количество энергии выделяется.
Температура, при которой происходит кипение жидкости, называется температурой кипения.
Температура кипения у разных жидкостей неодинакова. Это и понятно, ведь энергия взаимодействия их молекул тоже разная.
В таблице 4 приведены температуры кипения жидкостей при нормальном атмосферном давлении.
А случайно ли мы, говоря о температуре кипения жидкости, указываем давление? Нет, не случайно. Пузырьки кипящей жидкости лопаются при условии, что давление пара в них не меньше, чем давление снаружи. Значит, чем меньше внешнее давление, тем при более низкой температуре закипит жидкость.
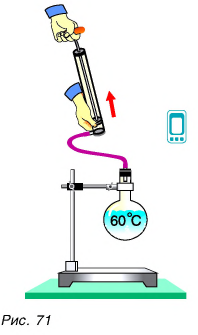
Подтвердим это опытом. Нальем в колбу теплой воды, температура которой t = 50—60 °C. Закроем колбу пробкой, подсоединенной к откачивающему насосу (рис. 71). Откачаем газ из колбы. Вода закипит, хотя ее температура меньше 100 °C. Ио это не значит, что в такой воде можно сварить яйцо. Яйцо варится не потому, что вода кипит, а потому, что она горячая.
А если в специальных условиях создать высокое давление над поверхностью воды, то в ней можно будет расплавить олово, но вода так и не будет кипеть. Объясните почему.


Зависимость температуры кипения от внешнего давления используется в практических целях. Например, для стерилизации медицинских инструментов их помещают в герметически закрытые камеры-автоклавы (рис. 72), вода в которых кипит при температуре значительно выше 100 °C. В быту используются кастрюли-скороварки (рис. 73), в которых температура кипения воды может повышаться до 120 °C. Поэтому пища в скороварках готовится гораздо быстрее, чем в обычных кастрюлях.
Вернемся к парообразованию. Чтобы превратить в пар 1 кг жидкости при температуре кипения, необходимо передать ей определенное количество теплоты. А если масса жидкости будет 2 кг? Значит, теплоты понадобится в 2 раза больше. А при превращении в пар m кг жидкости количество теплоты увеличится в m раз, т. е. количество теплоты, необходимое для парообразования, прямо пропорционально массе жидкости:
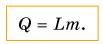
В этой формуле коэффициент L называется удельной теплотой парообразования:
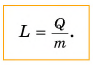
Как следует из формулы, единицей удельной теплоты парообразования в СИ является 1 джоуль на килограмм 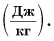
Удельная теплота парообразования есть физическая величина, численно равная количеству теплоты, поглощенному 1 кг жидкости при переходе ее в пар при температуре кипения.
Таблица 4. Температура кипения и удельная теплота парообразования некоторых жидкостей (при нормальном атмосферном давлении)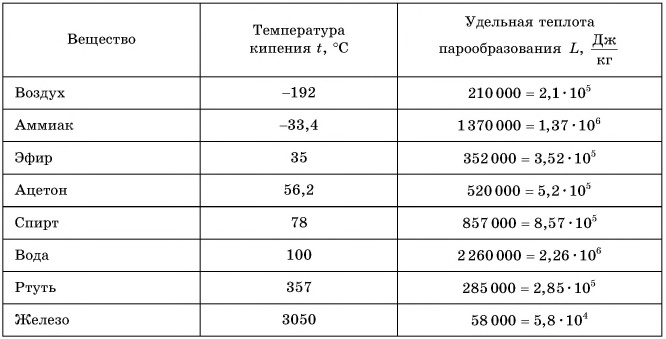
Удельная теплота парообразования различных жидкостей дана в таблице 4. Что значит 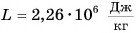 для воды? А это значит, что 1 кг воды при температуре 100 °C должен поглотить
для воды? А это значит, что 1 кг воды при температуре 100 °C должен поглотить 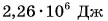 энергии (теплоты), чтобы перейти в газ (пар) с этой же температурой.
энергии (теплоты), чтобы перейти в газ (пар) с этой же температурой.
Можно сказать и иначе: 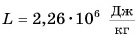 — это количество теплоты, которое выделится при конденсации 1 кг пара при температуре кипения (100 °C).
— это количество теплоты, которое выделится при конденсации 1 кг пара при температуре кипения (100 °C).
Главные выводы:
- Превращение жидкости в газ (пар) при постоянной температуре во всем объеме жидкости называют кипением.
- Температура кипения зависит от рода жидкости и внешнего давления.
- Чем выше давление над поверхностью жидкости, тем выше температура кипения.
- При кипении жидкость поглощает энергию, при конденсации пара выделяется равное количество энергии.
- Количество поглощенной при кипении тепловой энергии зависит от рода жидкости и ее массы.
Пример решения задачи
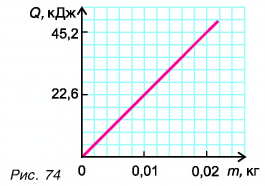
На рисунке 74 представлен график зависимости количества теплоты, идущего на парообразование некоторой жидкости, от ее массы. Какую массу олова можно расплавить, используя теплоту конденсации пара данной жидкости массой 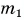 = 0,01 кг, взятого при температуре кипения? Температура олова t = 32 °C.
= 0,01 кг, взятого при температуре кипения? Температура олова t = 32 °C.
Дано:

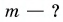
Решение
Из графика найдем модуль количества теплоты, которое выделится при конденсации пара массой 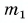 = 0,01 кг:
= 0,01 кг:
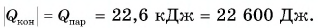
Для нагревания до температуры плавления 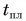 и плавления массы m олова необходимо количество теплоты
и плавления массы m олова необходимо количество теплоты
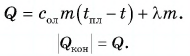
Откуда 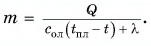
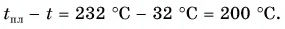
Тогда 
Ответ: m = 0,2 кг.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |