
Карбоновые кислоты в химии - свойства, формула, получение, номенклатура и определение с примерами
Содержание:
Карбоновые кислоты:
Карбоновыми кислотами называются органические соединения, содержащие в молекуле одну или несколько карбоксильных групп —СООН.
Карбоновые кислоты классифицируют в зависимости от строения углеводородной цепи и числа карбоксильных групп в молекуле.
В зависимости от строения углеводородной цепи различают кислоты алифатические насыщенные и ненасыщенные, алициклические и ароматические:
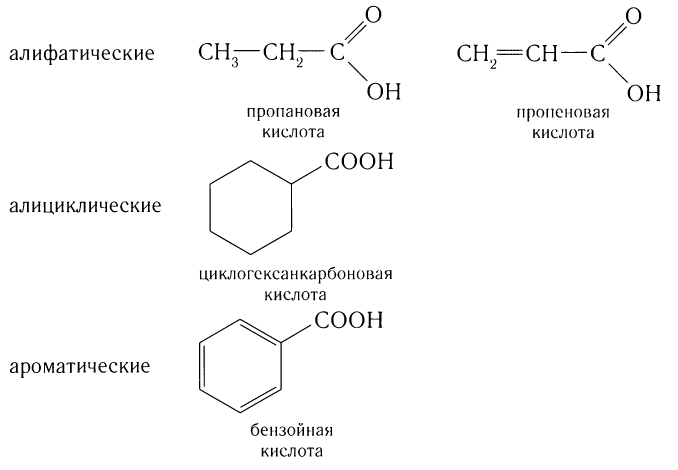
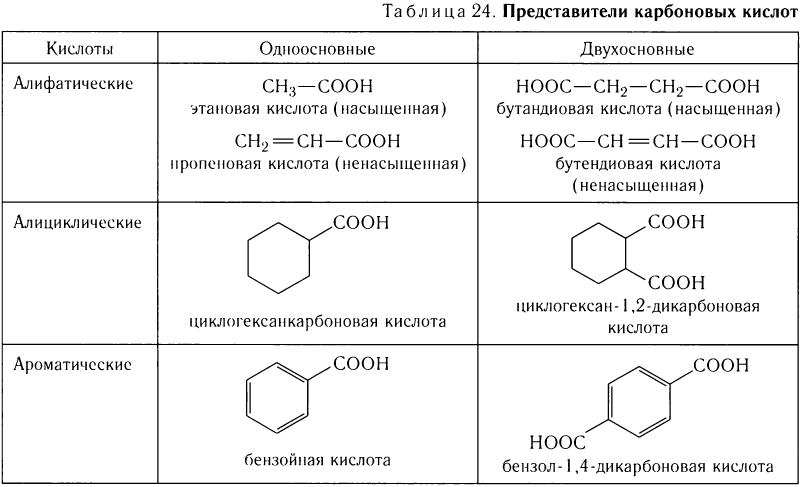
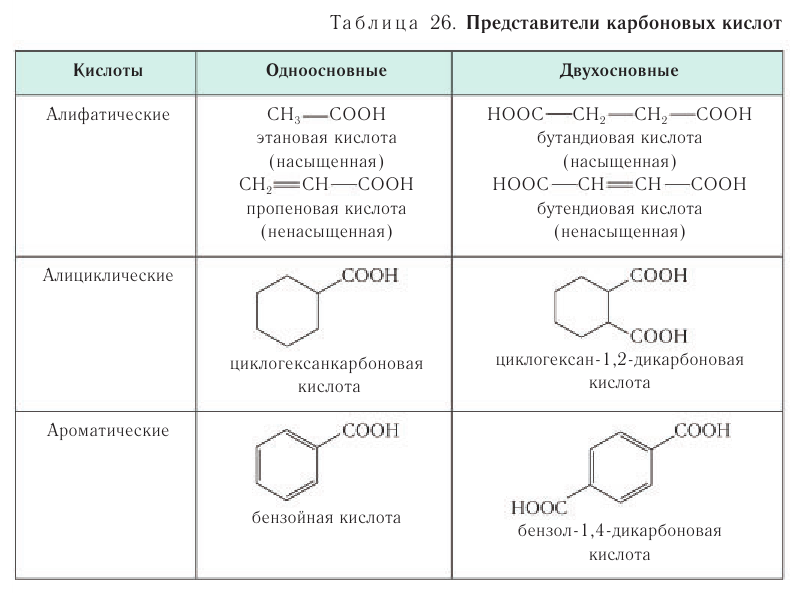
По числу карбоксильных групп карбоновые кислоты подразделяются па монокарбоновые, или одноосновные (содержат одну группу —СООН), дикарбоновые, или двухосновные (две группы —СООН), трикарбоновые и т. д. Формулы и названия нескольких представителей карбоновых кислот приведены в таблице 24
Карбоновые кислоты образуют различные функциональные производные при замещении гидроксильной группы. Общая формула таких производных карбоновых
кислот 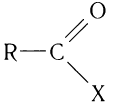 , где
, где 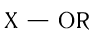 и др.
и др.
К функциональным производным карбоновых кислот относят сложные эфиры 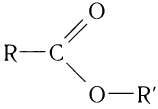
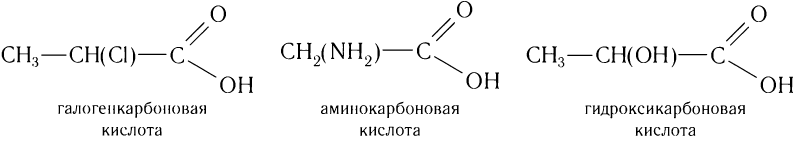
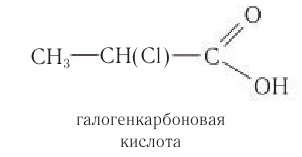
Карбоновые кислоты, у которых атомы водорода алкильной группы замещены на галоген, аминогруппу, гидроксильную группу и др., относят к замещенным карбоновым кислотам. Например:
Карбоновые кислоты и их производные встречаются в самых разнообразных природных объектах. Например, метановая (муравьиная) кислота НСООН содержится в выделениях муравьев; 3-метилбутановая (изовалериановая) кислота (СН3)2СН—СН2—СООН — в значительном количестве в корнях валерианы лекарственной; бензойная кислота С6Н5—СООН — в бруснике, клюкве, чернике, в различных растительных смолах; щавелевая кислота НООС—СООН — в виде оксалатов в листьях щавеля, ревеня, кислицы; малоновая кислота НООС—СН2—СООН — в соке сахарной свеклы: янтарная кислота НООС—(СН2)2—СООН впервые была выделена из продуктов сухой перегонки янтаря; яблочная кислота
- НООС—СН(ОН)—СН2—СООН — в ягодах и фруктах, особенно ее много в ягодах рябины; лимонная кислота
- НООС—СН2—С(ОН)(СООН)—СН2 — СООН — во многих растениях, в лимонном соке ее массовая доля 10 %.
В данном разделе предметом вашего изучения будут насыщенные одноосновные кислоты, а также некоторые представители ненасыщенных одноосновных карбо-новых кислот.
Органические соединения, содержащие карбоксильную группу —СООН, называют карбоновыми кислотами.
Карбоновые кислоты бывают одно-, двух-, трехосновные и т. д.; алифатические (насыщенные, ненасыщенные), алициклические, ароматические.
Функциональными производными карбоновых кислот называют соединения, в которых гидроксильная группа замещена на какую-либо иную группу или атом.
К функциональными производным карбоновых кислот относят сложные эфиры.
Насыщенные одноосновные карбоновые кислоты
Строение:
К насыщенным одноосновным карбоновым кислотам относятся органические соединения, в молекулах которых содержится одна функциональная группа 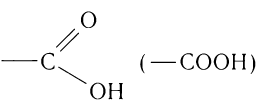 , соединенная
, соединенная
с алкильной группой (рис. 55) и только в случае метановой (муравьиной) кислоты НСООН — с атомом водорода.

Химический состав и строение насыщенных одноосновных кислот выражается общей формулой 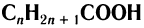 , или R—СООН, где R означает алкильную группу или атом водорода для метановой кислоты.
, или R—СООН, где R означает алкильную группу или атом водорода для метановой кислоты.
Общая формула насыщенных одноосновных карбоновых кислот
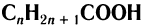 .
.
Общая формула, отражающая молекулярный состав данных кислот, 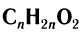 .
.
При решении целого ряда расчетных задач целесообразно обращаться именно к этой формуле.
Модели молекулы муравьиной кислоты показаны на рисунке 56.
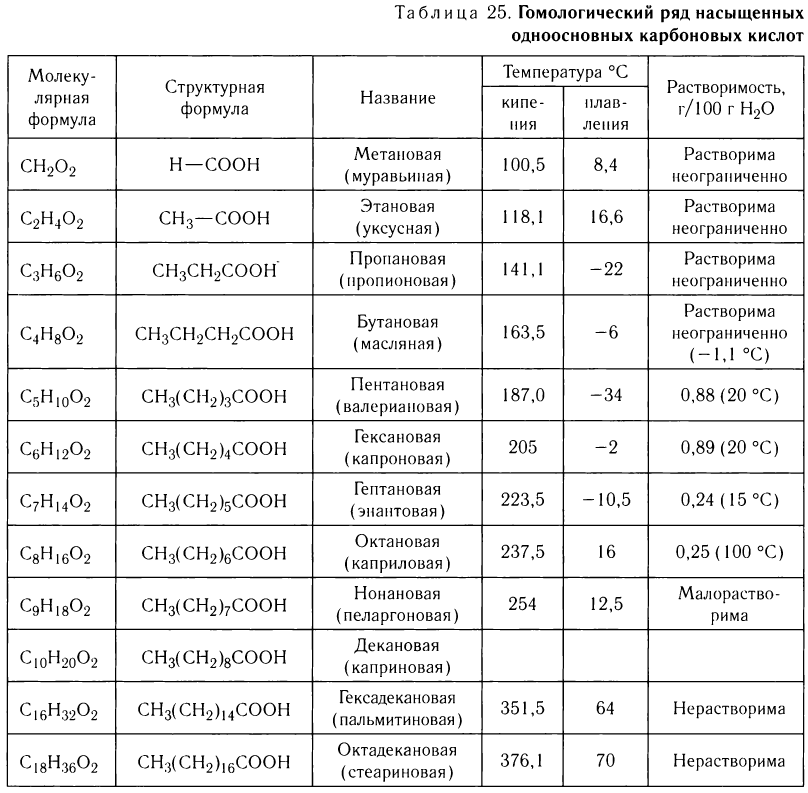
Молекулярные и структурные формулы десяти представителей гомологического ряда насыщенных одноосновных карбоновых кислот с неразветвленной цепью атомов углерода представлены в таблице 25.
Функциональная группа кислот получила название карбоксильная, потому что сочетает в себе карбонильную 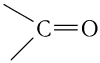 и гидроксильную —ОН группы. Электронная плотность в группе
и гидроксильную —ОН группы. Электронная плотность в группе 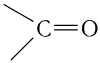 смещена в сторону атома кислорода в силу его высокой электроотрицательности. Вследствие этого на атоме углерода появляется частичный положительный заряд.
смещена в сторону атома кислорода в силу его высокой электроотрицательности. Вследствие этого на атоме углерода появляется частичный положительный заряд.
Компенсация возникающего положительного заряда происходит за счет смещения электронов неподеленной пары атома кислорода гидроксильной группы. Уменьшение электронной плотности на атоме кислорода гидроксильной группы приводит к смещению электронов связи  от водорода (рис. 57).
от водорода (рис. 57).
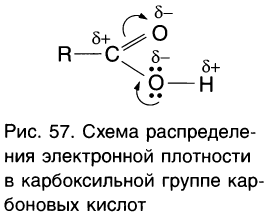
По этой причине химическая связь между атомами кислорода и водорода в гидроксильной группе становится более полярной, а атом водорода более подвижным, чем у спиртов. Поэтому карбо-новые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Номенклатура карбоновых кислот
По правилам номенклатуры ИЮПАК названия насыщенных одноосновных карбоновых кислот образуют добавлением к названию алкана с тем же числом атомов углерода суффикса -овая и слова «кислота». Например, НСООН — метановая кислота, СН3—СООН — этановая кислота.
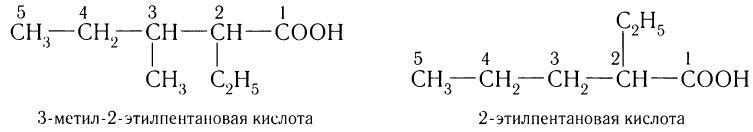
Названия кислот с разветвленной углеродной цепью алкильной группы производят в соответствии с уже известными вам правилами ИЮПАК. Например:
Для многих наиболее известных кислот употребляются тривиальные, исторически сложившиеся названия. Например, НСООН — муравьиная кислота, СН3СООН — уксусная кислота, СН3СН2СН2СООН — масляная кислота.
Изомерия карбоновых кислот
Для насыщенных одноосновных кислот, как и для альдегидов, характерна структурная изомерия, обусловленная изомерией углеродной цепи. Например:
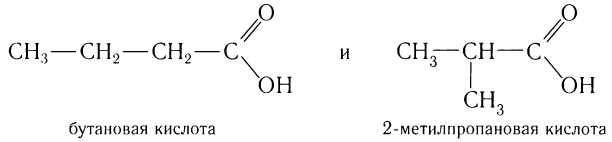
Первые три представителя гомологического ряда кислот — метановая, этановая, пропановая — изомеров кислот не имеют.
Физические свойства карбоновых кислот
Низшие насыщенные одноосновные кислоты (С1 — С9) представляют собой бесцветные жидкости, высшие кислоты — твердые вещества. Метановая, становая, пропановая кислоты обладают резким, раздражающим запахом. С водой они смешиваются в любых соотношениях. По мере увеличения длины алкилыюй группы кислот их растворимость в воде уменьшается.
Что касается температуры кипения кислот, то, как вы можете заметить (см. табл. 25), она значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода в молекуле. Такое явление объясняется тем, что насыщенные одноосновные кислоты в жидком состоянии образуют ассоциаты за счет межмолекулярных водородных связей (рис. 58). Для разрыва этих связей при переходе из жидкого состояния в газообразное требуется дополнительная энергия.
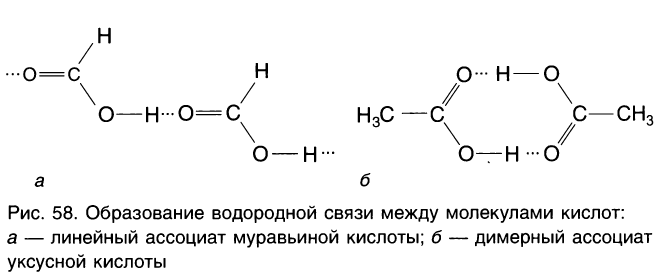
Ассоциаты могут быть линейными и циклическими (димеры). Прочность водородной связи такова, что метановая и этановая кислоты даже в газообразном состоянии существуют в виде димеров.
В природе существуют разнообразные карбоновые кислоты, которые можно классифицировать по типу углеводородной цепи и числу функциональных групп.
Химический состав и строение насыщенных одноосновных кислот выражается общей формулой 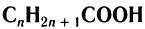 .
.
Дня насыщенных одноосновных карбоновых кислот характерна структурная изомерия, обусловленная изомерией углеродной цепи.
Кислоты в жидком состоянии образуют ассоциаты за счет межмолекулярных водородных связей.
Химические свойства насыщенных одноосновных карбоновых кислот
Химические свойства кислот обусловлены наличием в составе их молекул карбоксильной группы, содержащей при одном и том же атоме углерода карбонильную и гидроксильную группы, взаимно влияющие друг на друга.
1) Кислотные свойства.
Кислотные свойства насыщенных одноосновных кислот, как и кислотные свойства любых карбоновых кислот, связаны со способностью атома водорода карбоксильной группы отщепляться в виде протона. Подвижность атома водорода, как вам известно, обусловлена полярностью связи О — Н.
Растворимые в воде кислоты диссоциируют обратимо в водном растворе, например:
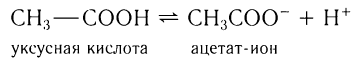
и потому изменяют окраску индикаторов, указывая на присутствие в растворе ионов водорода. Так, например, в водном растворе уксусной кислоты индикаторы — метиловый оранжевый и лакмус — изменяют окраску с оранжевой и фиолетовой на красную (рис. 59).
Рис. 59. Изменение окраски
индикаторов под действием
уксусной кислоты: а — лакмуса;
б — метилового оранжевого.
Степень диссоциации карбоновых кислот по сравнению с сильными неорганическими кислотами (серной, соляной) низкая. Карбоновые кислоты — слабые электролиты, только метановая кислота (муравьиная) является электролитом средней силы.
Кислотные свойства насыщенных одноосновных кислот проявляются прежде всего при их взаимодействии с сильными основаниями с образованием солей, т. е. в реакции нейтрализации:
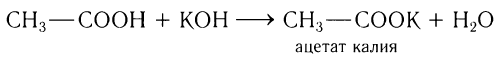
В органической химии используются как тривиальные названия солей карболовых кислот (ацетат калия), так и названия, образованные согласно правилам номенклатуры ИЮПАК. Такие названия складываются из названий аниона и катиона. Название аниона образуется путем замены в названии карбоновой кислоты суффикса -овая на -оат: СН3СООК — этаноат калия.
Кислотные свойства карбоновых кислот проявляются также в реакциях с некоторыми активными металлами (Mg, Са, А1), основными оксидами и солями более слабых кислот. Все реакции протекают с образованием солей карбоновых кислот:
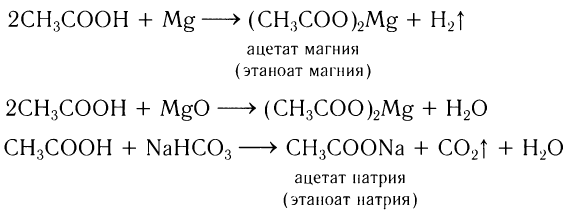
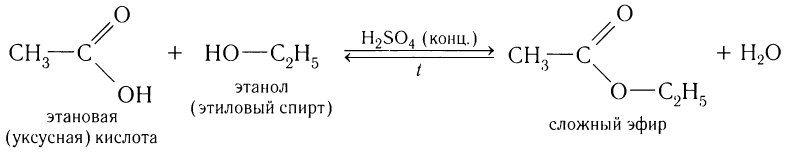
2)Взаимодействие со спиртами.
Карбоновые кислоты взаимодействуют со спиртами в присутствии сильных минеральных кислот с образованием сложных эфиров:
3)Реакция замещения атома водорода у 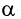 -углеродного атома на атом галогена.
-углеродного атома на атом галогена.
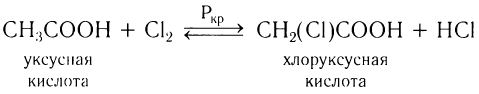
Карбоновые кислоты могут вступать в реакции замещения атома водорода у 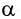 -углеродного атома на атом галогена в присутствии красного фосфора:
-углеродного атома на атом галогена в присутствии красного фосфора:
Химические свойства карбоновых кислот обусловлены в основном наличием в молекуле карбоксильной группы.
Кислотные свойства карбоновых кислот связаны со способностью атома водорода функциональной группы отщепляться в виде протона.
Кислотные свойства проявляются в реакциях с основаниями, некоторыми активными металлами, оксидами и солями более слабых кислот.
Дня карбоновых кислот возможны реакции получения таких функциональных производных кислот, как сложные эфиры.
Получение насыщенных одноосновных карбоновых кислот и их применение
Насыщенные одноосновные карбоновые кислоты, как спирты и альдегиды, получают промышленным и лабораторным способами.
Промышленные способы получения кислот:
1)Каталитическое окисление насыщенных углеводородов кислородом воздуха с образованием смеси карбоновых кислот:
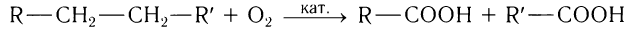
Уксусную кислоту получают при частичном окислении бутана в присутствии солей марганца и кобальта:
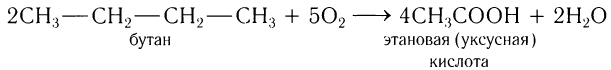
Данным способом в промышленности получают как низшие, так и высшие алифатические карбоновые кислоты. Сырьем для получения кислот служат различные фракции перегонки нефти, газы крекинга — алкены.
2)Уксусную кислоту также получают окислением кислородом уксусного альдегида в присутствии катализатора:
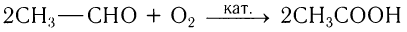
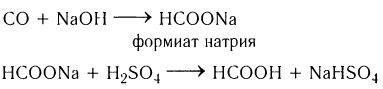
В промышленности метановую (муравьиную) кислоту получают специальным способом при взаимодействии оксида углерода(ІІ) с горячим раствором гидроксида натрия при повышенном давлении, образующаяся соль муравьиной кислоты под действием сильной минеральной кислоты превращается в муравьиную кислоту:
3)Высшие карбоновые кислоты, такие, как пальмитиновая, стеариновая, получают в результате гидролиза жиров.
Лабораторные способы получения кислот:
Первичные спирты и альдегиды окисляются в карбоновые кислоты. В этих реакциях в качестве окислителей могут использоваться перманганат калия, дихромат калия и др.:
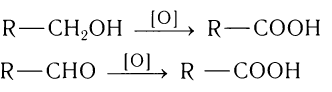
Применение карбоновых кислот:
Муравьиная кислота применяется в текстильной и кожевенной промышленности, а также для получения двухосновной щавелевой кислоты (НООС — СООН). Ее также применяют при обработке кожи, для получения лекарственных средств, средств защиты растений, консервантов.
Многие карбоновые кислоты используют для получения душистых веществ.
Уксусная кислота в виде раствора с массовой долей 3—6 % (столовый уксус) используется как пищевая приправа, консервант. Пищевую уксусную кислоту получают при микробиологическом окислении этанола.
Основная часть получаемой уксусной кислоты используется для производства искусственных волокон на основе целлюлозы. Применяется уксусная кислота в производстве эфиров (ацетатов), лекарственных средств (например, аспирина), красителей.
З-Метилбутановая кислота применяется для получения эфиров, входящих в состав лекарственного средства валидола.
Бензойная кислота С6Н5СООН используется как консервирующее средство, а также в производстве лекарственных средств, душистых веществ.
Высшие карбоновые кислоты (пальмитиновая и стеариновая) применяются для производства мыла различного назначения.
Источниками получения карбоновых кислот являются насыщенные углеводороды и их производные.
Уксусная кислота находит широкое применение в производстве искусственных волокон, в пищевой промышленности.
Ненасыщенные карбоновые кислоты
Акриловая кислота:
Простейшим представителем ненасыщенных одноосновных карбоновых кислот является кислота СН2 = СН— СООН, тривиальное название которой акриловая кислота (по номенклатуре ИЮПАК — пропеновая кислота).
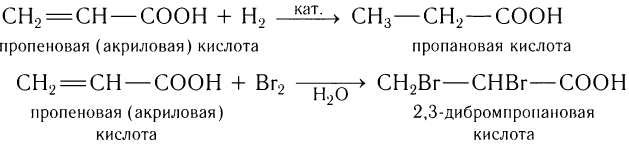
Для акриловой кислоты характерны все свойства карбоновых кислот и свойства алкенов. Она обесцвечивает водный раствор перманганата калия, способна к реакциям присоединения, например водорода (гидрирование), галогенов (обесцвечивает бромную воду):
Важнейшее свойство акриловой кислоты как непредельной кислоты — способность к полимеризации:
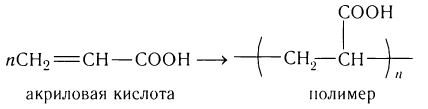
Акриловая кислота, ее гомолог метакриловая кислота
СН2С(СН3)—СООН и сложные эфиры утих кислот служат мономерами для получения полимерных материалов, таких, как органическое стекло, синтетические волокна (нитрон, ПАН).
Олеиновая кислота:
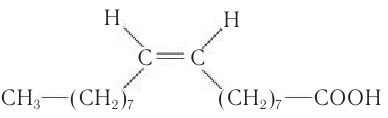
К высшим ненасыщенным одноосновным карбоновым кислотам, содержащим одну двойную связь, относится олеиновая кислота С17Н33СООН, структурная формула которой
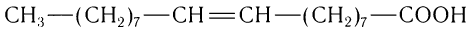
Двойная связь в углеводородной группе находится между 9-м и 10-м атомами углерода. Масштабная модель олеиновой кислоты показана на рисунке 61.
Олеиновая кислота — маслянистая жидкость, легче воды, без запаха, нерастворима в воде, но растворяется в органических растворителях. Она содержится почти во всех животных и растительных жирах в виде сложных эфиров глицерина и имеет двойную связь цыс-строения. В больших количествах остатки олеиновой кислоты содержатся в составе оливкового, миндального и подсолнечного масел.
Олеиновую кислоту выделяют гидролизом жидких жиров. Но основную ее массу получают каталитическим окислением углеводородов в присутствии катализатора — солей марганца.
Олеиновая кислота как представитель карбоновых кислот обладает всеми свойствами, присущими карбоновым кислотам. Олеиновая кислота, как уксусная кислота и ее гомологи, взаимодействует с некоторыми активными металлами, основаниями, солями более слабых кислот, спиртами. Уравнения таких реакций вы вполне можете составить самостоятельно по аналогии с насыщенными кислотами.
По месту двойной связи олеиновая кислота присоединяет водороде образованием кислоты насыщенного ряда — стеариновой:
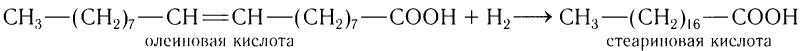
Реакция гидрирования олеиновой кислоты имеет большое промышленное значение и используется в производстве маргарина из жидких жиров.
По месту двойной связи к олеиновой кислоте (рис. 62, а) могут присоединяться галогены, например бром (рис. 62, б):
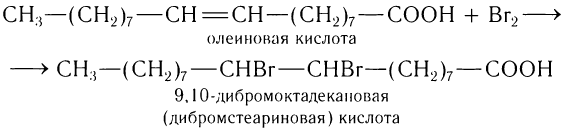
Олеиновая кислота в составе жиров является необходимой составляющей пищи человека. Применяется в производстве мыла, в текстильной промышленности (для обработки шерсти), при изготовлении типографских красок.
К высшим ненасыщенным кислотам с несколькими двойными связями в молекуле относятся линолевая С17Н31СООН и линоленовая С17Н29СООН кислоты. В молекуле линолевой кислоты две двойные связи:
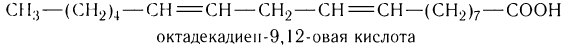
а в молекуле линоленовой кислоты три двойные связи:
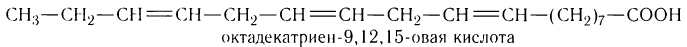
Остатки обеих кислот входят в состав жидких жиров. Потребление жиров, содержащих эти кислоты, необходимо для здоровья человека, так как они не синтезируются в организме. Большое практическое значение имеет сорбиновая кислота С5Н7СООН, в молекуле которой содержатся две двойные связи:
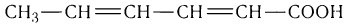
В природе сорбиновая кислота встречается в некоторых растениях, а выделена впервые была из ягод рябины в середине XIX в.
Сорбиновая кислота обладает бактерицидными свойствами и поэтому применяется в пищевой промышленности, в качестве консервирующего средства.
Существуют ненасыщенные одноосновные карбоновые кислоты с одной, двумя и более двойными связями.
Ненасыщенные кислоты сочетают в себе химические свойства карбоновых кислот и алкенов.
Олеиновая кислота используется в производстве маргарина. Она является важным компонентом питания человека, ее остатки в значительном количестве входят в состав жидких жиров.
Решение расчетных задач
В данном параграфе рассматриваются примеры решения таких типов расчетных задач, как вычисления по уравнениям реакций, протекающих в растворах, и определение молекулярных формул органических веществ на основании качественного и количественного состава для альдегидов и карбоновых кислот.
Пример 1. Определите массу соли, полученной при добавлении магния, взятого в избытке, к раствору уксусной кислоты массой 26 г с массовой долей кислоты 6 %.
Решение:
1)Общие формулы, используемые при расчетах, и молярные массы веществ:
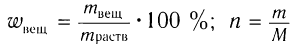 ;
;
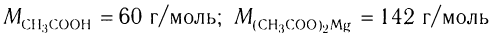 .
.
2)Определяем массу и химическое количество уксусной кислоты в растворе:
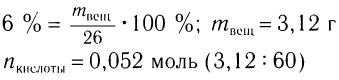
3)Исходя из анализа уравнения реакции, определяем химическое количество полученной соли:
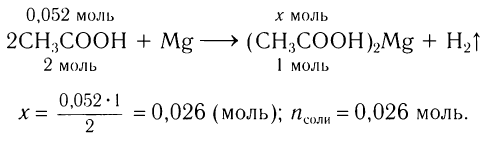
Определяем массу соли:
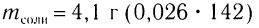 .
.
Ответ: 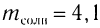 г.
г.
Пример 2. Рассчитайте массовую долю соли (%), полученной при добавлении к раствору уксусной кислоты массой 50 г с массовой долей кислоты 6 % раствора гидроксида натрия массой 40 г. Щелочи в растворе было достаточно для полной нейтрализации кислоты.
Решение:
1)Общие формулы, используемые при расчетах, и молярные массы веществ:
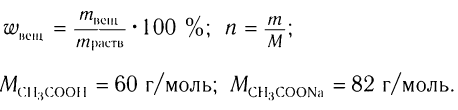
2)Определяем массу и химическое количество уксусной кислоты в растворе:
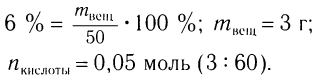
3)Исходя из анализа уравнения реакции, определяем химическое количество полученной соли, далее ее массу и массовую долю в новом растворе:
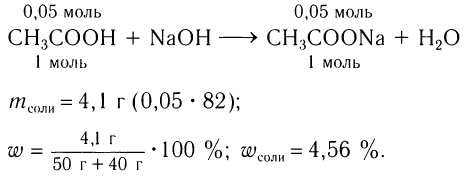
Ответ: 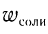 = 4,56 %.
= 4,56 %.
Пример 3. Определите молекулярную формулу алифатического насыщенного альдегида, в котором массовая доля кислорода равна 22,22 %.
Решение:
1)Для определения молекулярной формулы используем общую
формулу 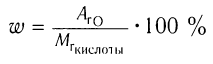 из расчета 1 моль альдегида,
из расчета 1 моль альдегида,
общая формула которого 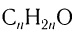 :
:
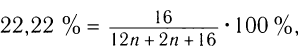
откуда 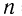 = 4
= 4
2)Следовательно, молекулярная формула альдегида С4Н8О.
Ответ: С4Н8О.
Пример 4. Определите формулу насыщенной одноосновной карбоновой кислоты, плотность паров которой по кислороду равна 2,75.
Решение:
1 )Для определения формулы кислоты используем общую формулу 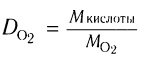 и общую формулу класса насыщенных кислот
и общую формулу класса насыщенных кислот 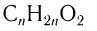 :
:

2)Следовательно, молекулярная формула насыщенной кислоты С4Н802, а химическая формула C3H7COOH.
Ответ: C3H7COOH.
Пример 5. Определите молекулярную формулу неизвестного альдегида, при восстановлении которого массой 7,308 г получили насыщенный одноатомный спирт массой 7,56 г.
Решение:
1)Проанализируем уравнение реакции восстановления альдегида:
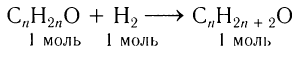
Это реакция присоединения. Разница масс альдегида и спирта 0,252 г и есть масса водорода, вступившего в реакцию. Химическое количество водорода равно 0,126 моль (0,252 : 2).
2)Согласно уравнению реакции химическое количество водорода равно химическому количеству альдегида. По формуле 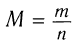 — определяем молярную массу альдегида:
— определяем молярную массу альдегида:
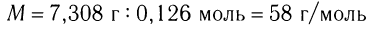 .
.
3)По общей формуле класса определяем формулу альдегида:
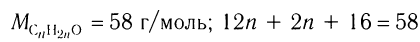 ,
,
откуда 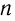 = 3.
= 3.
Следовательно, формула альдегида С3Н6О, или С2Н5СНО.
Ответ: С2Н5СНО.
Пример 6. Определите молекулярную формулу насыщенной одноосновной кар-боновой кислоты, при сжигании паров которой массой 18,5 г получили углекислый газ объемом (н. у.) 16,8 дм3 и воду массой 13,5 г.
Решение:
Первый способ.
1)Определяем химическое количество образовавшегося углекислого газа и воды и далее анализируем уравнение реакции горения, коэффициенты в котором поставлены из расчета, что сгорает 1 моль кислоты:
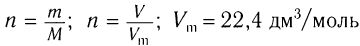 ;
;
тогда 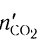 = 0,75 моль (16,8 : 22,4);
= 0,75 моль (16,8 : 22,4); 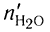 = 0,75 моль (13,5 = 18), откуда
= 0,75 моль (13,5 = 18), откуда
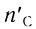 = 0,75 моль, а
= 0,75 моль, а 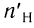 = 1,5 моль.
= 1,5 моль.
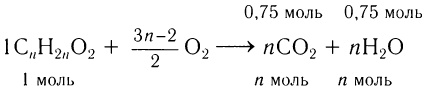
2)Определяем массы углерода и водорода, содержащихся в кислоте массой 18,5 г, а затем массу и химическое количество атомарного кислорода:
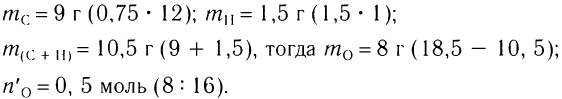
Определяем формулу карбоновой кислоты, исходя из общей формулы 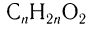 :
:
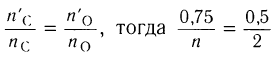 , откуда
, откуда 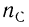 = 3.
= 3.
Следовательно, молекулярная формула карбоновой кислоты С3Н602.
Второй способ.
Анализируем уравнение реакции, исходя из массы сгоревших паров кислоты:
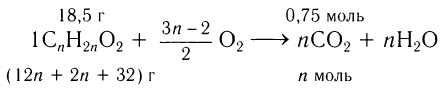
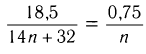 , откуда
, откуда 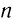 = 3
= 3
Следовательно, формула кислоты С3Н602.
Ответ: С3Н602.
Взаимосвязь между углеводородами, спиртами, альдегидами, карбоновыми кислотами
Изучая курс органической химии, вы познакомились со строением, химическими свойствами, способами получения важнейших представителей таких классов органических соединений, как углеводороды, спирты, фенолы, альдегиды, карбоновые кислоты. При этом вы, очевидно, отметили, что, изучая химические свойства веществ одного класса, вы знакомились со способами получения органических веществ другого класса.
Например, при окислении первичных насыщенных одноатомных спиртов образуются альдегиды:
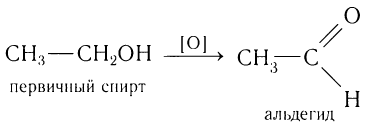
Рассматривая источники природного сырья, которые используются для синтеза многочисленных органических веществ, вы также отметили, что для осуществления многих реакций на производстве в качестве исходного сырья используют углеводороды. Природными источниками углеводородов являются нефть и фракции ее переработки, природный газ и попутные нефтяные газы.
Рассмотрим для примера, какие последовательные процессы можно осуществить при получении насыщенной одноосновной карбоновой кислоты из алканов. Сначала следует записать схему, отражающую последовательность возможных химических реакций. Например: алкан  галогеналкан
галогеналкан спирт
спирт альдегид
альдегид карбоновая кислота. Если исходным алканом будет этан, то конкретная схема получения карбоновой кислоты будет выглядеть так:
карбоновая кислота. Если исходным алканом будет этан, то конкретная схема получения карбоновой кислоты будет выглядеть так:
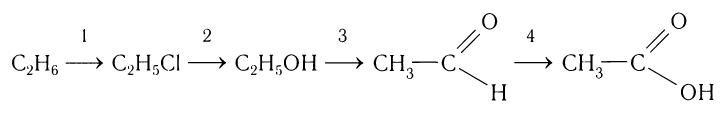
Составим уравнения химических реакций, иллюстрирующих процесс получения карбоновой кислоты, отметив условия течения реакций:
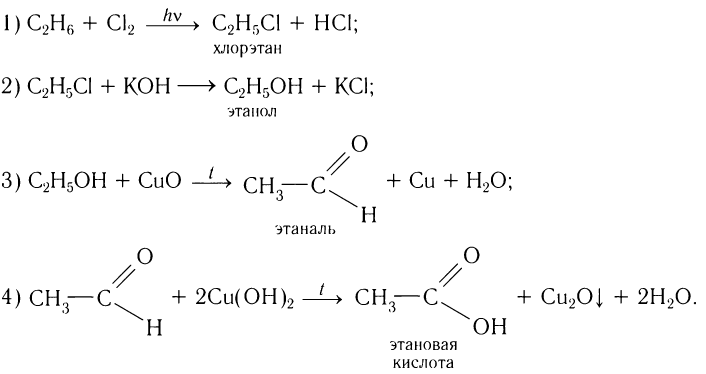
Естественно, что, для того чтобы практически осуществить подобные реакции, необходимы знания химических свойств веществ различных классов и условий практического осуществления реакций. Кроме того, чтобы решение проблемы получения продукта из имеющегося сырья было экономически выгодно, следует выбирать процесс с меньшим числом шагов (или производственных стадий). В данном случае хорошие знания химии и умение грамотно рассуждать позволят составить более короткую схему получения этановой кислоты из этана:
этан  этен
этен  этанол
этанол  этановая кислота,
этановая кислота,
или этан  этен
этен  этаналь
этаналь  этановая кислота.
этановая кислота.
Более того, знания химических свойств органических веществ позволяют при выполнении конкретной задачи подбирать такое исходное сырье, из которого продукт реакции получают еще с меньшим числом последовательных процессов. Так, например, этановую кислоту можно получить в одну стадию при каталитическом окислении бутана кислородом воздуха:
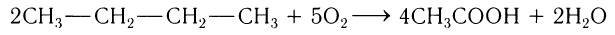
Процесс получения заданного органического вещества из конкретного сырья можно выразить, используя соответствующие общие формулы классов органических веществ. Такую связь можно представить в виде следующей схемы:
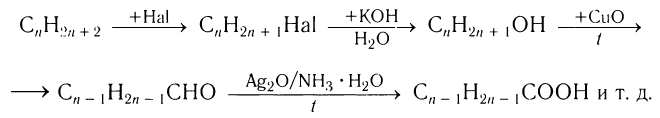
Разнообразные схемы взаимосвязи углеводородов и кислородсодержащих органических соединений представлены в перечне заданий после параграфа для самостоятельной работы. Выполняя предложенные задания, вы получите доказательства глубокой взаимной связи между различными классами органических соединений. Это поможет вам при дальнейшем изучении химии и будет способствовать пониманию сущности химических процессов.
На основе знаний о взаимосвязи между различными классами органических веществ люди научились получать тысячи разнообразных органических соединений, не только существующих в природе, но и не существующих, а также веществ с заранее определенными свойствами.
Карбоновые кислоты
Производные углеводородов, в которых один или несколько атомов водорода замещены на карбоксильную группу —СООН, называют карбоновыми кислотами.
Карбоновые кислоты классифицируют в зависимости от строения углеродного скелета и числа карбоксильных групп в молекуле.
В зависимости от строения углеродного скелета различают кислоты насыщенные, ненасыщенные, ароматические:
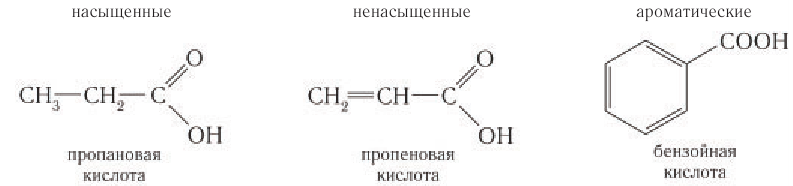
По числу карбоксильных групп карбоновые кислоты подразделяются на монокарбоновые, или одноосновные (содержат одну группу —СООН), дикарбоновые, или двухосновные (две группы —СООН), трикарбоновые и т. д. Формулы нескольких представителей карбоновых кислот различной основности приведены в таблице 26.
Карбоновые кислоты образуют различные функциональные производные при замещении гидроксильной группы, входящей в состав карбоксильной группы, на другие атомы или группы атомов. Общая формула таких производных карбоновых кислот 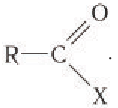
К функциональным производным карбоновых кислот относят ангидриды, хлорангидриды, амиды, сложные эфиры, соли:
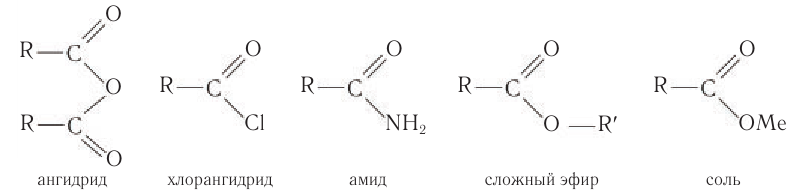
В данном курсе органической химии вы будете изучать строение и свойства только одного класса функциональных производных карбоновых кислот — сложных эфиров.
Карбоновые кислоты, у которых атомы водорода алкильной группы замещены на галоген, аминогруппу, гидроксильную группу и др., относят к замещенным карбоновым кислотам. Например:
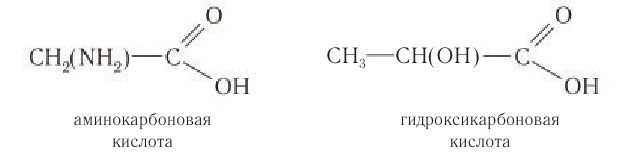
В данной главе предметом вашего изучения будут насыщенные одноосновные карбоновые кислоты, а также некоторые представители ненасыщенных одноосновных карбоновых кислот.
Карбоновыми кислотами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на карбоксильную группу.
Карбоновые кислоты бывают одно-, двух-, трехосновные и т.д.; насыщенные, ненасыщенные, ароматические.
Карбоновые кислоты образуют различные функциональные производные при замещении гидроксильной группы, входящей в состав карбоксильной группы, на какую-либо иную группу или атом.
Насыщенные одноосновные карбоновые кислоты
Строение: К насыщенным одноосновным карбоновым кислотам относятся производные насыщенных углеводородов (алканов), в молекулах которых один атом водорода замещен на карбоксильную группу-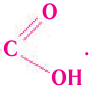
Химическое строение насыщенных одноосновных карбоновых кислот выражается общей формулой 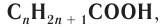 или
или 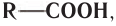 где R — насыщенный заместитель или атом водорода для простейшей метановой кислоты НСООН.
где R — насыщенный заместитель или атом водорода для простейшей метановой кислоты НСООН.
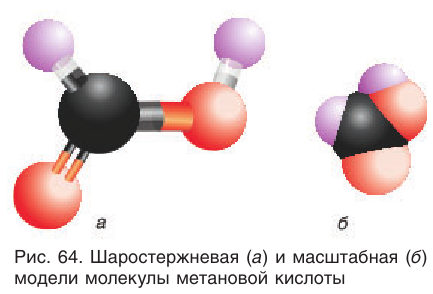
Модели молекулы метановой кислоты показаны на рисунке 64.
Общая формула, отражающая молекулярный состав данных кислот, — 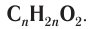
Формулы нескольких членов гомологического ряда насыщенных одноосновных карбоновых кислот нормального строения приведены в таблице 27. Рассмотрим электронное строение карбоксильной группы. Функциональная группа карбоновых кислот-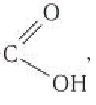 определяющая их химические свойства, состоит из связанных между собой карбонильной и гидроксильной групп. Взаимное влияние карбонильной и гидроксильной групп приводит к существенному перераспределению электронной плотности. В силу этого карбоновые кислоты проявляют особые свойства, отличающиеся от свойств этих групп
определяющая их химические свойства, состоит из связанных между собой карбонильной и гидроксильной групп. Взаимное влияние карбонильной и гидроксильной групп приводит к существенному перераспределению электронной плотности. В силу этого карбоновые кислоты проявляют особые свойства, отличающиеся от свойств этих групп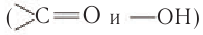 в альдегидах и спиртах. Электронная плотность связи
в альдегидах и спиртах. Электронная плотность связи  смещена в сторону более электроотрицательного атома кислорода. При этом на атоме кислорода образуется избыток карбоновых кислот (
смещена в сторону более электроотрицательного атома кислорода. При этом на атоме кислорода образуется избыток карбоновых кислот ( ), а на атоме углерода недостаток (
), а на атоме углерода недостаток ( ) электронной плотности. Компенсация возникающего положительного заряда на атоме углерода происходит за счет смещения электронов неподеленной пары атома кислорода гидроксильной группы. Уменьшение электронной плотности на атоме кислорода гидроксильной группы приводит к смещению электронов
) электронной плотности. Компенсация возникающего положительного заряда на атоме углерода происходит за счет смещения электронов неподеленной пары атома кислорода гидроксильной группы. Уменьшение электронной плотности на атоме кислорода гидроксильной группы приводит к смещению электронов 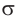 -связи
-связи 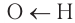 от водорода к кислороду. По этой причине химическая связь между атомами кислорода и водорода в гидроксильной группе становится более полярной, что приводит к возрастанию кислотных свойств, причем гораздо более сильному, чем в спиртах и феноле.
от водорода к кислороду. По этой причине химическая связь между атомами кислорода и водорода в гидроксильной группе становится более полярной, что приводит к возрастанию кислотных свойств, причем гораздо более сильному, чем в спиртах и феноле.
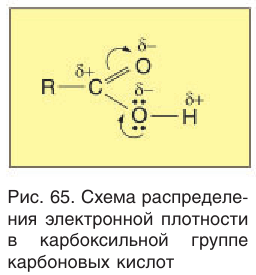
Схема распределения электронной плотности в карбоксильной группе, обусловленного взаимным влиянием карбонильной и гидроксильной групп, приведена на рисунке 65.
Номенклатура: По правилам номенклатуры ИЮПАК названия насыщенных одноосновных карбоновых кислот образуют добавлением к названию алкана с тем же числом атомов углерода суффикса -овая и слова «кислота». Например, НСООН — метановая кислота, 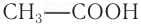 — этановая кислота.
— этановая кислота.
Названия кислот с разветвленным углеродным скелетом алкильной группы производят в соответствии с уже известными вам правилами ИЮПАК. Нумерация главной цепи начинается с атома углерода карбоксильной группы, заместители записываются в алфавитном порядке. Например:
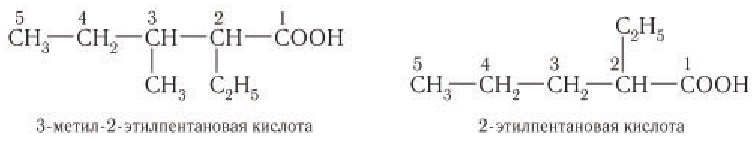
Для многих наиболее известных кислот употребляются тривиальные, исторически сложившиеся названия. Например, 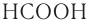 — муравьиная кислота,
— муравьиная кислота, 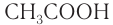 — уксусная кислота,
— уксусная кислота, 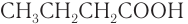 — масляная кислота.
— масляная кислота.
В таблице 27 приведены названия нескольких представителей гомологического ряда насыщенных одноосновных карбоновых кислот с неразветвленной цепью атомов углерода по номенклатуре ИЮПАК, и тривиальные.
Таблица 27. Гомологический ряд насыщенных одноосновных карбоновых кислот нормального строения
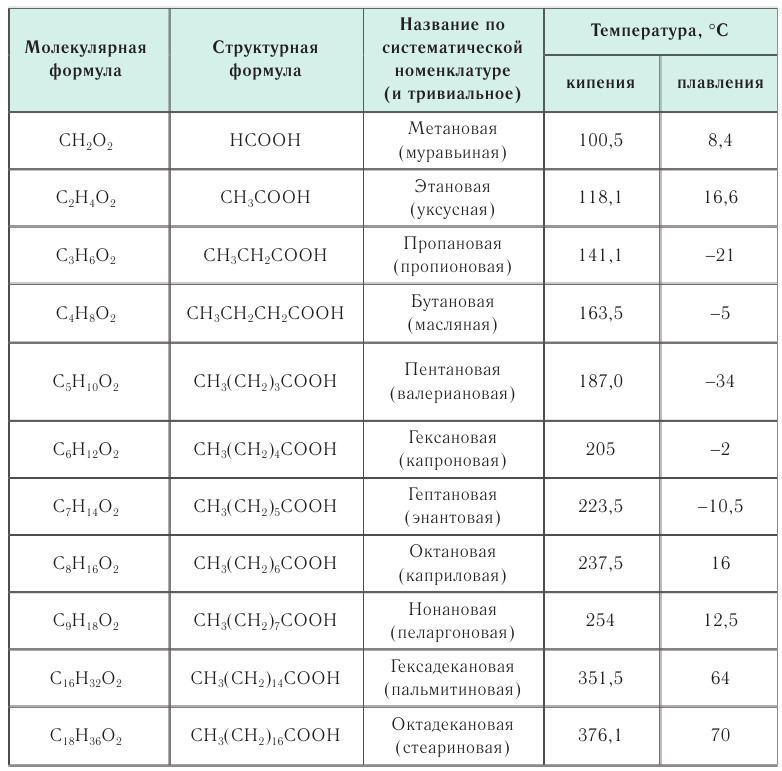
Изомерия: Для насыщенных одноосновных карбоновых кислот, как и для альдегидов, характерна структурная изомерия, обусловленная изомерией углеродного скелета. Например:
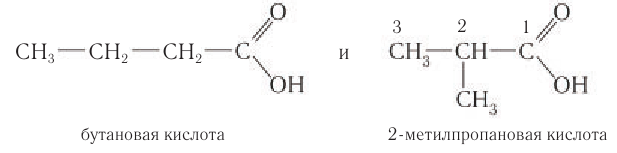
Первые три представителя класса насыщенных одноосновных карбоновых кислот — метановая, этановая, пропановая — изомеров не имеют.
Физические свойства: В отличие от альдегидов среди насыщенных одноосновных карбоновых кислот нет газообразных веществ. Низшие представители класса насыщенных одноосновных карбоновых кислот  — бесцветные жидкости с характерным резким запахом. Безводная уксусная кислота при комнатной температуре представляет собой жидкость, при 17°С она замерзает, превращаясь в льдистое вещество, которое называют ледяной уксусной кислотой.
— бесцветные жидкости с характерным резким запахом. Безводная уксусная кислота при комнатной температуре представляет собой жидкость, при 17°С она замерзает, превращаясь в льдистое вещество, которое называют ледяной уксусной кислотой.
Кислоты, содержащие в молекуле 4 — 9 атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; высшие кислоты, содержащие девять и более атомов углерода в молекуле, — твердые вещества, нерастворимые в воде. Низшие представители класса хорошо растворяются в воде. С увеличением молярной массы растворимость кислот в воде понижается.
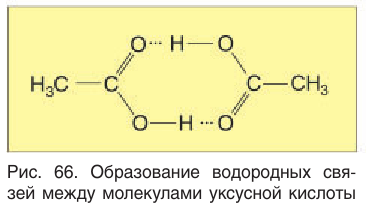
Температуры кипения кислот, как вы можете заметить (см. табл. 27), значительно выше температур кипения спиртов и альдегидов с тем же числом атомов углерода в молекуле. Такое явление объясняется тем, что насыщенные одноосновные карбоновые кислоты в жидком состоянии образуют циклические димеры, в которых две молекулы кислоты связаны двумя водородными связями (рис. 66). Для разрыва этих связей при переходе из жидкого состояния в газообразное требуется дополнительная энергия.
Водородная связь в карбоновых кислотах сильнее, чем в спиртах. Это объясняется высокой полярностью карбонильной группы. Прочность водородной связи такова, что метановая и этановая кислоты даже в парообразном состоянии существуют в виде димеров.
Производные насыщенных углеводородов (алканов), в молекулах которых один атом водорода замещен на карбоксильную группу, называют насыщенными одноосновными карбоновыми кислотами.
Общая формула насыщенных одноосновных карбоновых кислот 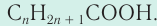
Для насыщенных одноосновных карбоновых кислот характерна структурная изомерия, обусловленная изомерией углеродного скелета.
Кислоты в жидком состоянии образуют циклические димеры за счет межмолекулярных водородных связей.
Химические свойства насыщенных одноосновных карбоновых кислот
Химические свойства карбоновых кислот обусловлены наличием в составе их молекул карбоксильной группы, содержащей при одном и том же атоме углерода карбонильную и гидроксильную группы, взаимно влияющие друг на друга.
Кислотные свойства
Кислотные свойства насыщенных одноосновных карбоновых кислот, как и кислотные свойства любых карбоновых кислот, связаны со способностью атома водорода карбоксильной группы отщепляться в виде протона под действием оснований, реакции протекают с разрывом связи 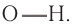 Подвижность атома водорода, как вам известно, обусловлена более высокой, чем в спиртах и феноле, полярностью связи
Подвижность атома водорода, как вам известно, обусловлена более высокой, чем в спиртах и феноле, полярностью связи 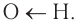
Растворимые в воде кислоты диссоциируют обратимо в водном растворе, например:
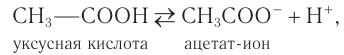
поэтому изменяют окраску индикаторов, указывая на присутствие ионов водорода. Так, например, в водном растворе уксусной кислоты индикаторы — метиловый оранжевый и лакмус — изменяют окраску с оранжевой и фиолетовой на красную. По степени диссоциации только метановая (муравьиная) кислота является электролитом средней силы. Остальные карбоновые кислоты относят к слабым электролитам, степень диссоциации которых с увеличением молярной массы понижается. Степень диссоциации карбоновых кислот по сравнению с сильными неорганическими кислотами (серной, соляной) низкая.
Кислотные свойства насыщенных одноосновных карбоновых кислот проявляются прежде всего при их взаимодействии с сильными основаниями с образованием солей:
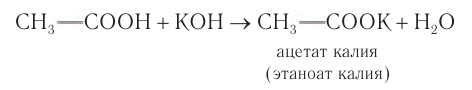
В органической химии используются как тривиальные названия солей карбоновых кислот (ацетат калия), так и названия, образованные согласно правилам номенклатуры ИЮПАК. Такие названия складываются из названий аниона и катиона. Название аниона образуется путем замены в названии карбоновой кислоты суффикса -овая на -оат: 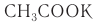 — этаноат калия.
— этаноат калия.

Кислотные свойства насыщенных одноосновных карбоновых кислот проявляются также в реакциях с некоторыми активными металлами 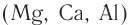 (рис. 67), основными оксидами и солями более слабых кислот. Все реакции протекают с образованием солей карбоновых кислот:
(рис. 67), основными оксидами и солями более слабых кислот. Все реакции протекают с образованием солей карбоновых кислот:
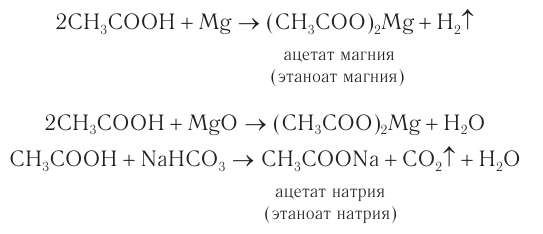
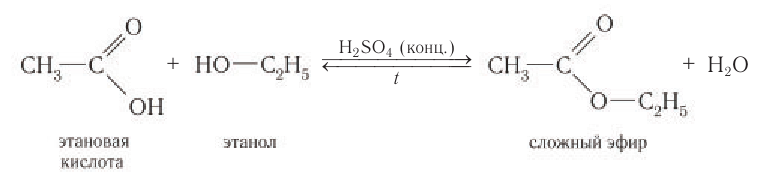
Взаимодействие со спиртами
Характерной и одной из важнейших реакций карбоновых кислот является реакция этерификации (от лат. acfher — эфир) — взаимодействие со спиртами в присутствии сильных минеральных кислот с образованием производных карбоновых кислот — сложных эфиров. Строение и свойства сложных эфиров описаны в следующей главе учебника.
Так, если в пробирку с этановой кислотой прилить этанол, затем добавить небольшое количество серной кислоты и смесь нагревать, то вскоре появляется приятный запах нового вещества — сложного эфира. Реакция протекает с разрывом связи  в карбоксильной группе:
в карбоксильной группе:
Реакция замещения атома водорода у 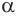 -углеродного атома на атом галогена
-углеродного атома на атом галогена
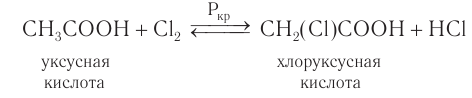
Насыщенные одноосновные карбоновые кислоты могут вступать в реакции замещения атома водорода у 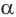 -углеродного атома на атом галогена в присутствии красного фосфора с образованием галогензамещенной карбоновой кислоты:
-углеродного атома на атом галогена в присутствии красного фосфора с образованием галогензамещенной карбоновой кислоты:
Метановая кислота, в отличие от других представителей класса, имеет особые химические свойства, обусловленные ее строением. В составе молекулы метановой кислоты имеется альдегидная группа:
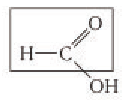
Поэтому кислота, как и альдегиды, — сильный восстановитель. Она дает реакцию серебряного зеркала.
Химические свойства насыщенных одноосновных карбоновых кислот обусловлены в основном наличием в молекуле карбоксильной группы.
Кислотные свойства карбоновых кислот проявляются в реакциях с основаниями, некоторыми активными металлами, основными оксидами и солями более слабых кислот.
Для насыщенных одноосновных карбоновых кислот характерна реакция этерификации с образованием функциональных производных кислот — сложных эфиров.
Получение и применение насыщенных одноосновных карбоновых кислот
Получение: Насыщенные одноосновные карбоновые кислоты, как спирты и альдегиды, получают промышленными и лабораторными способами.
Промышленные способы.
1) Каталитическое окисление насыщенных углеводородов состава 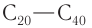 кислородом воздуха с образованием смеси карбоновых кислот:
кислородом воздуха с образованием смеси карбоновых кислот:
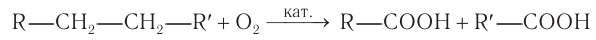
Только уксусную кислоту получают при частичном окислении бутана в присутствии солей марганца и кобальта:
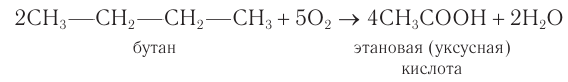
2) Уксусную кислоту также получают при окислении уксусного альдегида кислородом воздуха в присутствии катализатора:
Мировое производство уксусной кислоты только для непищевых целей составляет около 4 млн т в год.
Одним из способов получения уксусной кислоты является аэробное сбраживание вина. Брожение протекает под действием бактерий (Micoderma aceti), которые находятся в воздухе. Получаемая таким способом уксусная кислота используется в пищевой промышленности.
Способ получения уксуса из вина люди знали еще за 2000 лет до н.э.
В промышленности метановую (муравьиную) кислоту получают специальным способом. При взаимодействии оксида углерода(II) с расплавом гидроксида натрия при повышенном давлении образуется соль муравьиной кислоты, которую под действием сильной минеральной кислоты переводят в муравьиную кислоту:
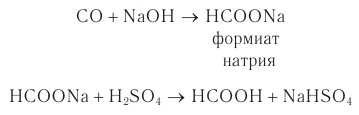
Мировое производство муравьиной кислоты составляет около 250 тыс. т в год.
3) Высшие карбоновые кислоты, такие как пальмитиновая, стеариновая, получают в результате гидролиза жиров.
Лабораторные способы. Первичные спирты и альдегиды окисляют подкисленными растворами пер-манганата или дихромата калия и др.:
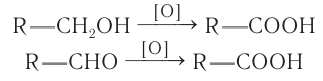
Применение. Широкое применение в народном хозяйстве находят метановая и этановая кислоты.
Метановая (муравьиная) кислота обладает дезинфицирующими свойствами, поэтому применяется в кожевенной и фармацевтической промышленности, а также как консервант пищевых продуктов и кормов для скота. Ее используют для синтеза некоторых лекарственных средств, сложных эфиров и других органических веществ, при крашении тканей и бумаги. На свойстве муравьиной кислоты легко окисляться основано ее применение в технике в качестве восстановителя.
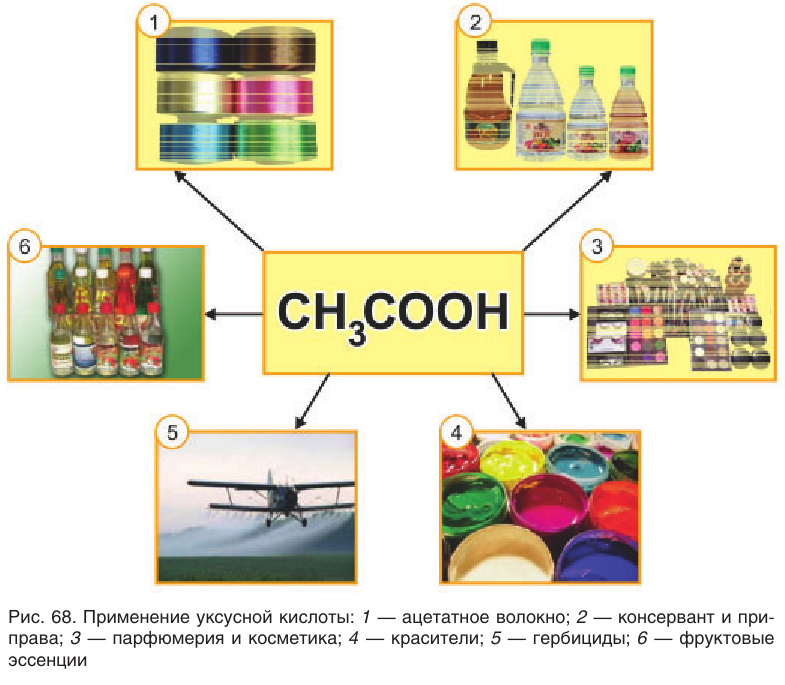
Наиболее широкое применение из всех карбоновых кислот имеет этановая (уксусная) кислота (рис. 68). Большая часть производимой уксусной кислоты используется в химической промышленности при производстве искусственных волокон, в частности ацетатного волокна, а также в производстве красителей (например, индиго), лекарственных соединений (например, аспирина), душистых веществ. Уксусная кислота и ее производные сложные эфиры являются хорошими растворителями многих органических веществ, поэтому применяются при крашении в кожевенном производстве, в лакокрасочной промышленности. Уксусная кислота как консервант широко используется в пищевой промышленности.
Высшие насыщенные карбоновые кислоты являются исходными веществами для синтеза разнообразных органических соединений. Соли высших кислот используются для некоторых промышленных целей, а натриевые и калиевые соли стеариновой и пальмитиновой кислот — для производства мыла.
В промышленном масштабе уксусную кислоту получают при окислении бутана и уксусного альдегида кислородом воздуха в присутствии катализатора, а также микробиологическим окислением этанола.
Карбоновые кислоты применяются в производстве искусственных волокон, в пищевой, лакокрасочной, кожевенной и многих других отраслях промышленности.
Ненасыщенные одноосновные карбоновые кислоты
В органической химии изучают разнообразные ненасыщенные карбоновые кислоты — производные ненасыщенных углеводородов (алкенов, алкадиенов, алкинов и др.). В данном параграфе вы познакомитесь с двумя представителями ненасыщенных одноосновных карбоновых кислот — производных алкенов, имеющих большое значение в жизнедеятельности человека.
Общая формула ненасыщенных одноосновных карбоновых кислот с одной двойной связью в углеводородном заместителе — 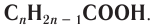 Для этих карбоновых кислот характерны такие же виды изомерии, как для алкенов: изомерия углеродного скелета, положения двойной связи, цис-транс-изомерия.
Для этих карбоновых кислот характерны такие же виды изомерии, как для алкенов: изомерия углеродного скелета, положения двойной связи, цис-транс-изомерия.
Химические свойства ненасыщенных одноосновных карбоновых кислот обусловлены наличием в их молекулах карбоксильной группы и двойной связи в углеводородном заместителе. Реакции с участием карбоксильной группы — это реакции, характерные для всех карбоновых кислот, реакции с участием ненасыщенного углеводородного заместителя — это реакции присоединения, окисления, полимеризации.
Акриловая кислота
Простейшим представителем ненасыщенных одноосновных карбоновых кислот с одной двойной связью в углеводородном заместителе является кислота 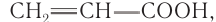 тривиальное название которой акриловая кислота (по номенклатуре ИЮПАК — пропеновая кислота).
тривиальное название которой акриловая кислота (по номенклатуре ИЮПАК — пропеновая кислота).
Акриловая кислота — бесцветная жидкость с резким запахом, растворимая в воде и органических растворителях. Она обладает химическими свойствами, присущими карбоновым кислотам: взаимодействует с активными металлами, основаниями, солями более слабых кислот с образованием солей, со спиртами с образованием сложных эфиров. Уравнения таких реакций по аналогии с насыщенными карбоновыми кислотами вы можете составить самостоятельно. Будучи ненасыщенной кислотой, акриловая кислота вступает в реакции присоединения, характерные для алкенов. Наиболее важными из реакций присоединения являются гидрирование и галогенирование. В результате гидрирования акриловой кислоты образуется насыщенная пропановая кислота:
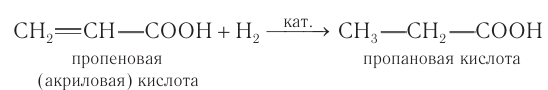
Если прилить к акриловой кислоте бромную воду, то происходит ее обесцвечивание и образование дибромпропановой кислоты:
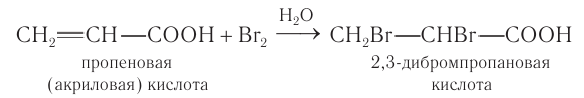
Так же, как и алкены, акриловая кислота легко реагирует с окислителями. При нриливании к ней разбавленного раствора перманганата калия фиолетовая окраска раствора исчезает.
Важнейшее свойство акриловой кислоты как ненасыщенной кислоты — способность к полимеризации.
Акриловая кислота, ее гомолог метакриловая кислота 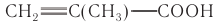 и сложные эфиры этих кислот служат мономерами для получения полимерных материалов, таких как органическое стекло, синтетические волокна (нитрон, ПАН).
и сложные эфиры этих кислот служат мономерами для получения полимерных материалов, таких как органическое стекло, синтетические волокна (нитрон, ПАН).
Акриловая кислота — важное в промышленном отношении вещество. Она применяется в производстве полиакриловой кислоты, ионообменных смол, сложных эфиров, метил- и этилакрилатов и др.
Олеиновая кислота
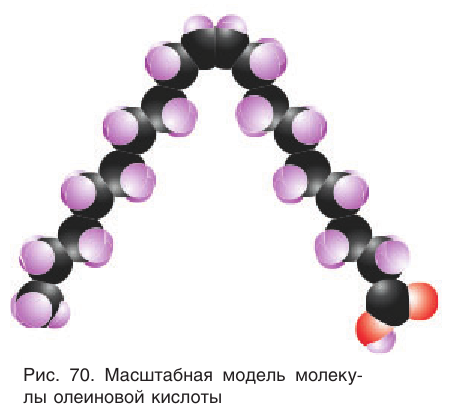
Одним из важнейших представителей высших ненасыщенных одноосновных карбоновых кислот является олеиновая кислота 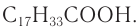 Двойная связь в углеводородной цени олеиновой кислоты находится между девятым и десятым атомами углерода. Олеиновая кислота — цис-изомер:
Двойная связь в углеводородной цени олеиновой кислоты находится между девятым и десятым атомами углерода. Олеиновая кислота — цис-изомер:
Масштабная модель молекулы олеиновой кислоты показана на рисунке 70.
Олеиновая кислота — маслянистая жидкость, легче воды, без запаха, нерастворима в воде, но растворяется в органических растворителях. Она содержится почти во всех животных и растительных жирах в виде сложных эфиров глицерина. В больших количествах остатки олеиновой кислоты содержатся в составе оливкового, миндального и подсолнечного масел.
Транс-изомер ненасыщенной одноосновной карбоновой кислоты 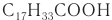 — твердое вещество и называется элаидиновой кислотой.
— твердое вещество и называется элаидиновой кислотой.
Как представитель карбоновых кислот олеиновая кислота обладает всеми свойствами, присущими карбоновым кислотам. Она, как уксусная кислота и ее гомологи, взаимодействует с некоторыми активными металлами, основаниями, солями более слабых кислот, спиртами. Уравнения таких реакций вы вполне можете составить самостоятельно по аналогии с насыщенными карбоновыми кислотами.
Для олеиновой кислоты как ненасыщенной карбоновой кислоты характерны реакции ненасыщенных углеводородов — реакции присоединения.
По двойной связи олеиновая кислота присоединяет водороде образованием кислоты насыщенного ряда — стеариновой:
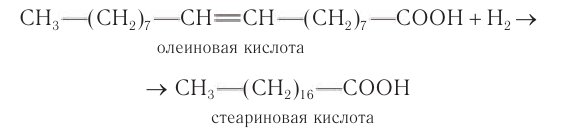
Реакция гидрирования олеиновой кислоты имеет большое промышленное значение и используетея в производстве маргарина из жидких жиров.
По двойной связи также проходит присоединение галогенов. Например, в реакции с бромом (рис. 71) образуется бромзамещенная насыщенная карбоновая кислота:

Олеиновую кислоту выделяют гидролизом жидких жиров. Но основную ее массу получают каталитическим окислением углеводородов в присутствии катализатора — солей марганца.
Олеиновая кислота является необходимым компонентом пищи человека. Применяется в производстве мыла, в текстильной промышленности (для обработки шерсти), при изготовлении типографских красок.

К важнейшим высшим ненасыщенным кислотам относятся линолевая 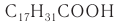 и линоленовая
и линоленовая 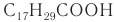 кислоты, которые, как и олеиновая кислота, являются цис-изомерами.
кислоты, которые, как и олеиновая кислота, являются цис-изомерами.
В молекуле линолевой кислоты две двойные связи:
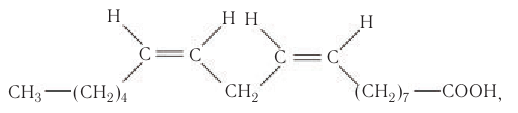
а в молекуле линоленовой кислоты три двойные связи:
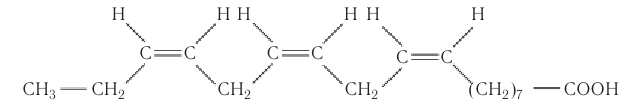
Обе эти кислоты содержатся в большом количестве в жидких жирах в виде сложных эфиров глицерина.
Линолевая и линоленовая кислоты так же, как и олеиновая кислота, являются необходимыми компонентами пищи человека.
Акриловая и олеиновая кислоты являются представителями ненасыщенных одноосновных карбоновых кислот и обладают двойственной химической функцией — карбоновых кислот и ненасыщенных углеводородов.
Олеиновая кислота — важнейший компонент пищи человека, она в значительных количествах (в виде остатков) содержится в жидких жирах.
Решение расчетных задач
В данном параграфе рассматриваются примеры решения расчетных задач на вычисление по уравнениям реакций, протекающих в растворах, и определение молекулярных формул органических веществ на основании качественного и количественного состава для альдегидов и карбоновых кислот.
Пример 1. К раствору уксусной кислоты объемом 43,9 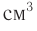 (плотность 1,026
(плотность 1,026 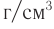 ) с массовой долей кислоты, равной 20 %, добавили магний, взятый в избытке. Рассчитайте химическое количество выделившегося водорода.
) с массовой долей кислоты, равной 20 %, добавили магний, взятый в избытке. Рассчитайте химическое количество выделившегося водорода.
Решение
1. Общие формулы, используемые при расчетах, и молярные массы веществ:
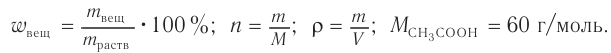
2. Определяем химическое количество уксусной кислоты в растворе:
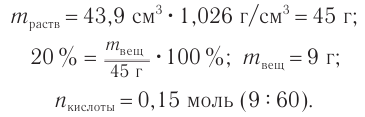
3. По уравнению реакции определяем химическое количество водорода:
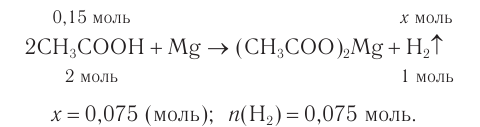
Ответ: 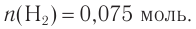
Пример 2. К раствору уксусной кислоты массой 30 г с массовой долей кислоты 0,12 прилили раствор гидроксида натрия массой 10 г с массовой долей щелочи 0,2. Рассчитайте массовую долю (%) образовавшейся в реакции соли.
Решение
1. Общие формулы, используемые при расчетах, и молярные массы веществ:
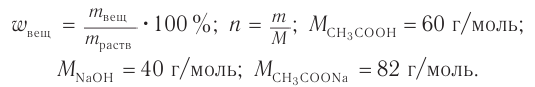
2. Определяем массу и химическое количество кислоты и щелочи в растворах:
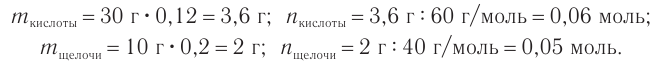
3. По уравнению реакции определяем, какое из веществ взято в избытке, а затем рассчитываем массу и массовую долю соли в растворе:
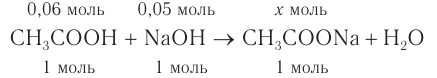
Уксусная кислота взята в избытке, следовательно, химическое количество соли равно 0,05 моль.
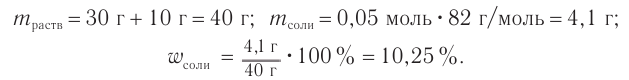
Ответ: 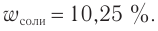
Пример 3. Массовая доля углерода в составе насыщенного альдегида равна 0,667. Определите молекулярную формулу альдегида, составьте структурную формулу с неразветвленной углеводородной цепью и приведите названия альдегида по номенклатуре ИЮПАК и тривиальное.
Решение
1. Общая формула альдегидов — 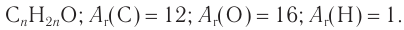 Относительная молекулярная масса альдегида:
Относительная молекулярная масса альдегида:
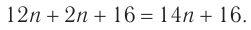
2. По формуле 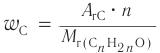 определяем число атомов углерода в молекуле:
определяем число атомов углерода в молекуле: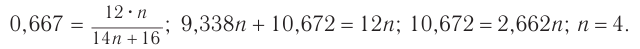
Следовательно, молекулярная формула альдегида — 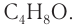 .
.
3. Структурная формула альдегида нормального строения — 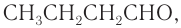 это бутаналь (масляный альдегид).
это бутаналь (масляный альдегид).
Ответ: 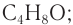 бутаналь (масляный альдегид).
бутаналь (масляный альдегид).
Пример 4. Определите молекулярную формулу насыщенной одноосновной карбоновой кислоты, молярная масса которой в 2,522 раза больше молярной массы метановой кислоты. Составьте структурные формулы трех изомерных кислот и назовите их по номенклатуре ИЮПАК.
Решение
1. Рассчитаем молярную массу неизвестной кислоты:
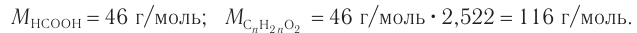
2. Исходя из общей формулы насыщенных одноосновных карбоновых кислот 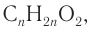 рассчитаем число атомов углерода в молекуле кислоты:
рассчитаем число атомов углерода в молекуле кислоты:
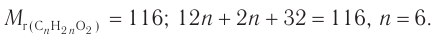
Молекулярная формула кислоты — 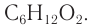
3. Данному составу могут соответствовать следующие изомеры карбоновых насыщенных кислот:
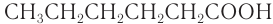 — гексановая кислота;
— гексановая кислота;
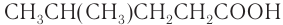 — 4-метилпентановая кислота;
— 4-метилпентановая кислота;
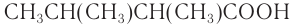 — 2,3-диметилбутановая кислота.
— 2,3-диметилбутановая кислота.
Ответ: 
Пример 5. Насыщенный одноатомный спирт массой 13,32 г получен при восстановлении неизвестного насыщенного альдегида массой 12,96 г. Определите молекулярную формулу альдегида и укажите число возможных изомеров альдегидов данного состава.
Решение
1. Проанализируем уравнение реакции восстановления альдегида, составленное в общем виде:
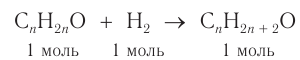
Это реакция присоединения. Разница масс альдегида и спирта 0,36 г и есть масса водорода, вступившего в реакцию. Химическое количество водорода равно:
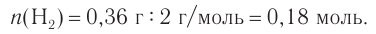
2. Согласно уравнению реакции химическое количество водорода равно химическому количеству альдегида и равно 0,18 моль.
По формуле 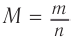 определяем молярную массу альдегида:
определяем молярную массу альдегида:
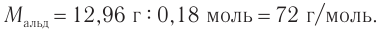
3. По общей формуле класса 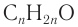 определяем формулу альдегида:
определяем формулу альдегида:
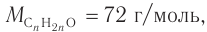 следовательно,
следовательно, 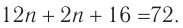
Решаем уравнение и определяем, что 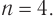
Молекулярная формула альдегида — 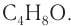
Для альдегидов данного состава существуют два изомера.
Ответ: 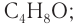 два изомера.
два изомера.
Взаимосвязь между углеводородами, спиртами, альдегидами, карбоновыми кислотами
Вы познакомились с важнейшими представителями нескольких классов углеводородов и кислородсодержащих функциональных производных углеводородов. При этом вы убедились, что все рассмотренные классы углеводородов и кислородсодержащих функциональных производных углеводородов — спирты, альдегиды, карбоновые кислоты — связаны взаимными переходами. Из насыщенных углеводородов (алканов) могут быть получены ненасыщенные углеводороды (алкены, алкины, алкадиены); из циклоалканов — ароматические; ненасыщенные углеводороды превращаются в насыщенные.

Николай Дмитриевич Зелинский
(1861—1953)
Российский химик-органик. Открыл каталитическое превращение циклопарафинов в ароматические углеводороды, каталитический крекинг углеводородов нефти, синтез бензола из ацетилена на активированном угле. Изобрел универсальный противогаз.
Известные вам взаимные переходы между углеводородами можно свести в следующую общую схему:
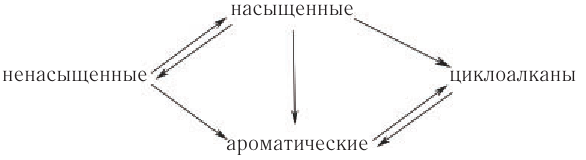
В исследовании взаимных превращений углеводородов основополагающее значение имеют работы русского ученого Н. Д. Зелинского и его научной школы.
Рассмотрим, какие реакции необходимо провести, чтобы получить из насыщенного углеводорода (например, метана) галогенопроизводное ароматического углеводорода (бромбензол):
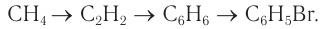
Вы знаете, что ацетилен можно получить в реакции метана с дозированным количеством кислорода. Далее при пропускании ацетилена через нагретый активированный уголь синтезируется бензол, из которого в реакции с бромом в присутствии специального катализатора образуется бромбензол.
Между различными классами углеводородов, спиртами, альдегидами и карбоновыми кислотами также существуют взаимные переходы (рис. 72). Изучая способы получения насыщенных одноатомных спиртов, вы проследили связь между углеводородами и спиртами. Углеводороды можно превратить в галогенопроизводные, а из галогенопроизводных получить спирты. Спирты можно получать и в процессе гидратации алкенов. Исходя из спиртов, можно получить альдегиды, а из альдегидов — карбоновые кислоты. Таким образом, все рассмотренные классы органических соединений — от углеводородов до карбоновых кислот — находятся в тесной взаимосвязи.
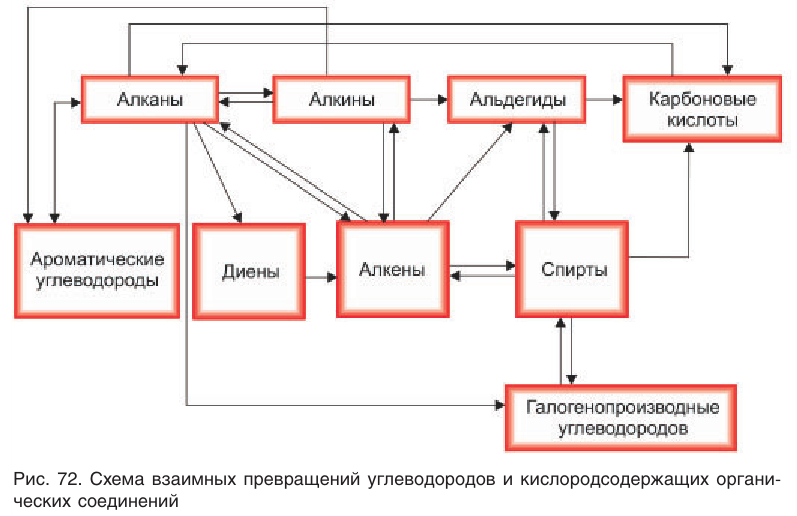
Вместе с тем спирты, альдегиды и карбоновые кислоты можно рассматривать как продукты последовательного окисления углеводородов. Если сравним массовую долю кислорода в составе этанола 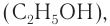 этаналя
этаналя 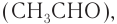 этановой кислоты
этановой кислоты 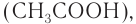 то увидим, что она возрастает.
то увидим, что она возрастает.
Рассмотрим для примера, какие переходы можно осуществить, чтобы получить уксусную кислоту из углеводородов. Если исходным веществом для синтеза взят этан, то возможны следующие превращения:
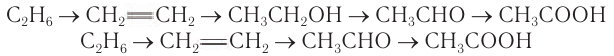
Если исходным веществом для синтеза кислоты является бутан, то получить кислоту можно в одну стадию:
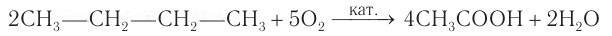
Чем меньше стадий требуется для получения продукта на производстве, тем производство является экономически более выгодным. При исследовании взаимных переходов углеводородов и кислородсодержащих органических веществ в лабораторных условиях ученые стремятся выявить все возможные переходы между веществами различных классов.
Схемы взаимных превращений углеводородов, спиртов, альдегидов и карбоновых кислот приведены в заданиях для самостоятельной работы после параграфа. Выполняя предложенные задания, вы получите доказательства существования взаимной связи между различными классами органических соединений. Это поможет вам при дальнейшем изучении химии и будет способствовать пониманию сущности химических процессов.
Между углеводородами и кислородсодержащими функциональными производными углеводородов существуют взаимные переходы.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |