
Изменение агрегатного состояния вещества - основные понятия, формулы и определения с примерами
Содержание:
Изменение агрегатного состояния вещества:
Приходилось ли вам бывать в морозный зимний день на берегу быстрой горной речки? Вокруг лежит снег, замерли деревья, покрытые сияющим в солнечных лучах инеем, а вода в речке не замерзает. Очень чистая, прозрачная, она течет, разбиваясь об обледенелые камни. В чем отличие воды и льда? Почему появился иней?
Агрегатное состояние вещества
Вы уже знаете, что лед (снег, иней) и вода — это разные агрегатные состояния воды: твердое и жидкое. Появление инея на деревьях объясняется так: в воздухе всегда есть водяной пар, который, охлаждаясь, кристаллизуется и оседает в виде инея. Водяной пар — это третье агрегатное состояние воды — газообразное.
Приведем еще пример. Вы, наверное, знаете об опасности разбить термометр с ртутью — густой жидкостью серебристого цвета; ртуть, испаряясь, образует очень ядовитый пар. А вот при температуре ниже –39 °С ртуть представляет собой твердый металл. То есть ртуть, как и вода, может находиться в твердом, жидком и газообразном состояниях.
Практически любое вещество в зависимости от физических условий может находиться в трех агрегатных состояниях — твердом, жидком, газообразном.
Существует еще одно агрегатное состояние вещества — плазма — частично или полностью ионизированный газ, то есть газ, который состоит из заряженных частиц (ионов и электронов), а также нейтральных атомов и молекул. Например, ртуть пребывает в плазменном состоянии во включенных ртутных лампах (так называемые лампы дневного света). Во Вселенной плазма является самым распространенным состоянием вещества (рис. 10.1).

Рис. 10.1. Вещество в недрах звезд находится в состоянии плазмы. Разреженной плазмой заполнено и межзвездное пространство
Водяной пар, вода, лед образованы одинаковыми молекулами, — молекулами воды. Почему же различаются физические свойства веществ, образованных одинаковыми молекулами, но находящихся в разных агрегатных состояниях? Причина в том, что молекулы по-разному движутся и взаимодействуют.
Физические свойства твердых тел
Тела, изображенные на рис. 10.2, различаются цветом, формой и т. п., они состоят из разных веществ. Вместе с тем они имеют общие физические свойства, присущие всем твердым телам.

Рис. 10.2. Несмотря на множество отличий, все твердые тела сохраняют объем и форму
Твердые тела сохраняют объем и форму. Дело в том, что частицы (молекулы, атомы, ионы) твердых тел находятся в положениях равновесия. В этих положениях силы притяжения и силы отталкивания между частицами равны. При попытке увеличить или уменьшить расстояние между частицами (то есть увеличить или уменьшить размер тела) возникает соответственно межмолекулярное притяжение или отталкивание. Кроме того, частицы твердых тел практически не перемещаются — они только непрерывно колеблются.
В большинстве твердых веществ частицы расположены в четком порядке, то есть образуют кристаллическую решетку. Такие вещества называют кристаллическими. Примеры кристаллических веществ: алмаз, графит (рис. 10.3), лед, соль (рис. 10.4), металлы и т. д.
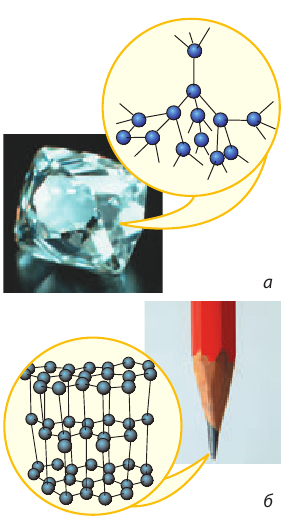
Рис. 10.3. Модели кристаллических решеток: а — алмаза, б — графита. Шариками изображены атомы Карбона. На самом деле атомы расположены плотно, а линий, соединяющих атомы, не существует (они проведены только для того, чтобы продемонстрировать характер пространственного расположения атомов)
Порядок расположения частиц в кристаллической решетке определяет физические свойства вещества. Так, алмаз и графит состоят из одних и тех же атомов Карбона, но эти вещества сильно отличаются, поскольку в них по-разному расположены атомы (см. рис. 10.3).
Существует группа твердых веществ (стекло, воск, смола, янтарь и др.), частицы которых не образуют кристаллическую решетку и в целом расположены беспорядочно. Такие вещества называют аморфными.
При определенных условиях твердые тела плавятся, то есть переходят в жидкое состояние. Каждое кристаллическое вещество плавится при определенной температуре. В отличие от кристаллических, аморфные вещества не имеют определенной температуры плавления — они переходят в жидкое состояние, постепенно размягчаясь. Подробнее о плавлении твердых тел вы узнаете из § 11.
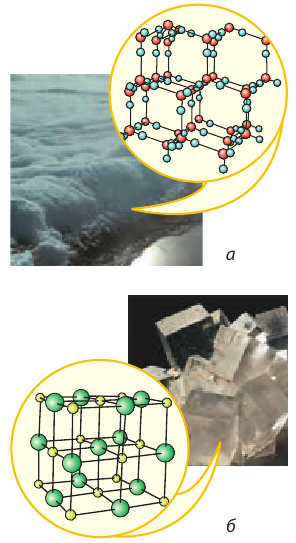
Рис. 10.4. Модели кристаллических решеток: а — льда (Н2О — молекула воды: красные шарики — атомы Оксигена, синие — атомы Гидрогена); б — поваренной соли (желтые шарики — ионы Натрия, зеленые — ионы Хлора)
Физические свойства жидкостей
Жидкость изменяет свою форму, приобретая форму того сосуда, в котором находится; сохраняет объем (рис. 10.5); является практически несжимаемой. Эти свойства жидкости можно объяснить так.

Рис. 10.5. В жидком состоянии вещество сохраняет свой объем, но приобретает форму сосуда, в котором находится
Как и в твердых телах, частицы в жидкостях расположены вплотную друг к другу (рис. 10.6). Такая плотная «упаковка» частиц является причиной не только сохранения объема жидкостей, но и того, что жидкости практически невозможно сжать.
Каждая частица жидкости в течение некоторого времени (порядка 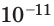 с) осуществляет движение, подобное колебательному, не удаляясь при этом от своих «соседей»; затем она вырывается из своего окружения и перескакивает в другое место, где попадает в новое окружение и снова некоторое время колеблется около своего положения равновесия. Перепрыгивания (переходы) молекул из одного равновесного состояния в другое происходят преимущественно в направлении внешней силы, поэтому жидкость текуча — под воздействием внешних сил она приобретает форму сосуда, в котором находится.
с) осуществляет движение, подобное колебательному, не удаляясь при этом от своих «соседей»; затем она вырывается из своего окружения и перескакивает в другое место, где попадает в новое окружение и снова некоторое время колеблется около своего положения равновесия. Перепрыгивания (переходы) молекул из одного равновесного состояния в другое происходят преимущественно в направлении внешней силы, поэтому жидкость текуча — под воздействием внешних сил она приобретает форму сосуда, в котором находится.
Физические свойства газов
Слово «газ» происходит от греческого «хаос» — беспорядок. В самом деле, для газообразного состояния вещества характерно полное отсутствие порядка во взаимном расположении и движении частиц.
Частицы газа расположены на расстояниях, которые в десятки и сотни раз превышают размеры самых частиц. На таких расстояниях частицы практически не взаимодействуют, поэтому они разлетаются и газ занимает весь предоставленный ему объем. Большими расстояниями между частицами объясняется и тот факт, что газы легко сжимаются.
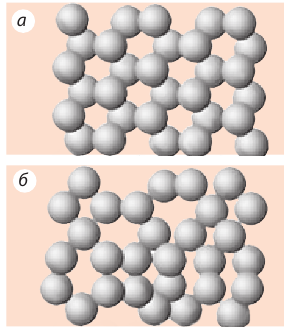
Рис. 10.6. Характер расположения частиц: а — в твердых кристаллических веществах; б — в жидкостях и аморфных веществах (частицы в целом расположены хаотично, однако в малом объеме вещества сохраняется некоторая взаимная ориентация соседних частиц — существует ближний порядок)
Чтобы понять, как движутся молекулы и атомы газа, представим движение одной частицы. Вот она движется в некотором направлении, сталкивается с другой частицей, изменяет направление и скорость своего движения и летит дальше, до следующего столкновения (рис. 10.7).
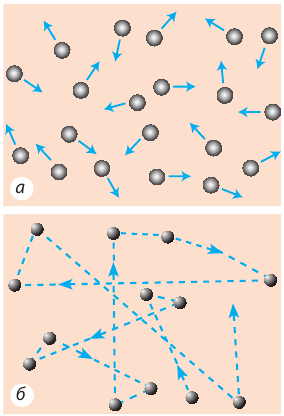
Рис. 10.7. Движение и расположение частиц газа: а — направление движения частиц изменяется в результате столкновений с другими частицами; б — приблизительная траектория движения частицы
Чем больше частиц в данном объеме газа, тем чаще они сталкиваются. Например, каждая частица, входящая в состав воздуха в классной комнате, сталкивается с другими и изменяет скорость своего движения примерно пять миллиардов раз в секунду.
Наноматериалы
«Пока мы должны пользоваться атомарными структурами, которые предлагает нам природа… Но в принципе физик мог бы создать любое вещество по заданной химической формуле», — заявил в 1959 г. в своей лекции «Там, внизу, полно места» американский физик Ричард Фейнман (рис. 10.8).
Фейнман предположил, что с помощью некоего «манипулятора» можно брать отдельные атомы и молекулы и, складывая их как кирпичики, создавать новые материалы. Так ученый заложил будущие основы и обозначил основные направления развития нанотехнологий. Это и сверхплотная запись информации, и разработка миниатюрных компьютеров, и создание хирургических инструментов, выполняющих операции непосредственно в организме человека. Фейнман говорил: «Было бы интересно для хирургии, если бы вы могли проглотить хирурга. Вы введете механического хирурга в кровеносные сосуды, он пройдет к сердцу и «осмотрится» там…»
В то время идеи Фейнмана казались фантастикой. Но уже в 1981 г. был создан сканирующий туннельный микроскоп, появилась возможность манипулировать веществом на атомарном уровне и получать материалы с уникальными свойствами — наноматериалы.

Рис. 10.8. Ричард Филлипс Фейнман (1918–1988) — выдающийся американский физик, лауреат Нобелевской премии по физике, один из основателей квантовой электродинамики
Согласно толковым словарям, материалы — это предметы, вещества, идущие на изготовление различных изделий; сырье. Префикс нано- (в переводе с греческого «гном, карлик») используется для записи дольных единиц СИ и означает «одна миллиардная». Соответственно объект, хотя бы один из линейных размеров которого не превышает 100 нанометров (100 нм), называют нанообъектом (рис. 10.9).
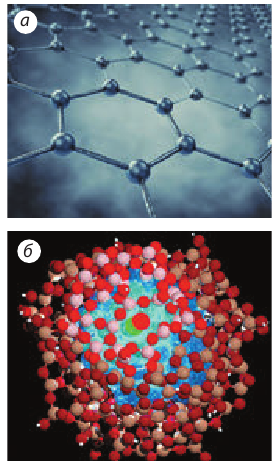
Рис. 10.9. Некоторые нанообъекты: а — графен — слой атомов Карбона толщиной всего 0,18 нм и горизонтальными размерами около 10 мкм; б — наночастица — частица, размеры которой в каждом направлении не превышают 100 нм
Следовательно, наноматериалы — это предметы, вещества, другое сырье, которые искусственно созданы с использованием нанообъектов и предназначены для изготовления различных изделий.
Свойства наноматериалов и перспективы их применения
Свойства наноматериалов и обычных веществ очень сильно отличаются, даже если те и другие состоят из одних и тех же атомов. Поэтому наноматериалы можно рассматривать как особое состояние вещества.
В отличие от обычных объектов, состоящих из огромного количества частиц (атомов, молекул, ионов), нанообъекты могут состоять всего лишь из нескольких десятков частиц. Именно поэтому они имеют малые размеры. Это позволяет разместить на небольшой площади колоссальное количество нанообъектов, что очень важно, например, для наноэлектроники и записи информации. Нанообъекты могут внедряться в любые участки тела человека или части машины, поэтому их, например, можно использовать в медицине для доставки лекарства в определенные части организма (рис. 10.10).
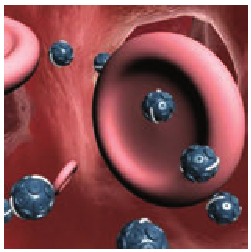
Рис. 10.10. Нанокапсулы — микроконтейнеры, защищающие лекарства при их транспортировке к больной части организма
Кроме того, у нанообъектов велика доля атомов, размещенных на поверхности. Благодаря этому в несколько раз ускоряется взаимодействие нанообъекта и среды, в которую он помещен. Поэтому наноматериалы — хорошие катализаторы (они позволяют в миллионы раз ускорить химические реакции). Так, наночастицы титан диоксида могут раскладывать воду на водород и кислород под действием обычного солнечного света, нанопористые вещества поглощают примеси и токсины, а поверхность, покрытая гидрофобным нанопорошком, «не боится» воды и грязи — она просто отталкивает их.
Важная особенность нанообъектов — отсутствие дефектов, поэтому, например, нанотрубки (рис. 10.11) в десятки раз прочнее стали и примерно в четыре раза легче. Если бы удалось сделать такие трубки достаточно длинными и изготовить из них кабель, то он проводил бы электрический ток в сотни раз лучше, чем медный.
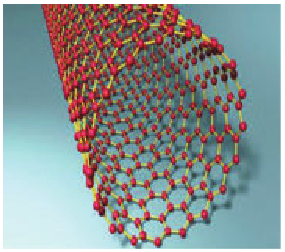
Рис. 10.11. Нанотрубка — протяженная цилиндрическая структура диаметром от одного до нескольких десятков нанометров и длиной до нескольких микрометров
Понятно, что мы описали лишь небольшую часть перспектив применения наноматериалов. Сейчас нанонаука очень быстро развивается. По мнению многих экспертов, XXI век будет веком нанотехнологий.
Итоги:
Практически любое вещество в зависимости от физических условий может существовать в трех агрегатных состояниях: твердом, жидком, газообразном. Когда вещество переходит из одного агрегатного состояния в другое, изменяются взаимное расположение частиц вещества (молекул, атомов, ионов) и характер их движения.
Существует четвертое агрегатное состояние — плазма. Плазма — это частично или полностью ионизированный газ.
В последнее время получают широкое применение наноматериалы. Свойства наноматериалов существенно отличаются от свойств обычных веществ; их можно рассматривать как особое состояние вещества.
Плавление и кристаллизация
Задумывались ли вы над тем, почему комочек снега тает в руке? Почему появляются ледяные сосульки и когда это происходит — в оттепель или, наоборот, в мороз? Как охладить немного снега без морозильной камеры? Почему кусочек свинца можно расплавить в стальной ложке, а кусочек стали в свинцовой — нельзя?
Если в теплую комнату внести немного снега, через некоторое время он растает, или, как говорят физики, расплавится.
Плавление — это процесс перехода вещества из твердого состояния в жидкое. Проследим изменение температуры снега в процессе его таяния в теплой комнате (рис. 11.1).
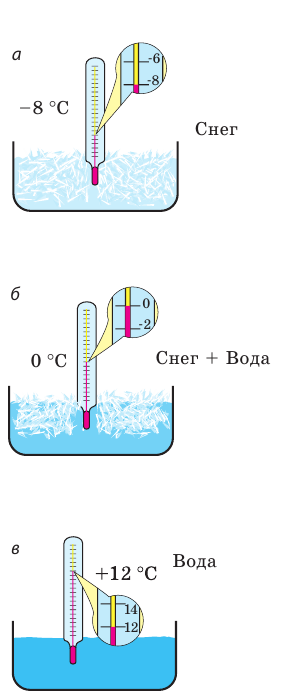
Рис. 11.1. Наблюдение процесса таяния снега: а — при отрицательной температуре вода находится в твердом состоянии; б — при температуре 0 °С снег начинает таять, во время таяния температура смеси неизменно равна 0 °С; в — при положительной температуре вода находится в жидком состоянии
В начале опыта температура снега ниже 0 °С, снег не тает, а его температура быстро увеличивается (рис. 11.1, а). Как только столбик термометра достигает отметки 0 °С, температура перестает увеличиваться, а в сосуде появляется вода (снег начинает плавиться). Осторожно перемешаем воду с остатками снега и отметим, что температура смеси остается неизменной (рис. 11.1, б). И только после того как снег полностью расплавится, температура снова начнет расти (рис. 11.1, в).
Опыты показывают: практически все кристаллические вещества начинают плавиться после достижения ими определенной температуры (собственной для каждого вещества); в процессе плавления температура вещества не изменяется.
Температура плавления — это температура, при которой твердое кристаллическое вещество плавится, то есть переходит в жидкое состояние. Итак, твердое вещество при достижении определенной температуры превращается в жидкость. Так же при определенных условиях отвердевают (кристаллизуются) жидкости. Например, если вынести воду на мороз или поставить сосуд с водой в морозильную камеру, то вода со временем кристаллизуется — превратится в лед (рис. 11.2).

Рис. 11.2. В морозильной камере вода кристаллизуется, превращаясь в лед
Кристализация — это процесс перехода вещества из жидкого состояния в твердое кристаллическое.
Измеряя температуру веществ в процессе их охлаждения и последующей кристаллизации, приходим к выводам:
- процесс кристаллизации начинается только после охлаждения жидкости до определенной для этой жидкости температуры;
- в процессе кристаллизации температура вещества не изменяется;
- температура кристаллизации вещества равна температуре его плавления.
Температуры плавления (кристаллизации) разных веществ довольно сильно отличаются. Так, температура плавления спирта равна –115 °С, льда — 0 °С; сталь плавится при температуре 1400 °С, свинец — при 327 °С, а чтобы расплавить вольфрам, его нужно нагреть до огромной температуры 3387 °С.
Температура плавления (кристаллизации) — это характеристика вещества, ее определяют экспериментально и заносят в таблицы (см. табл. 2 Приложения). В таких таблицах нет аморфных веществ, ведь они, как вы уже знаете, не имеют определенной температуры плавления: нагреваясь, аморфные вещества постепенно размягчаются, а в ходе охлаждения постепенно затвердевают. Далее, изучая процессы плавления и кристаллизации, мы будем рассматривать только кристаллические вещества.
График плавления и кристаллизации вещества
Для более детального изучения процессов плавления и кристаллизации рассмотрим график зависимости температуры кристаллического вещества (льда) от времени его нагревания и последующего охлаждения (рис. 11.3).
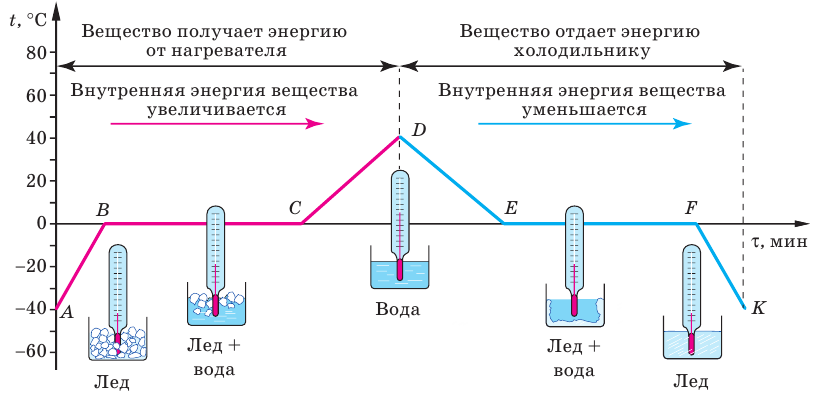
Рис. 11.3. График плавления льда и кристаллизации воды. График будет иметь такую симметричность, если количество теплоты, которую каждую минуту получает лед, а затем вода при работе нагревателя, будет равно количеству теплоты, которую каждую минуту отдает это же вещество во время работы холодильника
На момент начала наблюдения (точка A) температура льда равна –40 °С. В результате работы нагревателя температура льда увеличивается (участок AB). С точки зрения молекулярно-кинетической теории в данный интервал времени увеличивается кинетическая энергия колебательного движения молекул воды в узлах кристаллической решетки льда.
После достижения температуры 0 °С лед начинает плавиться, а его температура не изменяется несмотря на то, что нагреватель продолжает работать и передавать льду некоторое количество теплоты (участок BС). Вся энергия, поступающая от нагревателя, идет на разрушение кристаллической решетки льда. В данный интервал времени внутренняя энергия льда продолжает увеличиваться.
После того как весь лед расплавился и превратился в воду (точка С), температура воды начинает увеличиваться (участок СD), то есть начинает возрастать кинетическая энергия движения молекул.
В момент, когда температура достигла 40 °С (точка D), нагреватель выключили. Воду поместили в холодильник, и ее температура начала снижаться (участок DE). Снижение температуры свидетельствует о том, что кинетическая энергия, а значит, скорость движения молекул уменьшаются.
При достижении температуры кристаллизации 0 °С (точка E), скорость движения молекул уменьшается настолько, что они уже не могут перепрыгивать с места на место. Молекулы постепенно занимают фиксированные положения (участок EF), и к моменту завершения кристаллизации они уже все колеблются в узлах кристаллической решетки. Вода переходит в состояние с меньшей внутренней энергией — полностью превращается в лед (точка F). Во время дальнейшей работы холодильника замерзшая вода (лед) остывает, а кинетическая энергия колебательного движения молекул уменьшается (участок FK).
Процессы плавления и кристаллизации невозможны без передачи энергии:
Если поместить снег в холодильную камеру, температура в которой неизменна и равна 0 °С, выяснится следующее.
Как и в опыте с таянием снега в теплой комнате (см. рис. 11.1), температура снега будет сначала увеличиваться (правда, медленнее). Ведь температура в камере выше температуры снега, поэтому более теплый воздух в камере отдает энергию более холодному снегу. Увеличение температуры снега будет продолжаться до тех пор, пока его температура не достигнет 0 °С. И тут начинается самое интересное. Температура снега достигла температуры плавления, а снег не тает. Почему?
Вспомните: опыт, представленный на рис. 11.1, проводился в теплой комнате (то есть при температуре выше 0 °С). Следовательно, в течение всего времени наблюдения происходил теплообмен между воздухом в комнате и снегом. При этом все время снег получал энергию, в частности и тогда, когда его температура оставалась неизменной. И снег таял. А вот в опыте с холодильной камерой температура плавления снега и температура воздуха в холодильной камере одинаковы, поэтому теплообмен не происходит. Снег не получает энергию, следовательно, и не тает.
Если в холодильную камеру, температура в которой 0 °С, поместить теплую воду, то понятно, что вода будет охлаждаться (теплая вода будет отдавать энергию воздуху в камере). Однако после достижения температуры 0 °С вода не будет кристаллизоваться, поскольку теперь, чтобы перейти в состояние с меньшей внутренней энергией, ей нужно отдать окружающей среде некоторое количество теплоты, а в случае теплового равновесия теплообмен не происходит.
Итоги:
Тепловой процесс перехода вещества из твердого состояния в жидкое называют плавлением. В процессе плавления температура кристаллического вещества не изменяется.
При одинаковой температуре внутренняя энергия вещества в жидком состоянии больше внутренней энергии этого вещества в твердом состоянии.
Чтобы перевести вещество из твердого состояния в жидкое, необходимо выполнение двух условий: во-первых, нужно нагреть вещество до температуры плавления; во-вторых, вещество должно получать энергию и во время плавления.
Тепловой процесс перехода вещества из жидкого состояния в твердое кристаллическое называют кристаллизацией. Температура кристаллизации вещества равна температуре его плавления.
Чтобы вещество перевести из жидкого состояния в кристаллическое, должны быть выполнены два условия: во-первых, жидкость нужно охладить до температуры кристаллизации; во-вторых, вещество должно отдавать энергию и во время кристаллизации.
Удельная теплота плавления
На фото изображены кристаллические вещества (сталь и лед) одинаковой массы, находящиеся при температуре, близкой к температуре плавления. Чтобы расплавить эти вещества, им следует передать некоторое количество теплоты. А одинаковое ли количество теплоты необходимо передать льду и стали, чтобы перевести их в жидкое состояние? Выясним.
Вы знаете, что при переходе из твердого состояния в жидкое вещество поглощает некоторое количество теплоты и внутренняя энергия вещества увеличивается. Переход же вещества из жидкого состояния в твердое сопровождается выделением теплоты и уменьшением его внутренней энергии.
Изучение процессов плавления и кристаллизации показало, что количество теплоты, необходимое для плавления определенной массы вещества, равно количеству теплоты, которое выделяется при кристаллизации этого вещества (рис. 12.1).

Рис. 12.1. Во время плавления вещество поглощает такое же количество теплоты, какое выделяет при кристаллизации: 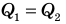
Возникает вопрос: одинаковое ли количество теплоты необходимо для плавления разных веществ равной массы? Логично предположить, что не одинаковое, ведь силы взаимодействия между частицами у разных веществ — разные, поэтому понятно, что для разрушения их кристаллических решеток требуется разное количество энергии. И это действительно так. Например, чтобы расплавить 1 кг льда, ему следует передать в 13 раз больше теплоты, чем нужно для плавления 1 кг свинца.
Физическую величину, показывающую, сколько теплоты поглощает 1 кг твердого кристаллического вещества при переходе в жидкость, называют удельной теплотой плавления.
Удельная теплота плавления — физическая величина, характеризующая данное вещество и равная количеству теплоты, которую необходимо передать 1 кг этого вещества, взятому в твердом кристаллическом состоянии, чтобы при температуре плавления полностью перевести его в жидкость.
Удельную теплоту плавления обозначают символом 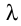 («лямбда») и вычисляют по формуле:
(«лямбда») и вычисляют по формуле:
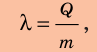
где Q — количество теплоты, необходимое для плавления вещества массой m.
Из формулы для определения удельной теплоты плавления получаем ее единицу в СИ — джоуль на килограмм:
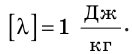
Удельная теплота плавления показывает, на сколько при температуре плавления внутренняя энергия 1 кг вещества в жидком состоянии больше, чем внутренняя энергия 1 кг этого вещества в твердом состоянии. В этом состоит физический смысл удельной теплоты плавления.
Например, удельная теплота плавления льда равна 332 килоджоуля на килограмм (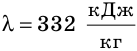 ) Это означает: чтобы расплавить 1 кг льда, находящегося при температуре плавления (0 °С), следует передать ему 332 килоджоуля теплоты. Такое же количество теплоты (332 кДж) выделится и при кристаллизации 1 кг воды. То есть при температуре 0 °С внутренняя энергия 1 кг воды больше внутренней энергии 1 кг льда на 332 кДж.
) Это означает: чтобы расплавить 1 кг льда, находящегося при температуре плавления (0 °С), следует передать ему 332 килоджоуля теплоты. Такое же количество теплоты (332 кДж) выделится и при кристаллизации 1 кг воды. То есть при температуре 0 °С внутренняя энергия 1 кг воды больше внутренней энергии 1 кг льда на 332 кДж.
Удельную теплоту плавления определяют опытным путем и заносят в таблицы (см. табл. 3 Приложения). Определить удельную теплоту плавления тугоплавких веществ (веществ, имеющих высокую температуру плавления) достаточно сложно. А вот удельную теплоту плавления легкоплавких веществ, например льда, вы можете определить даже самостоятельно (рис. 12.2).
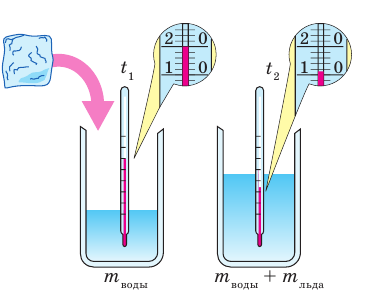
Рис. 12.2. Опыт по определению удельной теплоты плавления льда. В калориметр, содержащий известную массу воды 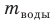 при температуре
при температуре 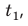 погружают лед при температуре плавления
погружают лед при температуре плавления 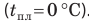 Вода будет отдавать тепло и охлаждаться:
Вода будет отдавать тепло и охлаждаться: 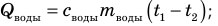 лед, получая тепло, будет плавиться, а полученная в результате плавления вода — нагреваться:
лед, получая тепло, будет плавиться, а полученная в результате плавления вода — нагреваться: 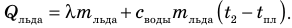 Измерив температуру
Измерив температуру 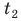 и массу m воды после плавления льда и вычислив массу льда
и массу m воды после плавления льда и вычислив массу льда 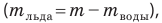 определяют удельную теплоту плавления льда:
определяют удельную теплоту плавления льда:
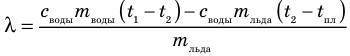
Вычисляем количество теплоты, необходимое для плавления вещества или выделяющееся при его кристаллизации:
Чтобы вычислить количество теплоты, необходимое для плавления кристаллического вещества, взятого при температуре плавления, нужно удельную теплоту плавления этого вещества умножить на его массу:
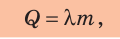
где Q — количество теплоты, которое поглощает твердое кристаллическое вещество; 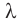 — удельная теплота плавления; m — масса вещества. (Действительно, по определению удельной теплоты плавления:
— удельная теплота плавления; m — масса вещества. (Действительно, по определению удельной теплоты плавления: 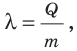 отсюда
отсюда 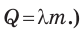
Понятно, что количество теплоты, выделяющееся при кристаллизации, рассчитывают по этой же формуле.
Пример №1
Какое количество теплоты необходимо, чтобы расплавить 5 кг свинца, взятого при температуре 27 °С?
Анализ физической проблемы. Чтобы расплавить свинец, его сначала нужно нагреть до температуры плавления. Найдем в табл. 2 Приложения температуру 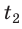 плавления свинца и построим схематический график процесса.
плавления свинца и построим схематический график процесса.
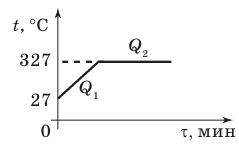
Искомое количество теплоты Q будет равно сумме количества теплоты 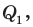 необходимого для нагревания свинца до температуры плавления, и количества теплоты
необходимого для нагревания свинца до температуры плавления, и количества теплоты 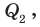 необходимого для плавления. Удельную теплоемкость c и удельную теплоту плавления
необходимого для плавления. Удельную теплоемкость c и удельную теплоту плавления 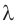 свинца найдем соответственно в табл. 1 и 3 Приложения.
свинца найдем соответственно в табл. 1 и 3 Приложения.
Дано:
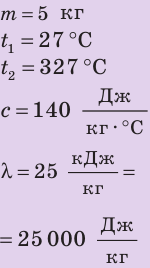
Найти: Q - ?
Решение:

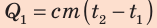 - нагревание;
- нагревание; 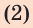
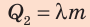 - плавление.
- плавление. 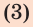
Подставив формулы (2) и (3) в формулу (1), окончательно получим:
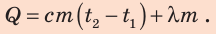
Проверим единицу, найдем значение искомой величины: 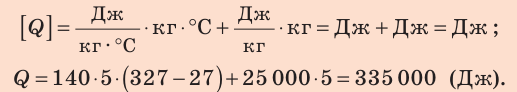
Ответ: Q=335 кДж.
Итоги:
Физическая величина, характеризующая данное вещество и равная количеству теплоты, которое необходимо передать 1 кг этого вещества в твердом кристаллическом состоянии, чтобы при температуре плавления полностью перевести его в жидкость, называется удельной теплотой плавления.
Удельную теплоту плавления обозначают символом 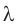 и вычисляют по формуле
и вычисляют по формуле 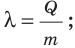 ее единица в СИ — джоуль на килограмм
ее единица в СИ — джоуль на килограмм 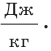
Количество теплоты, необходимое для плавления вещества, взятого при температуре плавления, равно количеству теплоты, выделяющемуся при кристаллизации этого вещества. Данное количество теплоты вычисляют по формуле 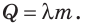
Испарение и конденсация
Почему, выходя из реки в жаркий летний день, мы ощущаем прохладу? Куда исчезают лужи после дождя? Для чего в жару собака высовывает язык? Почему, если нужно остудить руки, мы на них дуем, а если хотим согреть — дышим? И таких вопросов можно поставить множество.
Любое вещество может переходить из одного агрегатного состояния в другое. При определенных условиях твердое тело может превратиться в жидкость, жидкость может снова затвердеть или превратиться в газ.
Процесс перехода вещества из жидкого состояния в газообразное называют парообразованием.
Есть два способа парообразования: испарение и кипение. Знакомство с парообразованием начнем с процесса испарения.
Если разлить воду, то через некоторое время лужа исчезнет; вещи, намокшие под дождем, обязательно высохнут; даже масляный след, оставшийся на асфальте от неисправного автомобиля, со временем становится почти незаметным. Все эти явления можно объяснить испарением жидкости.
Испарение — это процесс парообразования со свободной поверхности жидкости.
Процесс парообразования происходит и с поверхности твердых тел (вы, наверное, чувствовали запах нафталина, замечали, что во время сильных морозов куда-то исчезают замерзшие лужи и т. д.). Этот процесс называют сублимацией.
Рассмотрим процесс испарения с точки зрения молекулярно-кинетической теории. Молекулы жидкости непрерывно движутся, постоянно изменяя как значение, так и направление скорости своего движения. Среди молекул поверхностного слоя жидкости всегда есть такие, которые «пытаются» покинуть ее. Молекулы, которые в определенный момент движутся медленно, не смогут преодолеть притяжение соседних молекул и останутся в жидкости. Но если вблизи поверхности окажется «быстрая» молекула, то ее кинетической энергии будет достаточно, чтобы преодолеть силы межмолекулярного притяжения и вылететь за пределы жидкости (рис. 13.1).
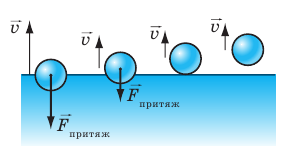
Рис. 13.1. Молекула, вылетающая из жидкости, должна преодолеть силы межмолекулярного притяжения, которые тянут ее обратно в жидкость
Ознакомившись с механизмом испарения, можно сделать несколько выводов.
Во-первых, тот факт, что в жидкости всегда есть молекулы, движущиеся сравнительно быстро, позволяет утверждать, что испарение жидкости происходит при любой температуре.
Во-вторых, поскольку в процессе испарения жидкость покидают самые быстрые молекулы, то средняя кинетическая энергия оставшихся молекул уменьшается. Поэтому, если жидкость не получает энергии извне, она охлаждается.
Кроме того, при испарении выполняется работа против сил межмолекулярного притяжения и против сил внешнего давления, поэтому процесс испарения сопровождается поглощением энергии (рис. 13.2).

Рис. 13.2. После купания на теле человека остаются капельки жидкости. Испаряясь, жидкость поглощает энергию, и человек ощущает прохладу даже в жаркий день
От чего зависит скорость испарения
Чем выше температура жидкости, тем быстрее жидкость испаряется: с увеличением температуры жидкости увеличивается число «быстрых» молекул, поэтому все больше молекул могут преодолеть силы межмолекулярного притяжения и вылететь за пределы жидкости.
Обратим внимание еще на один момент. Стараясь быстро высушить одежду, мы не положим ее на батарею комом, а расправим, так как из опыта знаем, что смятая одежда высыхает намного медленнее. Почему? Потому что скорость испарения зависит от площади свободной поверхности жидкости: чем больше площадь поверхности жидкости, тем больше на этой поверхности «быстрых» молекул и тем быстрее жидкость испаряется (рис. 13.4).

Рис. 13.4. С увеличением площади свободной поверхности жидкости (чай перелит из чашки в блюдце) скорость испарения увеличивается. А так как при испарении чай теряет энергию, он быстрее остывает (Б. М. Кустодиев «Купчиха за чаем»)
Нарисуем на стекле или классной доске три фигурки. Одну нарисуем салфеткой, смоченной в спирте, вторую — салфеткой, смоченной в воде, третью — салфеткой, смоченной в растительном масле (рис. 13.5).

Рис. 13.5. Демонстрация зависимости скорости испарения от рода жидкости. Через минуту фигурка, нарисованная спиртом, полностью исчезнет; фигурка, нарисованная водой, останется частично; испарение растительного масла будет почти незаметным
«Спиртовая» фигурка мгновенно испарится, «водяная» продержится немного дольше, а вот «масляная» будет радовать нас несколько дней. Дело в том, что у разных жидкостей силы притяжения между молекулами разные, а значит, скорость испарения зависит от рода жидкости. Очевидно, что медленнее испаряются те жидкости, молекулы которых сильнее взаимодействуют друг с другом.
Жизненный опыт также подсказывает, что скорость испарения зависит от движения воздуха. Действительно, чтобы быстрее высушить волосы, мы переключаем фен на более мощный режим (рис. 13.6); чтобы охладить обожженную руку, дуем на нее; белье, вывешенное на ветру, сохнет быстрее, чем в безветренном месте.

Рис. 13.6. Скорость испарения зависит от движения воздуха
Такую зависимость тоже легко объяснить с точки зрения движения и взаимодействия молекул. Около поверхности жидкости всегда существует «облако» молекул, вылетевших из нее (рис. 13.7).
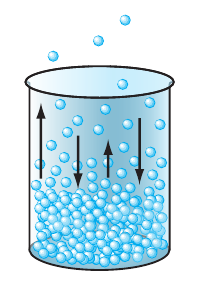
Рис. 13.7. Многие молекулы, покинувшие жидкость, могут вернуться в нее вследствие теплового движения
Эти молекулы хаотично движутся, сталкиваются друг с другом и с молекулами других газов, входящих в состав воздуха. В результате молекула жидкости может так близко подлететь к ее поверхности, что будет «захвачена» силами межмолекулярного взаимодействия и возвращена в жидкость. А если есть ветер, то он относит молекулы, вылетевшие из жидкости, и не дает им возможности вернуться.
Если бы молекулы, покидая жидкость, совсем не возвращались в нее, то скорость испарения была бы огромной. Например, при комнатной температуре полный стакан воды испарился бы за 4 минуты, ведь при этих условиях с 1 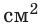 воды ежесекундно вылетает
воды ежесекундно вылетает 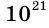 молекул.
молекул.
Молекулы постоянно вылетают из жидкости, и некоторые из них возвращаются. Таким образом, наряду с испарением, в ходе которого жидкость преобразуются в пар, существует обратный процесс, при котором вещество из газообразного состояния переходит в жидкое.
Процесс перехода вещества из газообразного состояния в жидкое называют конденсацией.
Процесс конденсации (от латин. сondensatio — сгущение, уплотнение) воды в природе мы наблюдаем каждый день. Так, летним утром на листьях растений мы видим прозрачные капельки росы (рис. 13.8, а). Это сконденсировавшийся водяной пар, который днем вследствие испарения скапливается в воздухе, а ночью, охлаждаясь, конденсируется.
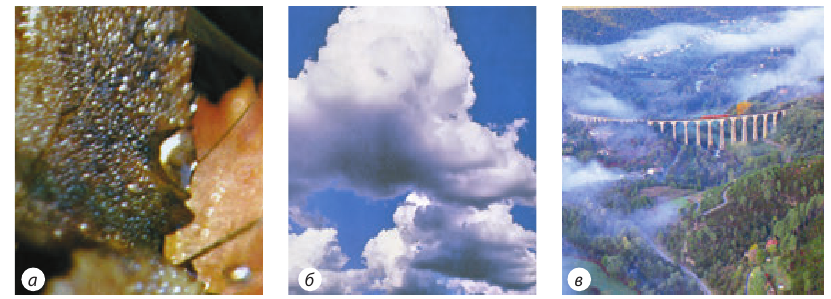
Рис. 13.8. Проявление конденсации в природе: выпадение росы (а); образование облаков (б); появление тумана (в)
Когда влажный воздух поднимается в высокие слои атмосферы, то, охлаждаясь, он образует облака (рис. 13.8, б). Облака состоят из мелких капелек воды, образовавшихся вследствие конденсации водяного пара. Из таких же мелких капелек воды состоит и туман, который образуется в результате охлаждения влажного воздуха у поверхности Земли (рис. 13.8, в). Поскольку процесс конденсации сопровождается выделением энергии, образование тумана сдерживает снижение температуры воздуха.
Итоги:
Тепловой процесс перехода вещества из жидкого состояния в газообразное называют парообразованием. Процесс парообразования со свободной поверхности жидкости называют испарением.
Испарение происходит при любой температуре, и оно тем интенсивнее, чем выше температура жидкости. Скорость испарения увеличивается также с увеличением площади свободной поверхности жидкости и вследствие движения воздуха вблизи этой поверхности. Кроме того, интенсивность испарения зависит от рода жидкости.
Тепловой процесс перехода вещества из газообразного состояния в жидкое называют конденсацией.
Испарение происходит с поглощением энергии. Конденсация, наоборот, сопровождается выделением энергии.
Кипение. Удельная теплота парообразования
До какой температуры можно нагреть воду? Есть ли смысл увеличивать мощность нагревателя, чтобы ускорить приготовление еды? Как закипятить воду с помощью снега?
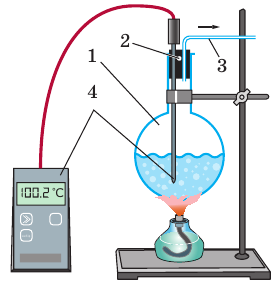
Рис. 14.1. Устройство для наблюдения и изучения процесса кипения жидкости: 1 — стеклянная колба; 2 — резиновая пробка с отверстиями; 3 — трубка для отвода водяного пара; 4 — термометр
Проведем эксперимент. Закрепим колбу с водой в лапке штатива. Плотно закупорим колбу пробкой с двумя отверстиями. В одно отверстие поместим трубку для выхода пара, во второе — термометр (рис. 14.1). Начнем нагревать воду в колбе.
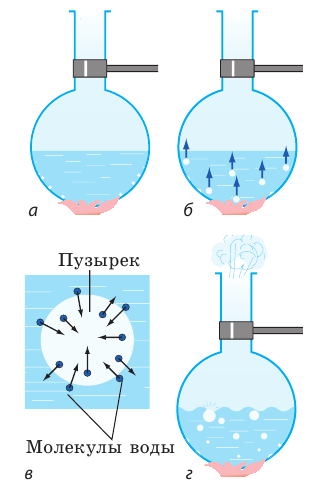
Рис. 14.2. Наблюдение процесса закипания воды
Через некоторое время дно и стенки колбы покроются пузырьками (рис. 14.2, а), образованными водяным паром и растворенными в воде газами (На самом деле микропузырьки газа в жидкости есть всегда, но заметными они становятся только при достаточно высокой температуре). Дело в том, что с увеличением температуры растворимость газов уменьшается, и «лишний» газ выделяется внутрь пузырьков. С увеличением температуры давление газов в пузырьках повышается, и как только оно превысит внешнее давление, пузырьки начинают расти.
После достижения каждым пузырьком определенного объема архимедова сила отрывает пузырек от дна сосуда и он поднимается (рис. 14.2, б). На местах оторвавшихся пузырьков остается небольшое количество газа — зародыши новых пузырьков. Верхние слои воды некоторое время холоднее нижних, поэтому в верхних слоях водяной пар в пузырьках конденсируется и пузырьки резко уменьшаютcя в объеме — схлопываются. Процесс сопровождается шумом и образованием многочисленных мелких пузырьков. Вода становится мутной — говорят, что она «кипит белым ключом».
Когда вся жидкость прогреется (температуры верхних и нижних слоев сравняются), пузырьки, поднимаясь, уже не будут уменьшаться в объеме, а наоборот, будут увеличиваться, ведь внутрь пузырьков активно испаряется вода (рис. 14.2, в). Достигая поверхности воды, пузырьки лопаются и выбрасывают наружу значительное количество водяного пара (рис. 14.2, г). Вода при этом бурлит и клокочет — мы говорим, что она закипела. Термометр в этот момент показывает 100 °С.
Кипение — это процесс парообразования, происходящий во всем объеме жидкости и сопровождающийся образованием и ростом пузырьков пара.
От чего зависит температура кипения
Продолжим эксперимент (см. пункт 1). Будем нагревать уже кипящую воду и наблюдать за показаниями термометра. Увидим, что столбик термометра застыл на отметке 100 °С. Следовательно, во время кипения температура жидкости не изменяется.
Температуру, при которой жидкость кипит, называют температурой кипения.
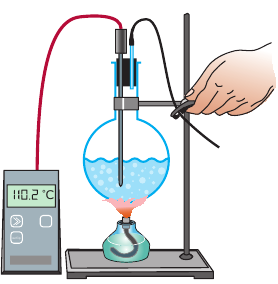
Рис. 14.4. Если зажать трубку для отведения пара, давление в колбе увеличивается, и это приводит к повышению температуры кипения жидкости
Выясним, от чего зависит температура кипения жидкости. Для начала уменьшим выход пара из колбы, крепко зажав трубку, отводящую пар (рис. 14.4). Пар будет собираться над поверхностью воды, давление над жидкостью увеличится, кипение на некоторое время прекратится, а температура жидкости начнет повышаться. Следовательно, с увеличением внешнего давления температура кипения жидкости возрастает (рис. 14.5).
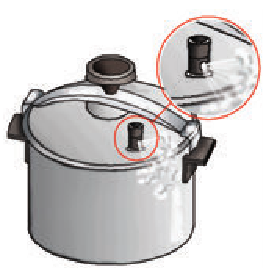
Рис. 14.5. Кастрюля-скороварка: благодаря клапанам и герметичной крышке поддерживается высокое давление в пространстве над жидкостью, поэтому температура кипения воды в такой кастрюле около 120 °С
Если в колбу налить теплую воду и насосом начать откачивать из колбы воздух, спустя некоторое время на внутренней поверхности колбы появятся пузырьки газа. Если продолжать откачивать воздух, вода закипит, но уже при температуре ниже 100 °С (рис. 14.6). С уменьшением внешнего давления температура кипения жидкости снижается.
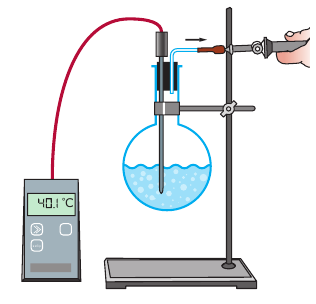
Рис. 14.6. Наблюдение снижения температуры кипения воды при уменьшении внешнего давления
Наблюдая кипение других жидкостей, например спирта, масла, эфира, можно заметить, что при одинаковом давлении они кипят при разных температурах, которые отличаются от температуры кипения воды. То есть температура кипения зависит от рода жидкости. О температуре кипения некоторых жидкостей при нормальном атмосферном давлении вы можете узнать из табл. 4 Приложения.
Температура кипения зависит также от наличия в жидкости растворенного газа. Если долго кипятить воду и таким образом удалить растворенный в ней газ, то повторно при нормальном давлении эту воду можно нагреть до температуры, превышающей 100 °С. Такую воду называют перегретой (Аналогично при отсутствии центров кристаллизации можно получить переохлажденную воду, температура которой меньше 0 °С).
Удельная теплота парообразования
Кипение — это переход жидкости в пар, и этот процесс идет с поглощением энергии. Поэтому для поддержания кипения к жидкости необходимо подводить тепло. Эта энергия идет на разрыв межмолекулярных связей и парообразование. Опыты показывают: количество теплоты, необходимое для перевода жидкости в пар, зависит от рода жидкости.
Удельная теплота парообразования — это физическая величина, характеризующая данное вещество и равная количеству теплоты, которую необходимо передать жидкости массой 1 кг, чтобы при неизменной температуре перевести ее в пар.
Удельную теплоту парообразования обозначают символом r (Для обозначения удельной теплоты парообразования используют также символ L) и вычисляют по формуле:
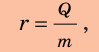
где Q — количество теплоты, полученное жидкостью; m — масса образовавшегося пара.
Из формулы для определения удельной теплоты парообразования получаем единицу этой величины в СИ — джоуль на килограмм:
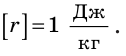
Удельную теплоту парообразования определяют опытным путем (рис. 14.7) и заносят в таблицы (см. табл. 5 Приложения).
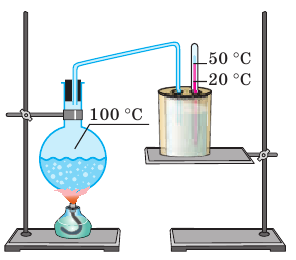
Рис. 14.7. Опыт по определению удельной теплоты парообразования воды (см. задачу 2 в пункте 5 § 14)
Вычисляем количество теплоты, необходимое для парообразования или выделяющееся при конденсации:
Чтобы вычислить количество теплоты, необходимое для превращения жидкости в пар при неизменной температуре, нужно удельную теплоту парообразования данной жидкости умножить на ее массу:
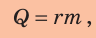
где Q — количество теплоты, полученное жидкостью; r — удельная теплота парообразования; m — масса жидкости (то есть масса образовавшегося пара). (Действительно, по определению удельной теплоты парообразования: 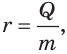 откуда Q = rm.) Если перед трубкой для отведения пара поместить холодный предмет, то пар будет конденсироваться на нем (рис. 14.8).
откуда Q = rm.) Если перед трубкой для отведения пара поместить холодный предмет, то пар будет конденсироваться на нем (рис. 14.8).
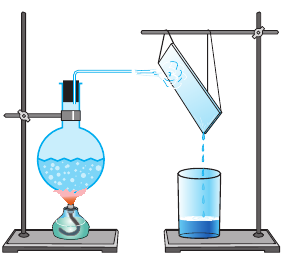
Рис. 14.8. Опыт, демонстрирующий конденсацию пара
Точные измерения показывают, что при конденсации пара выделяется такое же количество теплоты, какое было затрачено на образование этого пара.
Пример №2
Какое количество теплоты необходимо для того, чтобы довести до кипения и полностью испарить 3 кг воды, взятой при температуре 0 °С?
Анализ физической проблемы. Построим схематический график зависимости температуры воды от времени нагревания (рис. 14.9).
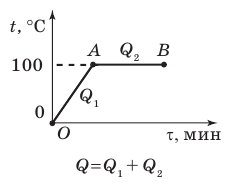
Рис. 14.9. К задаче 1 в § 14
В первый момент температура воды 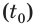 была 0 °С — точка O на графике. В ходе нагревания температура воды будет увеличиваться прямо пропорционально количеству полученной теплоты
была 0 °С — точка O на графике. В ходе нагревания температура воды будет увеличиваться прямо пропорционально количеству полученной теплоты 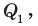 а значит, и времени нагревания (участок OA).
а значит, и времени нагревания (участок OA).
Достигнув температуры кипения, то есть 100 °С, вода закипит, и ее температура не будет изменяться до тех пор, пока вода полностью не испарится (участок AB графика).
Вода при этом получает некоторое количество теплоты 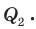 Удельную теплоемкость c воды и удельную теплоту парообразования r найдем соответственно в табл. 1 и 5 Приложения.
Удельную теплоемкость c воды и удельную теплоту парообразования r найдем соответственно в табл. 1 и 5 Приложения.
Дано:
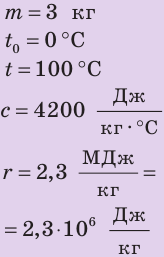
Найти: Q — ?
Решение:
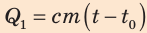 — нагревание воды;
— нагревание воды; 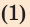
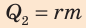 — парообразование;
— парообразование; 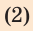
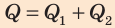 — общее количество теплоты.
— общее количество теплоты. 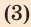
Подставив формулы (1) и (2) в формулу (3), получим:
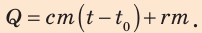
Проверим единицу, найдем значение искомой величины:
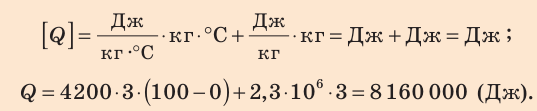
Ответ: Q = 8,16 МДж.
Пример №3
Во время опыта по определению удельной теплоты парообразования воды водяной пар, имеющий температуру 100 °С, поступал в калориметр, в котором находилось 500 г воды при температуре 20 °С (см. рис. 14.7). После окончания опыта температура воды в калориметре достигла 50 °С, а ее масса увеличилась на 25 г. По данным опыта вычислите удельную теплоту парообразования воды. Считайте, что теплообмен воды с калориметром и окружающей средой отсутствует.
Дано:
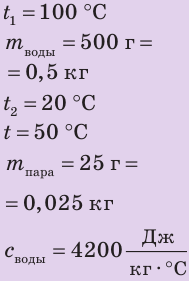
Найти: r — ?
Решение:
Во время опыта происходит теплообмен между водой в калориметре и паром. Отдает энергию водяной пар
- сначала конденсируется: 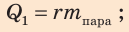
- полученная вода охлаждается: 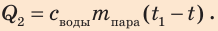
Получает энергию вода в калориметре
- нагревается: 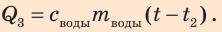
По условию теплообмен с окружающей средой отсутствует, поэтому: 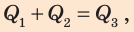 или
или 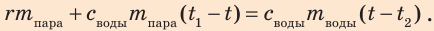
Отсюда найдем удельную теплоту парообразования воды: 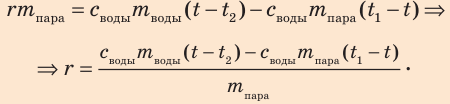
Проверим единицу, найдем значение искомой величины: 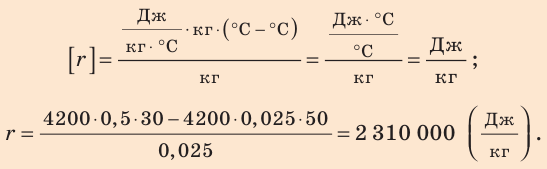
Анализ результата. Полученный результат (r = 2,31 МДж/кг) совпадает с табличным значением, следовательно, задача решена правильно.
Ответ: 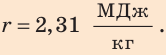
Итоги:
Процесс парообразования, происходящий во всем объеме жидкости и сопровождающийся образованием и ростом пузырьков пара, называют кипением.
Температура кипения жидкости зависит от внешнего давления, рода жидкости и наличия растворенных в жидкости газов.
Удельная теплота парообразования — физическая величина, характеризующая данное вещество и равная количеству теплоты, которую необходимо передать жидкости массой 1 кг, чтобы при неизменной температуре перевести ее в пар.
Удельную теплоту парообразования вычисляют по формуле 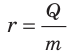 и измеряют в джоулях на килограмм:
и измеряют в джоулях на килограмм: 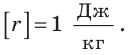
Количество теплоты, необходимое для перевода жидкости в пар, равно количеству теплоты, которое выделяется при конденсации этого пара. Данное количество теплоты вычисляют по формуле 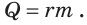
Теплота сгорания топлива. Коэффициент полезного действия нагревателя
Возьмите коробок со спичками, достаньте одну спичку. Перед вами — два холодных твердых тела. Но если потереть головку спички о коробок, спичка вспыхнет. Откуда берется эта энергия? Благодаря выполненной работе? Однако если даже долго и с усилием тереть о коробок спичку другим концом, столько тепла не выделится.
Нам часто требуется увеличить температуру какого-либо тела. Так, чтобы в комнате стало теплее, нужно увеличить температуру воды в батареях отопления; чтобы приготовить пищу — температуру воздуха в духовке. Для увеличения температуры люди издавна использовали энергию, которая выделяется во время химической реакции горения топлива (Заметим, что во время использования ядерного топлива энергия выделяется в ходе ядерных реакций (подробнее об этом будет идти речь в старших классах).) (см., например, рис. 15.1).
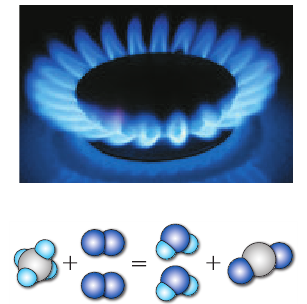
Рис. 15.1. Реакция взаимодействия метана (основной составляющей природного газа) и кислорода сопровождается выделением теплоты: 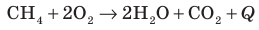
Топливом могут служить как природные вещества (каменный уголь, нефть, торф, дрова, природный газ) (рис. 15.2), так и специально полученные человеком (керосин, бензин, порох, древесный уголь, этиловый спирт и т. д.) (рис. 15.3).

Рис. 15.2. Дрова — распространенное твердое природное топливо

Рис. 15.3. Керосин, бензин, дизельное топливо — это жидкое топливо, полученное человеком
Как видим, топливо бывает твердым (каменный уголь, торф, дрова, сухое горючее), жидким (нефть, керосин, бензин, дизельное топливо) и газообразным (природный газ, пропан, бутан).
Для современной цивилизации топливо — необходимое условие существования (рис. 15.4).
Рис. 15.4. Для современной цивилизации топливо является необходимым условием существования
При работе транспорта, различных механизмов в промышленности и сельском хозяйстве, при обогреве жилья и приготовлении пищи химическая энергия, «запасенная» в топливе, превращается в другие виды энергии.
Удельная теплота сгорания топлива
Топливо отличается друг от друга теплотворной способностью. Убедимся в этом с помощью простого опыта.
На левую чашу весов поставим спиртовку, наполненную спиртом. Над спиртовкой подвесим сосуд с водой, измерив перед этим температуру воды. Уравновесим весы, а затем на левую чашу положим разновес массой 1 г. Равновесие весов нарушится (рис. 15.5, а). Зажжем спиртовку. По мере сгорания спирта масса спиртовки со спиртом будет уменьшаться, и через некоторое время равновесие весов восстановится (это будет означать, что сгорел 1 г спирта) (рис. 15.5, б). В этот момент погасим спиртовку и снова измерим температуру воды.
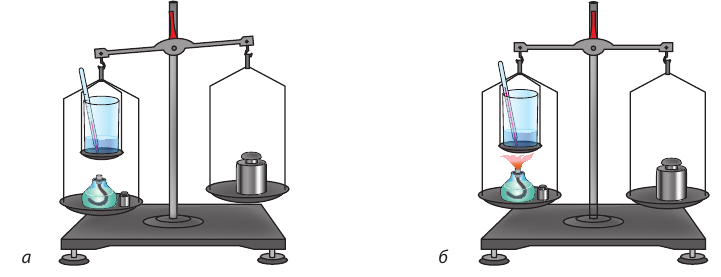
Рис. 15.5. Опыт, позволяющий убедиться в качественном отличии разных видов топлива
Повторим опыт, заменив спирт керосином, и убедимся, что в этом случае вода нагреется больше. Это значит, что при сгорании 1 г керосина выделилось больше энергии, чем при сгорании 1 г спирта.
Для количественной характеристики теплотворной способности топлива применяют физическую величину, которая называется удельная теплота сгорания топлива.
Удельная теплота сгорания топлива — это физическая величина, которая характеризует данное топливо и численно равна количеству теплоты, выделяющемуся при полном сгорании 1 кг этого топлива.
Удельную теплоту сгорания топлива обозначают символом q и вычисляют по формуле:
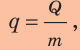
где Q — количество теплоты, которое выделяется в ходе полного сгорания топлива массой m.
Из формулы для определения удельной теплоты сгорания топлива получим единицу этой величины в СИ — джоуль на килограмм:
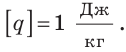
Удельную теплоту сгорания разных видов топлива определяют в лабораторных условиях и заносят в таблицы (см. табл. 6 Приложения).
Зная удельную теплоту сгорания q и массу m топлива, можно вычислить количество теплоты Q, которое выделится в ходе полного сгорания этого топлива: так как 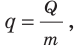 то
то
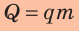
Вычисление коэффициента полезного действия (КПД) нагревателя
Для сжигания топлива используют различные нагреватели: печи и камины, газовые котлы, горелки и спиртовки, примусы, паяльные лампы и др. (рис. 15.6).

Рис. 15.6. Разные нагревательные устройства, используемые человеком: примус (а); газовая плита (б); паяльная лампа (в); газовый котел (г)
Тип нагревателя зависит от используемого в нем топлива и от того, для чего необходима теплота. Например, если надо отапливать помещение, а топливом является газ, целесообразно выбрать газовый котел; для физических опытов, во время которых топливом будет спирт, в качестве нагревателя следует взять спиртовку. Но даже с помощью самых современных нагревателей невозможно полностью использовать всю энергию, «накопленную» в топливе. Во-первых, никакое топливо не может в реальных условиях сгореть полностью. Во-вторых, некоторая часть энергии тратится «бесполезно» (например, уносится с продуктами сгорания, идет на нагревание окружающей среды).
Коэффициент полезного действия нагревателя — это физическая величина, характеризующая эффективность нагревателя и равная отношению полезно использованной теплоты ко всей теплоте, которая может быть выделена в процессе полного сгорания топлива.
КПД нагревателя вычисляют по формуле:
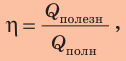
где η — коэффициент полезного действия нагревателя; 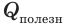 — полезно использованная теплота;
— полезно использованная теплота; 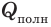 — вся теплота, которая может быть выделена в процессе полного сгорания данного топлива.
— вся теплота, которая может быть выделена в процессе полного сгорания данного топлива.
Обычно КПД выражают в процентах:
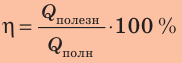
Пример №4
Туристы остановились на привал у ручья и решили приготовить чай. Какое количество сухих дров нужно заготовить туристам, чтобы закипятить 10 кг воды? Вода получает 15 % энергии, выделяющейся при полном сгорании дров. Температура воды в ручье 15 °С.
Дано:
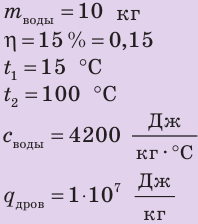

Решение:
Для решения задачи воспользуемся формулой для вычисления КПД нагревателя:

Количество теплоты, необходимое для нагревания воды:
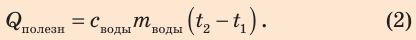
Количество теплоты, выделяющееся при полном сгорании дров: 
Подставив формулы (2) и (3) в формулу (1), получим:
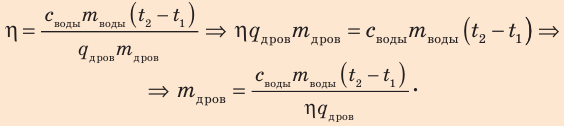
При нормальном атмосферном давлении вода кипит при температуре 100 °С. Удельную теплоемкость воды и удельную теплоту сгорания дров найдем соответственно в табл. 1 и 6 Приложения.
Проверим единицу, найдем значение искомой величины: 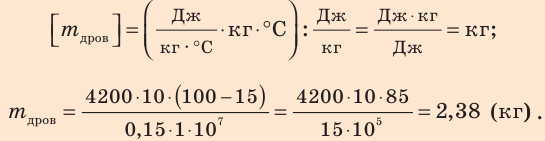
Анализ результата. Чтобы нагреть воду, туристам требуется 2,38 кг дров. Результат вполне реален.
Ответ: 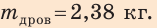
Итоги:
Химическая реакция горения топлива происходит с выделением теплоты. Количество теплоты, выделяющееся при полном сгорании топлива, вычисляют по формуле 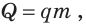 где q — удельная теплота сгорания топлива; m — масса топлива.
где q — удельная теплота сгорания топлива; m — масса топлива.
Удельная теплота сгорания топлива равна количеству теплоты, выделяющемуся в процессе полного сгорания 1 кг этого топлива. Эта физическая величина является характеристикой теплотворной способности топлива и измеряется в джоулях на килограмм 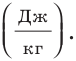
Сгорание топлива обычно происходит в нагревателях. КПД нагревателя обозначают символом η и вычисляют по формуле 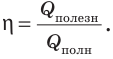 Как правило, КПД выражают в процентах:
Как правило, КПД выражают в процентах: 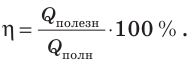
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |