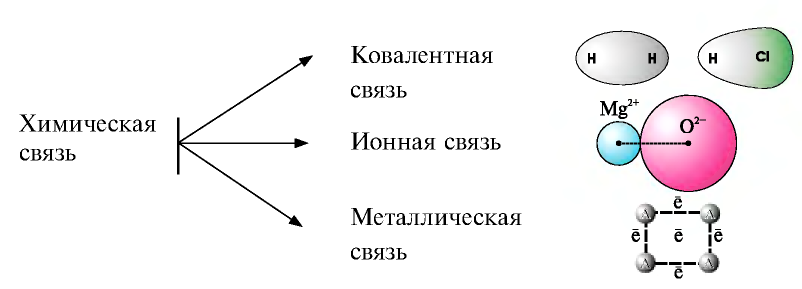
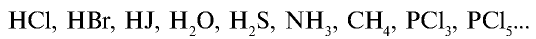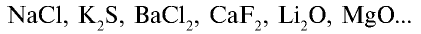Химические связи в химии - виды, типы, формулы и определения с примерами
Содержание:
Химические связи:
Известно, что атомы химических элементов, соединяясь друг с другом, образуют множество молекул простых и сложных веществ. Возникает вопрос, за счет какой силы в молекулах атомы связываются друг с другом?
В обычных условиях атомы инертных газов находятся в свободном состоянии (Не, Ne, Ar, Кг, Хе, Rn). Атомы любых других элементов не могут длительное время существовать в свободном состоянии и, соединяясь друг с другом, образуют простые и сложные вещества. Например, простые вещества — 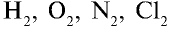
При изучении периодического закона и периодической таблицы химических элементов Д.И. Менделеева вы узнали, что любой химический элемент стремится привести число электронов на внешнем энергетическом уровне в завершенное состояние. Внешний энергетический уровень считается завершенным, если он содержит восемь электронов (для завершения первого энергетического уровня достаточно двух электронов).
Внешний энергетический уровень атомов инертных газов является завершенным по числу электронов, поэтому молекулы этих газов одноатомные и инертны в химическом отношении.
При образовании химических соединений ядра атомов элемента остаются неизменными, а число электронов на внешнем энергетическом уровне у элементов основной подгруппы и на внешнем и предыдущем энергетических уровнях у элементов побочной подгруппы — изменяется.
Относительная электроотрицательность химических элементов:
Чем объясняется более сильное, чем у хлора, свойство электроотрицательности фтора?
Как известно, каждый химический элемент отличается от другого энергией связывания электронов внешнего энергетического уровня с ядром атома.
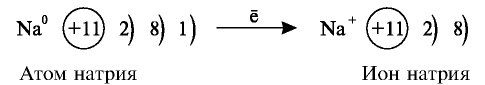
Так как у отдельных элементов s-электроны внешнего энергетического уровня слабо связаны с ядром, они относительно легко отделяются от атомов в процессе химических реакций. Такие элементы — металлы. Например, на внешнем энергетическом уровне атома натрия (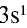 ) содержится один электрон, который легко отделяется и обнажает второй энергетический уровень. А на втором энергетическом уровне натрия находятся восемь электронов:
) содержится один электрон, который легко отделяется и обнажает второй энергетический уровень. А на втором энергетическом уровне натрия находятся восемь электронов:
У атомов неметаллов, напротив, электроны внешнего энергетического уровня связаны с ядром более прочно, поэтому атомы таких элементов в химических реакциях присоединяют электроны. Внешний энергетический уровень атома фтора содержит семь электронов и, принимая в химических реакциях электроны, пополняется восьмым электроном.
Свойство атома одного элемента захватывать электроны атомов другого элемента называется электроотрицательностью.
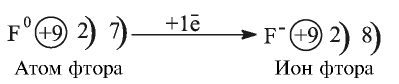
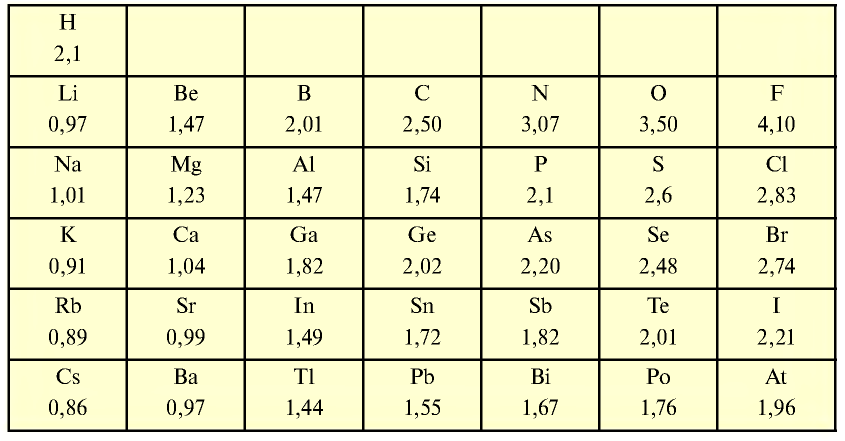
Выполнение расчетов с помощью абсолютных значений электроотрицательности является неудобным, поэтому на практике используются относительные значения электроотрицательности. В качестве эталона относительной электроотрицательности принята электроотрицательность лития, равная 1,0. Электроотрицательность остальных элементов определяется в сравнении с ним.
В периодах электроотрицательность химических элементов возрастает слева направо. В основных же подгруппах, наоборот, снижается сверху вниз. Следовательно, элемент с самой высокой электроотрицательностью — это фтор, с самой низкой — цезий, то есть 0,86.
Электроотрицательность неметаллов относительно велика, а у металлов — имеет низкие значения. Значения электроотрицательности элементов приводятся в табл. 16.
Таблица 16
Относительная электроотрицательность элементов
Элементы знаний, умений и навыков: электроотрицательность, относительная электроотрицательность, изменение относительной электроотрицательности в группах и периодах, сдвиги электронов в химических реакциях.
Виды химической связи
По какой причине появляются полярная и неполярная ковалентные связи?
С учетом значений относительной электроотрицательности химических элементов химические соединения можно разделить на следующие три группы.
1. Вещества, образующиеся из элементов с одинаковой электроотрицательностью, то есть из элементов с одинаковыми атомами:
- а)
 — простые вещества;
— простые вещества; - б) Li, Na, К, Al, Fe, Сu, Zn — металлы.
2. Вещества, образующиеся из атомов элементов, незначительно отличающихся друг от друга по электроотрицательности:
3. Вещества, образующиеся из атомов элементов, резко отличающихся друг от друга по электроотрицательности:
По распределению электронов в атомах, образующих химические соединения, химические связи можно разделить на три вида.
Ковалентная связь возникает между атомами, имеющими одинаковую или незначительно отличающуюся электроотрицательность. Рассмотрим, например, образование молекулы водорода 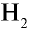 в результате соединения атомов водорода.
в результате соединения атомов водорода.
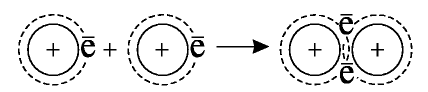
Это состояние можно записать также в упрощенном виде:

При соединении двух атомов водорода два электрона образуют электронную пару, за счет чего возникает молекула 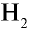 . В результате атомы водорода приобретают устойчивую электронную конфигурацию, то есть внешний энергетический уровень атома становится завершенным.
. В результате атомы водорода приобретают устойчивую электронную конфигурацию, то есть внешний энергетический уровень атома становится завершенным.
- — Связь атомов через посредство электронных пар называется ковалентной связью.
В молекулах кислорода 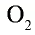 и азота
и азота 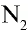 связь между атомами можно представить в следующем виде:
связь между атомами можно представить в следующем виде:
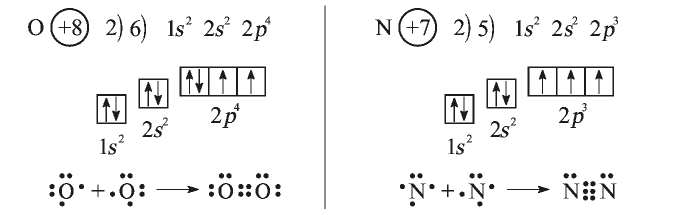
Атом кислорода имеет 2 нечетных электрона. Атом азота имеет 3 нечетных электрона.
В формулах каждая электронная пара, являющаяся общей для двух атомов, изображается черточкой (—): О = О, N = N.
| Вещество | Молекулярная формула | Электронная формула | Структурная формула |
|
Водород Кислород Азот |
 |
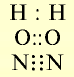 |
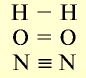 |
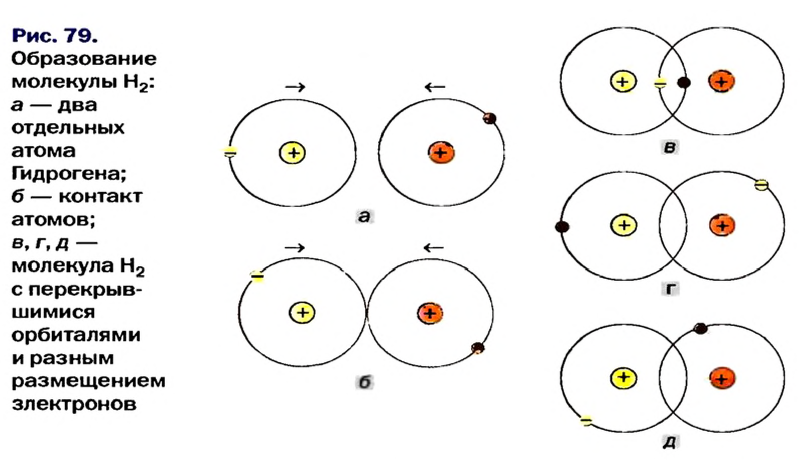
По числу электронных пар, участвующих в химической связи, можно узнать и валентность элемента:
- Н : Н — одновалентные атомы;
- О :: О — двухвалентные атомы;
- N :: N — трехвалентные атомы.
В рассмотренной выше связи атомы элементов  имеют одинаковую относительную электроотрицательность. При этом общие электронные пары расположены на одинаковом расстоянии от ядер атомов, то есть симметрично. Вследствие этого образовавшаяся молекула является неполярной.
имеют одинаковую относительную электроотрицательность. При этом общие электронные пары расположены на одинаковом расстоянии от ядер атомов, то есть симметрично. Вследствие этого образовавшаяся молекула является неполярной.
- — Химическая связь, которая возникает за счет образования электронных пар между атомами с одинаковой относительной электроотрицательностью, называется неполярной ковалентной связью.
Электронные пары, возникающие между атомами с различной относительной электроотрицательностью, смещаются в сторону атома с большей электроотрицательностью. Рассмотрим, например, образование молекулы хлорида водорода — НС1:
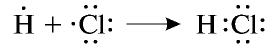
Видно, что общие электронные пары смещены в сторону атома хлора, имеющего большую электроотрицательность. В результате атом хлора становится отрицательно заряженным, а атом водорода с меньшей электроотрицательностью — положительно заряженным, то есть молекула поляризуется.
- — Химическая связь, которая возникает за счет образования электронных пар между атомами с различной относительной электроотрицательностью, называется полярной ковалентной связью.
Элементы знаний, умений и навыков: ковалентная связь, неполярная ковалентная связь, полярная ковалентная связь, электронная формула, структурная (графическая) формула, валентность, неполярная молекула, полярная молекула.
Донорно-акцепторная связь
При образовании каких соединений молекула аммиака служит донором?
В некоторых молекулах имеются атомы, электронные пары которых не участвуют в образовании химических связей, так называемые свободные пары.
Например, в молекуле воды 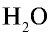 их две:
их две: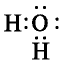 , в молекуле аммиака
, в молекуле аммиака  — одна:
— одна: 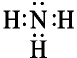 .
.
Некоторые атомы и ионы, или атомы, составляющие молекулу, обладают свободной орбиталью.
Между атомами, свободные электронные пары которых не участвовали в образовании химической связи, и атомами, имеющими свободные орбитали, возникает химическая связь. Эта связь, как и ковалентная, осуществляется за счет общих электронных пар. Однако общая электронная пара относится только к одному атому, предоставившему электронную пару. Он называется донором ("дающий'"), другой атом, соединяющийся с ним через свободную орбиталь, называется акцептором ("принимающий"):
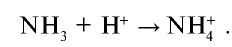
В молекуле аммиака имеется одна свободная электронная пара, относящаяся к атому азота, а ион водорода имеет свободную орбиталь.
Ион аммония является ионом с донорно-акцепторной связью. Атом азота —донор, ион водорода — акцептор.
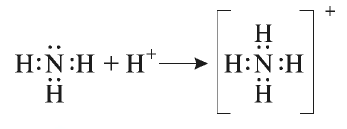
- — Связь, которая возникает между атомом с электронной парой, не участвовавшей в образовании химической связи, и атомом со свободной орбиталыо, называется донорно-акцепторной или координационной связью.
В атоме кислорода молекулы воды содержатся две электронные пары, не участвующие в химической связи:
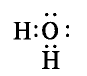
Атом кислорода присоединяет к себе ион водорода Н+ за счет своей свободной электронной пары и образует ион гидроксония:
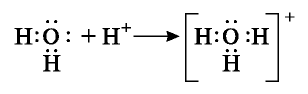
(в ионе водорода  lb-орбиталь свободная, то есть без электронов). В молекуле воды атом кислорода — донор, ион водорода — акцептор.
lb-орбиталь свободная, то есть без электронов). В молекуле воды атом кислорода — донор, ион водорода — акцептор.
Элементы знаний, умений и навыков: донорный атом, акцепторный атом, донорно-акцепторная связь.
Ионная связь
Существует ли сходство между ионами хлора и калия и электронной структурой атомов аргона? Если да, то почему их свойства различны?
Вы знакомы с соединениями, образованными атомами, которые резко отличаются друг от друга по электроотрицательности (NaCl, 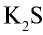 , LiF, СаО и др). Какой вид химической связи встречается в молекулах, образованных такими атомами?
, LiF, СаО и др). Какой вид химической связи встречается в молекулах, образованных такими атомами?
Чтобы ответить на этот вопрос, вспомним сначала строение атомов элементов (табл. 17).
Таблица 17
Строение атомов элементов С1, Аr и К
| Элемент | Символ элемента | Заряд ядра атома | Число электронов на внешних энергетических уровнях (n) | |||
| 1 | 2 | 3 | 4 | |||
| Хлор | С1 | +17 | 2 | 8 | 7 | — |
| Аргон | Аr | +18 | 2 | 8 | 8 | — |
| Калий | К | +19 | 2 | 8 | 8 | 1 |
Как видно из табл. 17, на внешнем энергетическом уровне атома хлора находятся 7 электронов, атома аргона — 8, атома калия — 1. Для завершения внешнего энергетического уровня атома хлора недостает одного электрона. У атома калия один электрон лишний. При столкновении атомов хлора и калия атом хлора принимает этот электрон, в результате энергетический уровень хлора заполняется восемью электронами. Атом калия, отдавая один электрон, обнажает свой третий энергетический уровень, образуя завершенный электронный слой с восемью электронами.
Атом хлора, принимая один электрон на свой внешний энергетический уровень, превращается в отрицательно заряженный ион, атом калия, отдав один электрон, превращается в положительно заряженный ион:
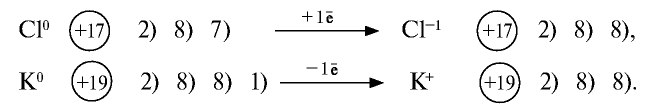
Металлы, отдавая электроны из внешних энергетических уровней, легко превращаются в положительно заряженные ионы. Наоборот, неметаллы легко присоединяют электроны на свой внешний энергетический уровень и превращаются в отрицательно заряженные ионы.
- Ионы — это заряженные частицы.
- Атомы, отдавая или присоединяя электроны, превращаются в заряженные частицы, или ионы.
- Число электронов, присоединенных или отданных атомами, определяет величину заряда.
- Противоположно заряженные ионы притягиваются друг к другу.
- Связь, которая возникает между ионами, называется ионной.
- Вещества, образованные в результате взаимного соединения ионов, называются ионными соединениями.
К ионным соединениям относятся соединения, образованные металлами, галогенами, кислородом и серой. Например, NaCl, KBr, 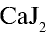 ,
, 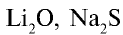 и др.
и др.
Связи, возникающие в солях между ионом металла и кислотным остатком, в щелочах между ионом металла и гидроксильной группой, также имеют характер ионной связи.
Таким образом, в химических связях важное значение имеют валентные электроны элементов, которые образуют электронные пары между атомами. По положению электронов, участвующих в химических связях между атомами, вещества делятся на соединения с неполярной ковалентной, полярной ковалентной, донорно-акцепторной и ионной связью.
Элементы знаний, умений и навыков: ионы, положительно заряженные ионы, отрицательно заряженные ионы, ионная связь, ионные соединения.
Кристаллическая решетка
В какой зависимости находятся физические свойства твердых веществ и природа химических связей между частицами вещества?
В обычных условиях все вещества обладают различными физическими свойствами и находятся в твердом, жидком или газообразном состоянии.
В отличие от молекул газообразных веществ, молекулы твердых веществ не рассеиваются, а в отличие от молекул жидких веществ — не просачиваются и не изменяют форму вещества (вспомните знания, полученные в курсе физики). Следовательно, твердые вещества образуют в пространстве определенную форму и имеют объем. Внешний вид и физические свойства твердых веществ зависят от природы химических связей между частицами, образующими эти вещества. Эти частицы (ионы, атомы и молекулы) располагаются в определенном порядке (кроме аморфных веществ). Так, частицы кристаллов образуют во всем объеме решетку определенной формы, которая называется кристаллической решеткой.
В зависимости от вида частиц, образующих кристаллические решетки, они делятся на четыре типа.
- Ионная кристаллическая решетка. В узлах кристаллической решетки расположены положительно и отрицательно заряженные ионы, связанные между собой ионной связью. Например, вещества с ионной кристаллической решеткой — это соли типичных металлов (NaCl,
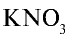 ,
, 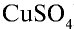 ), щелочи (NaOH, КОН, Са(
), щелочи (NaOH, КОН, Са(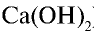 ) и некоторые оксиды.
) и некоторые оксиды. - Атомная кристаллическая решетка. В узлах кристаллической решетки расположены атомы, связанные между собой ковалентной связью. Например, атомную кристаллическую решетку имеют такие простые вещества, как алмаз, графит, кремний, германий, бор и др.
- Молекулярная кристаллическая решетка. В узлах кристаллической решетки расположены молекулы. Например, в узлах кристаллической решетки простых веществ молекулы с неполярной ковалентной связью (
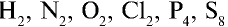 в твердом состоянии), а также молекулы с полярной ковалентной связью (
в твердом состоянии), а также молекулы с полярной ковалентной связью (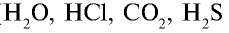 в твердом состоянии).
в твердом состоянии). - Металлическая кристаллическая решетка. В узлах кристаллической решетки расположены атомы металлов и положительно заряженные ионы, связанные между собой металлической связью. Например, такая решетка свойственна всем металлам (Na, Ва, Zn, А1, Си, Аи).
Свойства:
В узлах кристаллической решетки поваренной соли содержатся ионы натрия (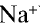 ) и хлора (
) и хлора (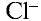 ). Эти противоположно заряженные ионы притягиваются друг к другу посредством ионной связи, а ионы
). Эти противоположно заряженные ионы притягиваются друг к другу посредством ионной связи, а ионы 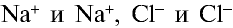 отталкиваются друг от друга. В результате ион
отталкиваются друг от друга. В результате ион 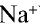 с шести сторон окружен ионами
с шести сторон окружен ионами 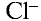 , ион
, ион 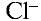 также окружен с шести сторон ионами
также окружен с шести сторон ионами 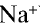 .
.
Благодаря расположению ионов в определенном порядке кристаллы поваренной соли приобретают кубическую форму (рис. 12). Ионы весьма прочно связаны между собой посредством ионной связи, что обусловливает прочность, трудную растворимость и нелетучесть ионных соединений.
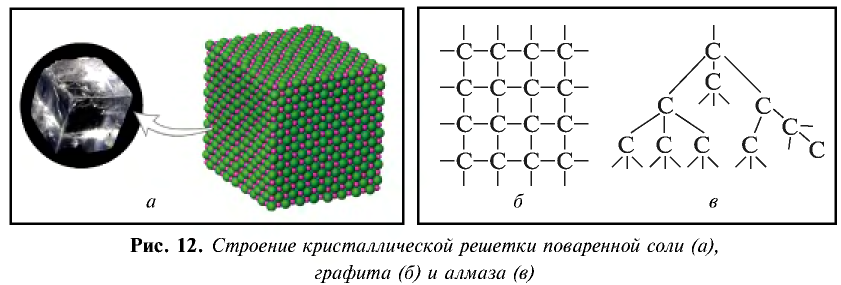
В узлах кристаллов веществ, имеющих атомную кристаллическую решетку, например, алмаза, находятся атомы углерода, которые образуют с четырьмя соседними атомами углерода кристаллы в форме пирамиды (тетраэдра). При этом каждый атом притягивается к соседнему посредством ковалентной связи.
В узлах молекулярной кристаллической решетки кристаллических веществ расположены молекулы, которые притягиваются друг к другу благодаря силе межмолекулярного притяжения. Сила взаимного притяжения молекул весьма слаба по сравнению с ионной и ковалентной связью, поэтому вещества, образующие молекулярную кристаллическую решетку, легко плавятся и улетучиваются. Например, сахар легко растворяется, йод или камфора легко улетучиваются. Вещества, находящиеся в обычных условиях в жидком или газообразном состоянии, при охлаждении переходят в твердое состояние. Вода может превратиться в лед, а диоксид углерода перейти в состояние "сухого" льда.
Элементы знаний, умений и навыков: кристаллическая решетка, ионная, атомная, молекулярная, металлическая кристаллическая решетка.
Степени окисления элементов в соединениях
Как изменяются степени окисления элементов при получении меди путем восстановления оксида меди (II) водородом?
В соединениях с полярной ковалентной и ионной связью электроны, участвующие в химических связях, смещены в сторону атома с большей электроотрицательностью или полностью переходят к ним. Атомы, отталкивающие от себя электроны, называются атомами, отдающими электроны. Атомы, притягивающие к себе электроны, — атомами, присоединяющими электроны.
Число электронов, отданных и присоединенных атомами, называется степенью окисления этих атомов. Если элемент отдает один электрон, степень окисления равна +1, если присоединяет, —1; если отдает два электрона, степень окисления составляет +2, если присоединяет , —2; если отдает три электрона, степень окисления равна +3, если присоединяет, —3.
Пояснение. При написании зарядов ионов величина заряда ставится перед знаками плюс "+" или минус "—". Например: 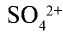 ,
, 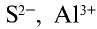
А при написании степени окисления элементов ее значение записывается после знаков плюс "+" или минус "—" . Например, 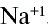 ,
, 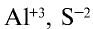 и т.д.
и т.д.
В веществах с неполярной ковалентной связью, то есть в простых веществах, степень окисления элемента равна нулю, так как общие электронные пары между атомами не сдвинуты в сторону какого-либо атома, то есть распределены равноценно. Например: 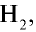
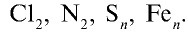
Определение степени окисления атомов в молекуле сульфида алюминия.
- Символ элемента (электроположительного), отдавшего электрон, записывается первым, символ элемента, присоединившего электрон (электроотрицательного), записывается вторым. Например,
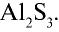 Следовательно, алюминий отдает электрон, а сера — принимает.
Следовательно, алюминий отдает электрон, а сера — принимает. - На внешнем энергетическом уровне атома алюминия имеется три электрона, а атома серы — шесть. Атом серы электроотрицателен относительно атома алюминия и принимает на внешний энергетический уровень два электрона, поэтому степень окисления серы равна —2. Атом алюминия отдает три электрона с внешнего энергетического уровня, и степень его окисления равна +3. Два атома алюминия отдают по три электрона каждый трем атомам серы:
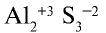 .
.
Сумма степеней окисления атомов химических соединений всегда равна нулю:
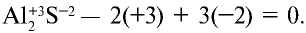
Определение степени окисления фосфора в фосфорной кислоте 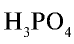 .
.
- Самый электроотрицательный элемент фосфорной кислоты — это кислород. Он принимает два электрона, и степень окисления его составляет —2. Степень окисления водорода равна +1.
- Сумма степеней окисления атомов фосфорной кислоты равна нулю:
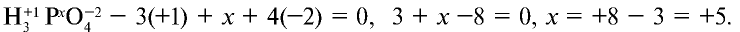
Следовательно, степень окисления фосфора +5: 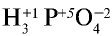 . При определении степеней окисления химических элементов следует помнить, что:
. При определении степеней окисления химических элементов следует помнить, что:
- в простых веществах степень окисления атомов равна нулю (
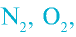
 );
); - степень окисления атомов металлов всегда положительна;
- степень окисления неметаллов бывает как положительной, так и отрицательной, за исключением фтора, степень окисления которого равна —1.
Например, степень окисления водорода в его гидридах, образуемых с металлами, составляет —1, в других соединениях +1.
Атом кислорода в соединениях с фтором отдает электрон атому фтора, поэтому степень окисления его равна +2, тогда как в остальных соединениях этот показатель составляет —2 .
В пероксидах степень окисления кислорода равна —1. Например. 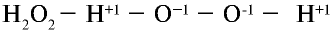 (рис. 13).
(рис. 13).
- Высшая степень окисления элементов основной подгруппы соответствует номеру группы, в которой они находятся:

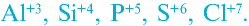
- Высшая степень окисления элементов побочной подгруппы также равна номеру группы.
Так, 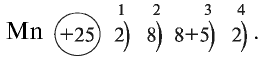 Марганец — элемент седьмой группы, поэтому его высшая степень окисления равна +7.
Марганец — элемент седьмой группы, поэтому его высшая степень окисления равна +7.
- Низшая степень окисления элемента равна разности числа 8 и количества валентных электронов. Например, сера является элементом седьмой группы и имеет шесть валентных электронов.
Отсюда степень окисления серы равна: (8 — 6 = 2) — 2 .
Элементы знаний, умений и навыков: степень окисления, соединения со степенью окисления, равной нулю, отрицательная степень окисления, положительная степень окисления, степень окисления элементов в соединениях.
Окислительно-восстановительные реакции
Как вы объясните восстановление атома хлора при образовании поваренной соли?
В зависимости от того, изменяются или не изменяются степени окисления атомов элементов, участвующих в химических реакциях, они подразделяются на две группы.
1. Реакция взаимодействия оксида меди (II) и серной кислоты:
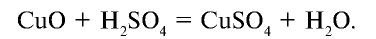
Степени окисления атомов веществ, участвующих в реакции, после реакции не изменились.
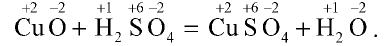
Такие реакции не являются окислительно-восстановительными.
2. Реакция натрия с хлором:
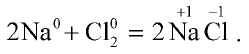
В этой реакции атомы натрия отдают электроны с внешнего энергетического уровня атомам хлора:
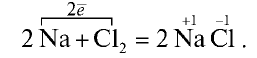
В результате реакции атомы натрия отдают один электрон и приобретают степень окисления +1, а атомы хлора принимают электроны и их степень окисления составляет —1.
При изучении химических свойств кислорода вы узнали, что кислород является окислителем. Рассмотрим это понятие с точки зрения электронного строения атомов. Вступая в реакцию с металлами, неметаллами и сложными веществами, атом кислорода принимает два электрона, чтобы заполнить свой внешний энергетический уровень, и его степень окисления составляет —2 .
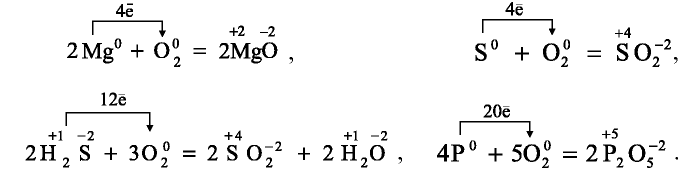
А при изучении свойств водорода мы наблюдаем следующие процессы:
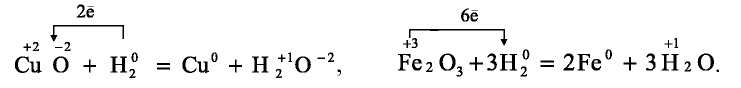
Металлы с положительной степенью окисления принимают от атома водорода два электрона и их степень окисления становится равной нулю, а атом водорода отдает электрон и проявляет степень окисления +1.
- — Реакции, протекающие с изменением степени окисления элементов, называются окислительно-восстановительными.
- — В окислительно-восстановительных реакциях атом элемента или ион, присоединивший электрон, называется окислителем, атом элемента или ион, отдавший электрон, называется восстановителем.
- — В химическом процессе окислитель, принимая электрон, восстанавливается, восстановитель, отдавая электрон, окисляется.
В химических процессах металлы всегда отдают электроны. Следовательно, металлы всегда являются восстановителями. Неметаллы же (за исключением фтора) в химических процессах могут быть и окислителями, и окислителями, и восстановителями. Например, если в реакции 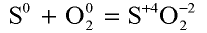 атом серы отдает атому кислорода четыре электрона
атом серы отдает атому кислорода четыре электрона
и окисляется, то в реакции 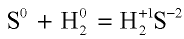 атом серы принимает два электрона и восстанавливается.
атом серы принимает два электрона и восстанавливается.
В химических процессах степени окисления элементов изменяются в зависимости от количества отданных и принятых электронов (см. схему):
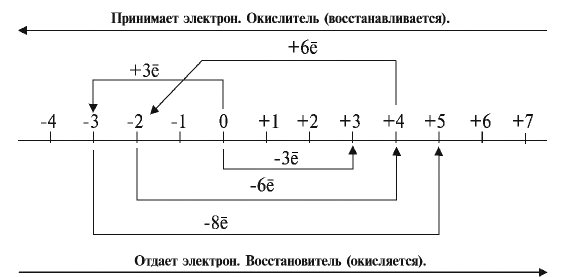
Если степень окисления элемента изменяется с —3 на +5:
- он отдает 8 электронов;
- является восстановителем;
- окисляется.
Если степень окисления элемента изменяется с +4 на —2:
- он принимает 6 электронов;
- является окислителем;
- восстанавливается.
Элементы знаний, умений и навыков: окислительно-восстановительные реакции, окислитель, восстановитель, только окислитель, только восстановитель, и окислитель, и восстановитель.
Составление уравнений окислительно—восстановительных реакций
На что нужно обращать внимание при написании уравнений и проставлении коэффициентов окислительно-восстановительных реакций?
Число электронов, присоединенных окислителем (атом, ион), участвующим в химической реакции, должно быть равно числу электронов, отданных восстановителем.
Рассмотрим примеры по написанию уравнений окислительно-восстановительных реакций, их уравниванию и определению веществ (молекул, атомов, ионов), являющихся окислителями и восстановителями.
Пример №1
При растворении металла алюминия в соляной кислоте образуется соль хлорида алюминия и выделяется водород. Если станет известно, что реакция окислительно-восстановительная, уравняйте ее методом электронного баланса.
Решение.
Подчеркнем элементы, степени окисления которых изменились в данном химическом процессе, и запишем над каждым элементом его степень окисления:
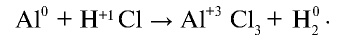
(Степень окисления хлора, участвующего в химическом процессе, до и после реакции не изменилась).
Составим схему, отражающую число электронов, принятых и отданных окислителем и восстановителем:
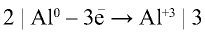 (восстановитель — окисляется),
(восстановитель — окисляется),
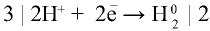 (окислитель — восстанавливается).
(окислитель — восстанавливается).
Количество электронов, принятых окислителем, является коэффициентом восстановителя, а число электронов, отданных восстановителем, — коэффициентом восстановленного вещества:
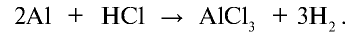
Исходя из поставленных в уравнение коэффициентов, уравняем реакцию:

Пример №2
При взаимодействии алюминия с разбавленной азотной кислотой образуются нитрат алюминия, оксид азота (I) и вода. Уравняйте эту химическую реакцию методом электронного баланса.
Решение.
Запишем уравнение реакции и определим элементы, степени окисления которых изменились:
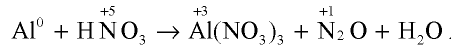
В данном химическом процессе атом алюминия отдает три электрона и проявляет степень окисления +3, степень окисления азота изменяется с +5 на +1, так как каждый атом азота присоединяет по четыре электрона, то есть восемь электронов:
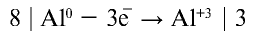 (восстановитель — окисляется),
(восстановитель — окисляется),
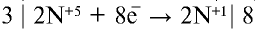 (окислитель — восстанавливается).
(окислитель — восстанавливается).
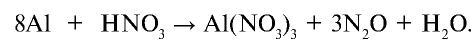
Исходя из поставленных в уравнение коэффициентов 8 и 3 уравняем реакцию:
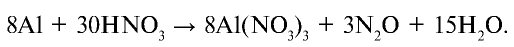
Пример №3
В результате прокаливания перманганата калия выделяются манганат калия, оксид марганца (IV) и кислород. Запишите уравнение этой реакции и уравняйте ее. Чему равна сумма всех коэффициентов?
Решение.
Запишем уравнение реакции и отметим элементы с изменившимися степенями окисления:
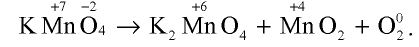
Атомы марганца, имеющего степень окисления +7, являются окислителем, а атомы кислорода, имеющего степень окисления —2, — восстановителем:
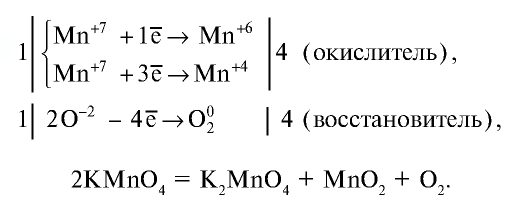
Ответ: Сумма коэффициентов равна 5.
— Окислитель и восстановитель входят в состав одного вещества, и обмен электронами происходит между частицами этого вещества. Окислительно-восстановительные реакции такого типа называются внутримолекулярными окислительно-восстановительными реакциями.
Пример №4
При расщеплении пероксида водорода при участии катализатора ( ) образуются вода и кислород. Запишите уравнение реакции и уравняйте ее.
) образуются вода и кислород. Запишите уравнение реакции и уравняйте ее.
Решение.
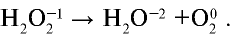
Степень окисления атомов кислорода в молекуле пероксида водорода равна -1:
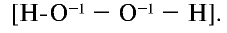
Часть атомов кислорода, имеющего степень окисления —1, проявляет степень окисления —2, другая часть —0:
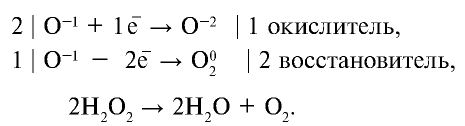
— Окислительно-восстановительные реакции, в которых часть атомов одной молекулы, имеющих промежуточную степень окисления, проявляет большую степень окисления, а другая часть — низшую степень окисления, называются реакциями диспропорционирования.
Элементы знаний, умений и навыков: умение распознавать окис-лительно-восстановительные реакции, определять степени окисления элементов, участвующих в химическом процессе, распознавать элементы, отдающие и присоединяющие электроны, классифицировать окислительно-восстановительные реакции, межмолекулярные, внутримолекулярные, диспропорционирования.
Пример №5
Определите степени окисления марганца и хрома в соединениях 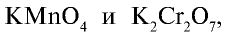 зная, что сумма степеней окисления элементов в соединении равна нулю.
зная, что сумма степеней окисления элементов в соединении равна нулю.
Решение.
Сумма степеней окисления элементов, входящих в состав любого вещества, равна нулю. Степень окисления калия всегда равна +1. Степень окисления кислорода в данных соединениях равна —2. Степени окисления марганца и хрома неизвестны.
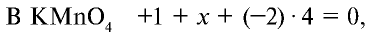
откуда 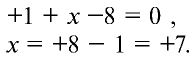
Следовательно, степень окисления марганца в  равна +7.
равна +7.
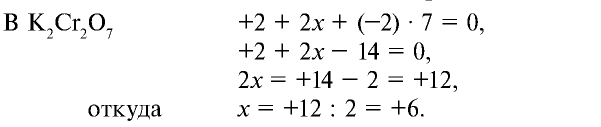
Следовательно, степень окисления хрома в  равна +6.
равна +6.
Пример №6
Какой элемент окисляется и какой восстанавливается в следующих реакциях между простыми веществами?

Решение.
Элемент, отдавший электрон, является восстановителем и окисляется. Элемент, присоединивший электрон, является окислителем и восстанавливается.
- В реакции
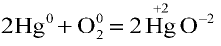 кислород восстанавливается, ртуть окисляется.
кислород восстанавливается, ртуть окисляется. - В реакции
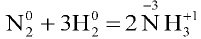 азот присоединяет электроны и восстанавливается, водород отдает электроны и окисляется.
азот присоединяет электроны и восстанавливается, водород отдает электроны и окисляется. - В реакции
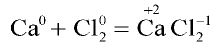 кальций отдает электроны и окисляется, хлор присоединяет электроны и восстанавливается.
кальций отдает электроны и окисляется, хлор присоединяет электроны и восстанавливается. - В реакции
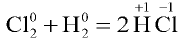 хлор присоединяет электроны и восстанавливается, водород отдает электроны и окисляется.
хлор присоединяет электроны и восстанавливается, водород отдает электроны и окисляется.
Пример №7
Концентрированная азотная кислота, являющаяся сильным окислителем, вступает во взаимодействие с цинком. При этом протекает следующая реакция: 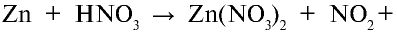
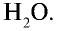 Уравняйте уравнение этой реакции методом электронного баланса.
Уравняйте уравнение этой реакции методом электронного баланса.
Решение.
1) по уравнению реакции определим элементы с изменившимися степенями окисления и запишем над символами элементов их степени окисления:
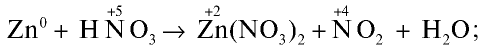
2) определим элементы, присоединившие или отдавшие электроны:
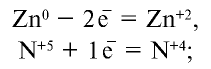
3) суммы степеней окисления окислителя и восстановителя, присоединившего или отдавшего электроны, должны быть равны между собой. Уравняем электроны:
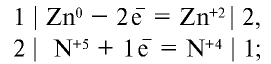
4) подставим коэффициенты в уравнения реакций, исходя из того, что один атом цинка отдает двум атомам азота, перешедшего в 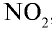 , по одному электрону:
, по одному электрону:
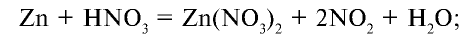
5) на основе предыдущего действия уравняем уравнение:
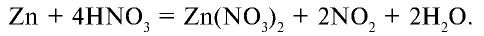
Химическая связь и строение вещества
Атомы почти всех элементов не могут долго существовать поодиночке. Они соединяются с такими же или другими атомами. Многие атомы металлического элемента, соединяясь вместе, образуют металл. Алмаз, графит, красный фосфор состоят из соединенных между собой атомов неметаллических элементов. Два атома Оксигена объединяются в молекулу 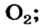 из таких молекул состоит газ кислород. Вода содержит молекулы
из таких молекул состоит газ кислород. Вода содержит молекулы 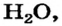 каждая из которых образована двумя атомами Гидрогена и одним атомом Оксигена. Натрий хлорид
каждая из которых образована двумя атомами Гидрогена и одним атомом Оксигена. Натрий хлорид  состоит не из молекул, а из ионов
состоит не из молекул, а из ионов 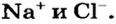
Соединение частиц любого типа происходит с выделением энергии.
Взаимодействие между атомами, молекулами, ионами, благодаря которому частицы удерживаются вместе, называют химической связью.
Почему и как соединяются атомы? Чем обусловлено превращение электронейтральных атомов в заряженные частицы — ионы? Как зависят физические свойства веществ от их строения? Ответы на эти и другие вопросы вы найдете в материале данного раздела. Узнаете и о том, что при образовании химической связи электронные оболочки атомов претерпевают определенные изменения.
Электронное строение атомов инертных элементов
Среди всех простых веществ лишь инертные газы — гелий, неон, аргон, криптон, ксенон и радон — состоят из отдельных атомов. Долгое время ученым не удавалось осуществить химические реакции с участием инертных газов; их атомы «не хотели» соединяться с атомами других элементов. Причина химической пассивности этих веществ стала понятной позже, после открытия строения атомов.
Электронное строение атомов первых трех инертных элементов таково:
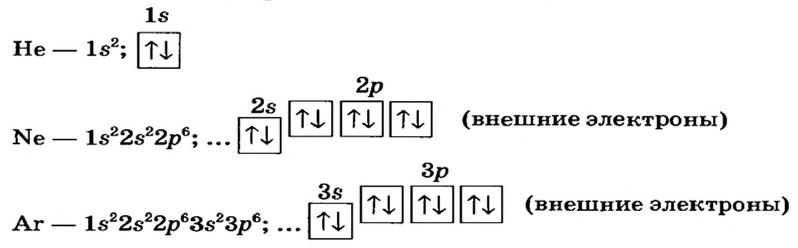
Два электрона в атоме Гелия заполняют первый энергетический уровень. Электронная оболочка атома Неона состоит из двух заполненных уровней: первый содержит 2 электрона, а второй — 8. В атоме Аргона, кроме этих уровней, есть третий, незавершенный. На нем размещаются 8 электронов, которые заполняют 3s- и Зр-подуровни.
Атомы Криптона, Ксенона и Радона также имеют на последнем (незавершенном) энергетическом уровне по 8 электронов (среди них — два s-электрона и шесть р-электронов).
Учитывая химическую пассивность инертных газов и строение атомов соответствующих элементов, приходим к такому выводу: внешняя 8-электронная оболочка является для атома выгодной и устойчивой. Ее часто называют электронным октетом.
Образование положительно заряженных ионов
Натрий (элемент № 11) находится в периодической системе после инертного элемента Неона. Электронная формула атома Натрия — 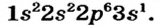 На последнем энергетическом уровне в атоме имеется лишь один электрон, а на предпоследнем — октет электронов
На последнем энергетическом уровне в атоме имеется лишь один электрон, а на предпоследнем — октет электронов 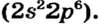 Не удивительно, что атом Натрия легко теряет Зs-электрон. Какая же частица образуется при этом? Ядро атома не изменяется (а значит, и сам элемент). В нем содержится 11 протонов (заряд ядра равен + 11), а электронов становится на один меньше, т. е. 10 (их суммарный заряд равен —10). Электронейтральный атом превращается в частицу, которая имеет заряд:
Не удивительно, что атом Натрия легко теряет Зs-электрон. Какая же частица образуется при этом? Ядро атома не изменяется (а значит, и сам элемент). В нем содержится 11 протонов (заряд ядра равен + 11), а электронов становится на один меньше, т. е. 10 (их суммарный заряд равен —10). Электронейтральный атом превращается в частицу, которая имеет заряд: 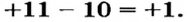 Это — ион Натрия
Это — ион Натрия 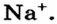 Его электронное строение такое же, как и атома инертного элемента Неона; ион Натрия является устойчивой частицей с внешним электронным октетом.
Его электронное строение такое же, как и атома инертного элемента Неона; ион Натрия является устойчивой частицей с внешним электронным октетом.
Запишем схему превращения атома Натрия в ион и электронные формулы этих частиц:
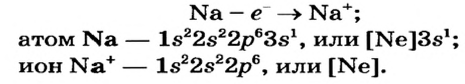
Электронный октет мог бы образоваться иначе — в результате присоединения к единственному внешнему электрону атома Натрия еще семи. Однако этого не происходит. Очевидно, атому легче отдать один электрон, чем присоединить семь.
Вы знаете, что положительно заряженные ионы называют катионами. В каждом катионе содержится больше протонов, чем электронов.
Катионы 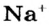 входят в состав почти всех соединений Натрия, среди которых — оксид
входят в состав почти всех соединений Натрия, среди которых — оксид 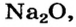 гидроксид
гидроксид 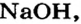 различные соли.
различные соли.
Атомы металлических элементов имеют на внешнем энергетическом уровне небольшое количество электронов (как правило, от одного до трех) и способны от (авать их, превращаясь в катионы.
Образование отрицательно заряженных ионов
В атоме элемента № 17 Хлора на внешнем энергетическом уровне находится 7 электронов 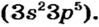 Этот атом способен присоединить один электрон (который может отдать ему, например, атом Натрия) и превратиться в ион
Этот атом способен присоединить один электрон (который может отдать ему, например, атом Натрия) и превратиться в ион 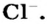 Электронное строение иона Хлора такое же, как и атома инертного элемента Аргона.
Электронное строение иона Хлора такое же, как и атома инертного элемента Аргона.
Схема превращения атома Хлора в ион и электронные формулы этих частиц таковы:
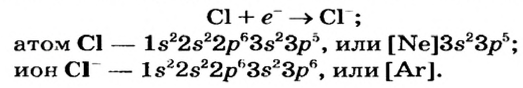
Отрицательно заряженные ионы называют анионами. В состав каждого аниона входит больше электронов, чем протонов.
Анионы 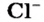 содержатся в солях хлоридной кислоты — натрий хлориде
содержатся в солях хлоридной кислоты — натрий хлориде 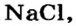 кальций хлориде
кальций хлориде 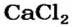 и др.
и др.
Атомы неметаллических элементов (кроме инертных) имеют на внешнем энергетическом уровне от четырех до семи электронов и способны присоединять дополнительные электроны, превращаясь в анионы.
Большинство простых (одноатомных) ионов содержат на внешнем энергетическом уровне октет электронов.
Отличия ионов от атомов
Катион и атом Натрия имеют одинаковые заряды ядер (+11), анион и атом Хлора — тоже (+17). Однако состав электронных оболочек, размеры (радиусы), свойства простого иона и атома каждого элемента различны. Кроме того, ионы — заряженные частицы, а атомы — электронейтральные.
Электронное строение атомов  ионов
ионов  а также радиусы этих частиц приведены на схеме 18.
а также радиусы этих частиц приведены на схеме 18.
Сопоставив радиусы атомов и ионов, катионов и анионов, можно обнаружить такие закономерности:
- • радиусы катионов меньше, чем радиусы соответствующих атомов;
- • радиусы анионов и соответствующих атомов почти одинаковы;
- • радиусы большинства анионов превышают радиусы катионов.
Сравним некоторые свойства катиона и атома Гидрогена. Ионы 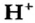 содержатся в водном растворе кислоты и придают ему кислый вкус.
содержатся в водном растворе кислоты и придают ему кислый вкус.
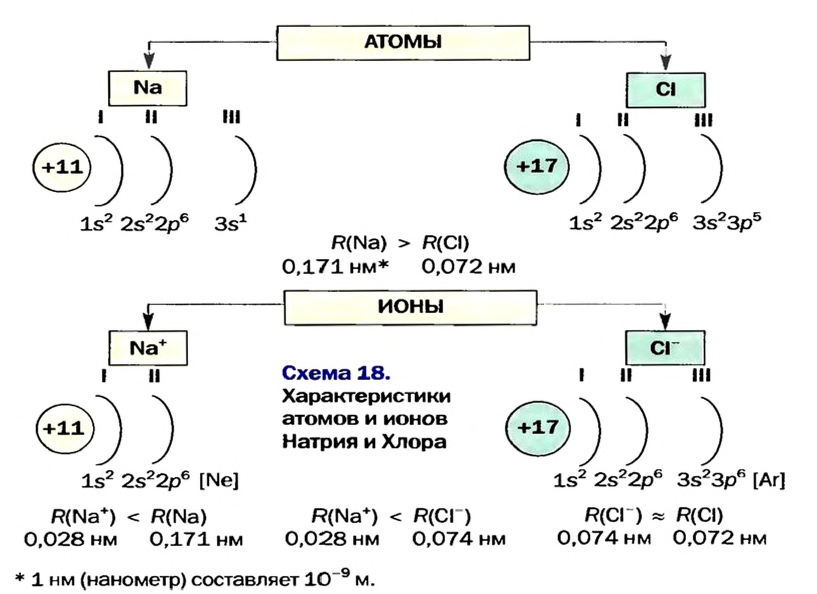
Атомы Гидрогена таким свойством не обладают. В отличие от ионов, они легко соединяются друг с другом в молекулы 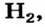 из которых состоит простое вещество — водород.
из которых состоит простое вещество — водород.
Выводы:
Наиболее устойчивая внешняя электронная оболочка атома или простого иона содержит восемь электронов.
Атомы металлических элементов способны отдавать электроны внешней оболочки и превращаться в катионы, а атомы неметаллических элементов — присоединять электроны и превращаться в анионы.
Катионы имеют меньшие радиусы, чем соответствующие атомы. Радиусы анионов почти не отличаются от радиусов атомов.
Ионная связь и ионные соединения
Многие вещества состоят из ионов. Положительно заряженные ионы в результате действия электростатических сил соединяются с отрицательно заряженными.
Взаимодействие между противоположно заряженными ионами в веществе называют ионной связью.
Катион и анион притягиваются друг к другу тем сильнее, чем больше заряд каждой частицы и чем меньше расстояние между ними, а в случае их контакта — чем меньше их радиусы. На это указывает один из законов физики, который вы будете изучать в 9 классе.
Соединения, состоящие из ионов, называют ионными соединениями.
К ионным соединениям относятся основные и амфотерные оксиды, щелочи, соли. Все эти вещества содержат катионы металлических элементов (например, 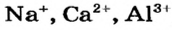 ). Анионами в ионных оксидах являются ионы
). Анионами в ионных оксидах являются ионы 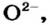 в щелочах —
в щелочах — 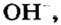 а в солях — ионы кислотных остатков
а в солях — ионы кислотных остатков 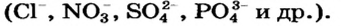
Отметим, что из ионов состоят некоторые другие бинарные соединения, образованные типичными металлическими элементами, например 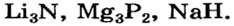 Вместе с тем ни одно соединение двух неметаллических элементов, например хлороводород
Вместе с тем ни одно соединение двух неметаллических элементов, например хлороводород 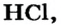 углекислый газ
углекислый газ 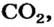 не содержит ионов.
не содержит ионов.
Вы уже научились составлять формулы ионных соединений — оксидов металлических элементов, оснований, солей. Напомним, что для этого нужно знать состав и заряды соответствующих катиона и аниона. Помните: в ионном соединении сумма зарядов всех катионов и анионов равна нулю.
Формула ионного соединения указывает на соотношение в нем катионов и анионов.
Строение ионных соединений
Все ионные соединения в обычных условиях являются, как правило, кристаллическими веществами. Кристаллическое строение имеют многие молекулярные и атомные вещества, а также металлы.
Из курса химии вам известно, что кристалл — это естественное твердое тело, которое имеет плоские грани (поверхности) и прямые ребра (стыки поверхностей). Такая форма тела является результатом четкой последовательности в размещении атомов, молекул или ионов в веществе.
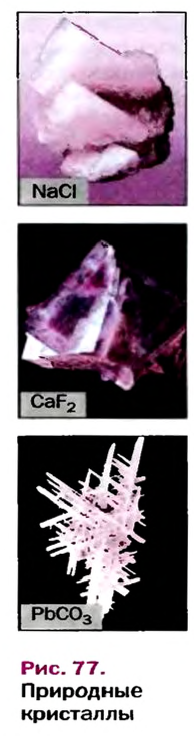
Кристаллы каждого вещества имеют характерную форму (рис. 77). Если посмотреть на поваренную соль через увеличительное стекло, то увидим множество бесцветных прозрачных кубиков.
Кроме кристаллических, существуют аморфные твердые вещества. К ним, в частности, относится стекло. Оно состоит из катионов 
 и анионов различных силикатных кислот. Даже в изготовленном стеклянном кубике или предмете другой правильной формы отсутствует порядок в расположении ионов. Если стеклянный предмет разбить, то получим осколки произвольной, несимметричной формы; их поверхности не будут плоскими, а ребра — прямыми.
и анионов различных силикатных кислот. Даже в изготовленном стеклянном кубике или предмете другой правильной формы отсутствует порядок в расположении ионов. Если стеклянный предмет разбить, то получим осколки произвольной, несимметричной формы; их поверхности не будут плоскими, а ребра — прямыми.
В кристалле ионного вещества каждый катион находится в контакте с определенным количеством анионов, а анион — с таким же или другим количеством катионов. В любом направлении наблюдается строгое чередование катионов и анионов.
Последовательность размещения ионов внутри кристалла зависит от состава вещества, т. е. соотношения катионов и анионов, а также от соотношения радиусов этих частиц.
Кристаллическая решетка
Внутреннее строение кристаллов описывают с помощью модели, название которой — кристаллическая решетка. Это схема или объемный макет размещения частиц в небольшой части кристалла (рис. 78). Исходя из такой модели, можно воспроизвести строение вещества в целом.
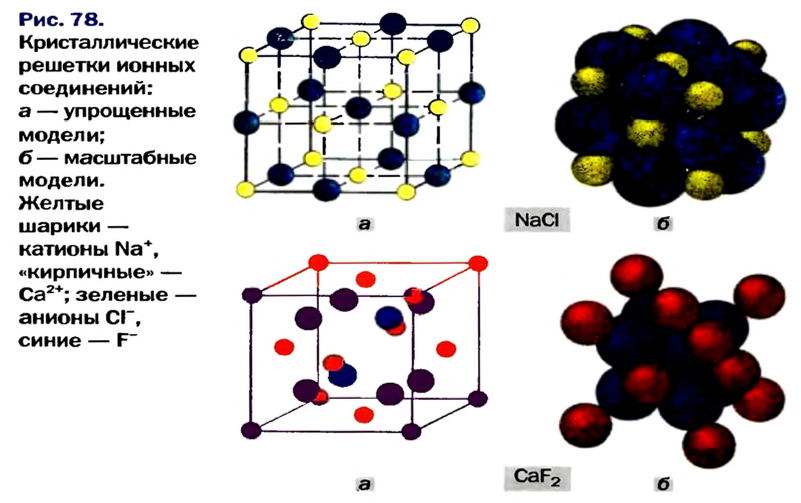
Шарики в кристаллической решетке имитируют частицы вещества — ионы, атомы, молекулы. Они размещены в так называемых узлах кристаллической решетки- В упрощенных моделях (рис. 78, а) шарики имеют произвольные радиусы и не касаются друг друга. Существуют еще и масштабные модели (рис. 78, б). В них радиусы шариков пропорциональны радиусам частиц и ближайшие шарики контактируют друг с другом (частицы, как правило, плотно «упакованы» в кристалле). Упрощенная модель является более наглядной, так как маленькие шарики в ней не мешают «заглянуть» внутрь кристалла. Ее мы будем использовать чаще.
Физические свойства ионных соединений
Ионы соединяются друг с другом достаточно прочно. Для того чтобы разрушить ионную связь, необходимо затратить немалую энергию. Этим объясняют высокие температуры плавления и кипения большинства ионных веществ. При плавлении кристаллы разрушаются, связи между ионами ослабевают, а при кипении ионы отделяются друг от друга и «вылетают» из жидкости. Натрий хлорид NaCl плавится при температуре +801 °С (ее нельзя достичь, нагревая вещество с помощью спиртовки или лабораторной газовой горелки), а кипит при температуре 1440 °С. Температуры плавления и кипения другого ионного соединения — магний оксида 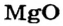 — еще выше: 2825 и 3600 °С. Объяснить это можно так. Ионы
— еще выше: 2825 и 3600 °С. Объяснить это можно так. Ионы 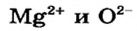 имеют большие заряды и меньшие радиусы, чем ионы
имеют большие заряды и меньшие радиусы, чем ионы 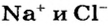 соответственно, и потому прочнее соединяются. Для того чтобы расплавить магний оксид, нужно нагреть соединение до более высокой температуры.
соответственно, и потому прочнее соединяются. Для того чтобы расплавить магний оксид, нужно нагреть соединение до более высокой температуры.
Ионные вещества в твердом состоянии не проводят электрический ток, а в жидком (расплавленном) являются электропроводными.
Известно, что электрический ток представляет собой направленное движение заряженных частиц (электронов, ионов). В кристалле ионы занимают фиксированные положения и перемещаться не могут. Во время плавления вещества кристаллы превращаются в жидкость, в которой ионы перемещаются в произвольных направлениях. При погружении в расплав электродов, соединенных с источником постоянного тока (аккумулятором), катионы начинают двигаться к отрицательно заряженному электроду, анионы — к положительно заряженному. Так в расплавленном ионном веществе возникает электрический ток.
Вещества атомного и молекулярного строения в любом агрегатном состоянии не проводят электрический ток, поскольку состоят из электронейтральных частиц — атомов, молекул.
Выводы:
Ионная связь — это взаимодействие между противоположно заряженными ионами в веществе.
К ионным соединениям относятся многие оксиды металлических элементов, щелочи, соли, а также другие бинарные соединения типичных металлических элементов.
Большинство ионных соединений в обычных условиях находятся в кристаллическом состоянии. Их строение описывает модель — кристаллическая решетка. Каждый ион в кристалле ионного соединения окружен несколькими противоположно заряженными ионами.
Ионная связь довольно прочная. Поэтому ионные вещества имеют высокие температуры плавления и кипения. В расплавленном состоянии они проводят электрический ток.
Ковалентная связь
Соединяться могут не только противоположно заряженные ионы, но и электронейтральные атомы — одинаковые или разные. Благодаря этому существуют вещества молекулярного и атомного строения.
Связь в молекуле 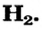 Рассмотрим, как образуется молекула водорода
Рассмотрим, как образуется молекула водорода 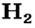 из двух атомов Гидрогена. Каждый атом имеет один электрон (рис. 79, а). Электронная формула атома Гидрогена —
из двух атомов Гидрогена. Каждый атом имеет один электрон (рис. 79, а). Электронная формула атома Гидрогена — 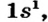 а ее графический вариант —
а ее графический вариант — 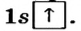
Это интересно. В металлах существует особая химическая связь. Ее название — металлическая.
Для того чтобы образовалась молекула 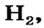 двум атомам Гидрогена необходимо сблизиться. С уменьшением расстояния между ними усиливается притяжение электронов каждого атома к ядру другого атома. В определенный момент орбитали двух атомов сконтактируют (рис. 79, б), а затем начнут проникать друг в друга. При этом будет возрастать отталкивание между одноименно (положительно) заряженными ядрами атомов. Когда силы притяжения и отталкивания уравняются, атомы остановятся (рис. 79, в). Через область перекрывания орбиталей электроны будут переходить от одного атома к другому (рис. 79, в, г, д). Так формируется общая для двух атомов электронная пара. Каждый атом Гидрогена «приобретает» дополнительный электрон и выгодную электронную оболочку (как у атома Гелия).
двум атомам Гидрогена необходимо сблизиться. С уменьшением расстояния между ними усиливается притяжение электронов каждого атома к ядру другого атома. В определенный момент орбитали двух атомов сконтактируют (рис. 79, б), а затем начнут проникать друг в друга. При этом будет возрастать отталкивание между одноименно (положительно) заряженными ядрами атомов. Когда силы притяжения и отталкивания уравняются, атомы остановятся (рис. 79, в). Через область перекрывания орбиталей электроны будут переходить от одного атома к другому (рис. 79, в, г, д). Так формируется общая для двух атомов электронная пара. Каждый атом Гидрогена «приобретает» дополнительный электрон и выгодную электронную оболочку (как у атома Гелия).
Связь между атомами, обусловленную образованием общих электронных пар, называют ковалентной связью.
Связь в молекуле водорода изображают двумя способами: 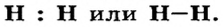 Первую запись называют электронной формулой молекулы; в ней каждый электрон обозначают точкой. Вторая запись — графическая формула; она знакома вам из курса химии 7 класса. Отныне вы будете знать, что черточкой обозначают общую электронную пару.
Первую запись называют электронной формулой молекулы; в ней каждый электрон обозначают точкой. Вторая запись — графическая формула; она знакома вам из курса химии 7 класса. Отныне вы будете знать, что черточкой обозначают общую электронную пару.
Образование молекулы водорода из атомов можно представить такой схемой:
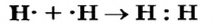
Связь в молекуле 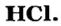 Рассмотрим, как соединяются два разных атома — Гидрогена и Хлора.
Рассмотрим, как соединяются два разных атома — Гидрогена и Хлора.
В атоме Гидрогена имеется один электрон, а в атоме Хлора на внешнем энергетическом уровне — 7 электронов, из которых один — неспаренный. Атомам выгодно получить по дополнительному электрону. Первый атом заполнит свой единственный энергетический уровень, а второй будет обладать внешним электронным октетом 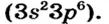
В результате сближения атомов происходит перекрывание 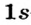 -орбитали атома Гидрогена и
-орбитали атома Гидрогена и 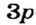 -орбитали атома Хлора (рис. 80); из соответствующих неспаренных электронов формируется общая электронная пара.
-орбитали атома Хлора (рис. 80); из соответствующих неспаренных электронов формируется общая электронная пара.
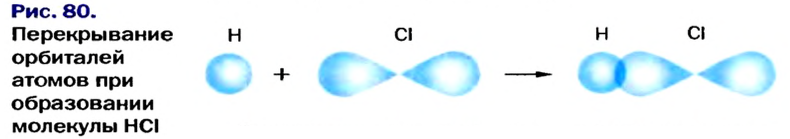
Электронная и графическая формулы молекулы хлороводорода, а также схема образования молекулы из атомов таковы:
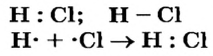
Формулу молекулы с обозначением общей электронной пары называют упрощенной электронной формулой. Если указать все внешние электроны каждого атома, то получим полную электронную формулу. Соответствующая схема образования молекулы хлороводорода имеет такой вид:
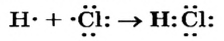
Связь в молекулах  Между атомами Оксигена в молекуле кислорода
Между атомами Оксигена в молекуле кислорода 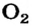 существует ковалентная связь, которая отличается от связей в молекулах
существует ковалентная связь, которая отличается от связей в молекулах 
Электронная формула атома Оксигена — 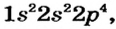 ее графический вариант —
ее графический вариант —
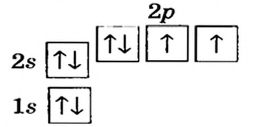
В р-орбиталях атома находятся два неспаренных электрона. При соединении двух атомов Оксигена эти электроны образуют две общие электронные пары:
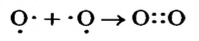
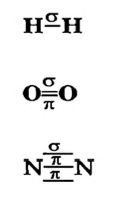
Теперь каждый атом имеет октет внешних электронов. Полная электронная формула молекулы кислорода — 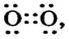 а графическая —
а графическая — 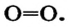

Ковалентную связь, реализуемую с помощью одной общей электронной пары (например, в молекулах  ), называют простой связью, а с помощью двух пар (в молекуле
), называют простой связью, а с помощью двух пар (в молекуле 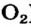 ) — двойной. Существует еще и тройная связь, которая осуществляется за счет трех общих электронных пар. Ею соединены атомы в молекуле азота
) — двойной. Существует еще и тройная связь, которая осуществляется за счет трех общих электронных пар. Ею соединены атомы в молекуле азота 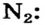
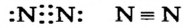
Из вышеизложенного следует, что необходимым условием для образования ко валентной связи между атомами является наличие у каждого из них одного или нескольких неспаренных электронов. Запомните: ковалентной связью соединяются атомы неметаллических элементов.
Ковалентная связь существует в простых и сложных веществах не только молекулярного, но и атомного строения (рис. 81). Она отсутствует только в инертных газах.
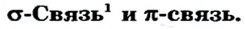 В молекуле водорода
В молекуле водорода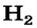 область перекрывания s-орбиталей атомов Гидрогена расположена на пути прямой, соединяющей центры атомов. Такую связь называют
область перекрывания s-орбиталей атомов Гидрогена расположена на пути прямой, соединяющей центры атомов. Такую связь называют 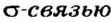 (рис. 82). Она существует и в молекуле
(рис. 82). Она существует и в молекуле 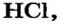 где перекрываются s-орбиталь атома Гидрогена и р-орбиталь атома Хлора (рис. 80).
где перекрываются s-орбиталь атома Гидрогена и р-орбиталь атома Хлора (рис. 80).
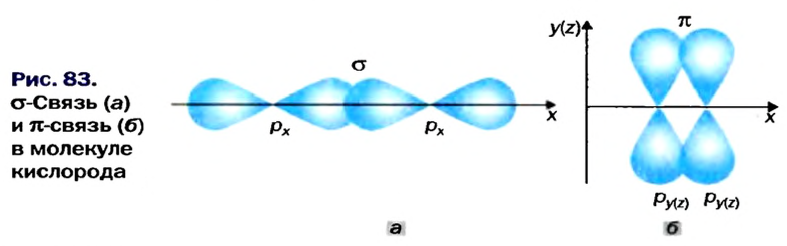
Рассмотрим, как перекрываются орбитали с неспаренными электронами в молекуле кислорода. Пара р-орбиталей, направленных друг к другу (рис. 83, а), образует один общий участок. Это 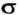 -связь. Две р-орбитали, размещенные параллельно друг другу (рис. 83, б), перекрываются с образованием двух общих участков. Эти участки расположены над и под линией, соединяющей центры атомов. Такую связь называют
-связь. Две р-орбитали, размещенные параллельно друг другу (рис. 83, б), перекрываются с образованием двух общих участков. Эти участки расположены над и под линией, соединяющей центры атомов. Такую связь называют 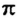 -связью.
-связью.
Если простая связь всегда является 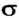 -связью, то двойная связь состоит из одной
-связью, то двойная связь состоит из одной 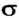 -связи и одной
-связи и одной 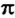 -связи. Составными частями тройной связи (например, в молекуле
-связи. Составными частями тройной связи (например, в молекуле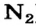 ) являются одна
) являются одна 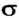 -связь и две
-связь и две 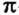 -связи.
-связи.
Область перекрывания орбиталей в случае 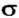 -связи больше, чем в случае
-связи больше, чем в случае 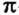 -связи. А чем большая часть пространства одновременно принадлежит двум орбиталям, тем чаще электроны переходят от одного атома к другому. Поэтому
-связи. А чем большая часть пространства одновременно принадлежит двум орбиталям, тем чаще электроны переходят от одного атома к другому. Поэтому 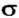 -связь прочнее и выгоднее
-связь прочнее и выгоднее 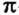 -связи.
-связи.
Выводы:
Ковалентная связь реализуется вследствие образования одной, двух или трех общих электронных пар за счет неспаренных электронов атомов.
Связь между атомами с помощью одной общей электронной пары называют простой, двух пар — двойной, трех пар — тройной.
Ковалентными связями соединяются друг с другом атомы неметаллических элементов.
Если орбитали неспаренных электронов перекрываются на одном участке пространства, то связь называют 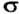 -связью, а если на двух участках —
-связью, а если на двух участках — 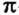 -связью. Простая ковалентная связь всегда является
-связью. Простая ковалентная связь всегда является 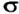 -связью, двойная связь состоит из
-связью, двойная связь состоит из 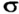 - и
- и 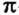 -связи, а тройная — из
-связи, а тройная — из 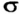 -связи и двух
-связи и двух 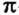 -связей.
-связей.
Полярная и неполярная ковалентная связь
Сложных веществ существует значительно больше, чем простых. Поэтому ковалентная связь между разными атомами встречается чаще, чем между одинаковыми.
Может ли атом одного элемента «перетягивать» общую электронную пару от атома другого элемента?
Чтобы ответить на поставленный вопрос, рассмотрим молекулу хлороводорода 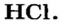 В соответствии с результатами исследований в этой молекуле два электрона ковалентной связи чаще находятся в атоме Хлора, чем в атоме Гидрогена. Общая электронная пара оказывается смещенной к атому Хлора. Этот атом приобретает небольшой отрицательный заряд, который меньше единицы (он равен -0,2), а атом Гидрогена — такой же заряд по значению, но положительный (+0,2). Дробные заряды на атомах обозначают греческой буквой
В соответствии с результатами исследований в этой молекуле два электрона ковалентной связи чаще находятся в атоме Хлора, чем в атоме Гидрогена. Общая электронная пара оказывается смещенной к атому Хлора. Этот атом приобретает небольшой отрицательный заряд, который меньше единицы (он равен -0,2), а атом Гидрогена — такой же заряд по значению, но положительный (+0,2). Дробные заряды на атомах обозначают греческой буквой 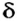 («дельта») вместе со знаком «плюс» или «минус».
(«дельта») вместе со знаком «плюс» или «минус».
Рассмотренную особенность ковалентной связи изображают так:
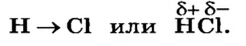
Ковалентную связь, в которой одна или несколько общих электронных пар смещены к одному из атомов, называют полярной связью, а при отсутствии такого смещения — неполярной.
Свойство атома элемента смещать в свою сторону электронную пару, общую с другим атомом, называют электроотрицательностью.
Учитывая полярность ковалентной связи в молекуле 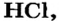 можно утверждать, что Хлор — более электроотрицательный элемент, чем Гидроген.
можно утверждать, что Хлор — более электроотрицательный элемент, чем Гидроген.
Для количественной оценки электроотрицательности элементов используют таблицу, составленную американским ученым Л. Полингом (табл. 9). В соответствии с ней наименее электроотрицательным элементом является Цезий, а наиболее электроотрицательным — Флуор. Металлические элементы имеют более низкие значения электроотрицательности, чем неметаллические. Это и понятно, так как атомы металлических элементов способны терять электроны и превращаться в катионы, а атомы неметаллических элементов — присоединять электроны и превращаться в анионы.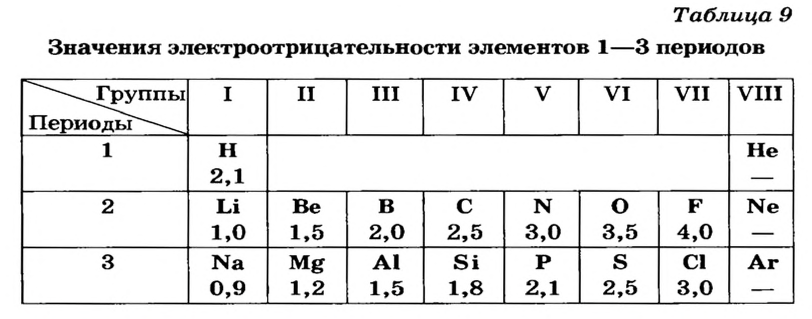
В периодах электроотрицательность элементов возрастает слева направо, а в группах (главных подгруппах) — снизу вверх.
В таблице 9 отсутствуют значения электроотрицательности Гелия, Неона, Аргона. Атомы этих элементов не способны соединяться с другими атомами, а также превращаться в катионы или анионы.
Предсказать полярность или неполярность ковалентной связи, пользуясь таблицей электроотрицательности, очень просто. Если атомы имеют одинаковую электроотрицательность, то связь между ними неполярная. Неполярные ковалентные связи существуют, например, в молекулах 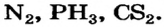 Атомы с разной электроотрицательностью соединяются полярными связями.
Атомы с разной электроотрицательностью соединяются полярными связями.
Рассмотрим молекулу воды 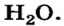 Между атомом Оксигена и каждым атомом Гидрогена существует простая ковалентная связь; таких связей в молекуле — две. Поскольку Оксиген имеет большую электроотрицательность (3,5), чем Гидроген (2,1), то его атом смещает к себе общие электронные пары:
Между атомом Оксигена и каждым атомом Гидрогена существует простая ковалентная связь; таких связей в молекуле — две. Поскольку Оксиген имеет большую электроотрицательность (3,5), чем Гидроген (2,1), то его атом смещает к себе общие электронные пары:
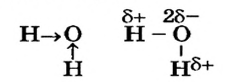
Это интересно. Электрический заряд на каждом атоме Гидрогена в молекуле воды составляет +0,17, а на атоме Оксигена -0,34.
Таким образом, ковалентные связи в молекуле воды являются полярными.
Чем больше разница в электроотрицательности элементов, тем полярнее связь между атомами.
Выводы:
Если ковалентная связь образуется между атомами разных элементов, то они обычно приобретают небольшие заряды. Их появление вызвано смещением общих электронных пар от одних атомов к другим. Такую ковалентную связь называют полярной. Если смещения общих электронных пар нет, то связь является неполярной.
Свойство атома смещать к себе электронную пару, общую с другим атомом, называют электроотрицательностью. Электроотрицательность элементов возрастает в периодах слева направо, а в группах (главных подгруппах) — снизу вверх.
Это интересно. Химическая связь с максимальной полярностью — ионная связь.
Молекулярные вещества
Межмолекулярное взаимодействие:
Вещество независимо от его строения может находиться в трех агрегатных состояниях. Твердое и жидкое состояния молекулярных веществ существуют благодаря тому, что молекулы притягиваются друг к другу. Это явление называют межмолекулярным взаимодействием.
В отличие от прочных ковалентной и ионной связей взаимодействие между молекулами довольно слабое. Оно состоит во взаимном притяжении атомов с небольшими положительными и отрицательными зарядами (§ 35), принадлежащих разным молекулам. Такое взаимодействие существует, например, в воде, кислотах, белках. Оно является важным условием для существования живых организмов на нашей планете.
Физические свойства молекулярных веществ
Вследствие того что молекулы слабо притягиваются друг к другу, вещества молекулярного строения существенно отличаются от ионных веществ по физическим свойствам. Для молекулярных веществ характерны летучесть, низкая твердость, невысокие температуры плавления и кипения. Некоторые молекулярные вещества при нагревании переходят из твердого состояния в газообразное, минуя жидкое. Такое явление называют сублимацией. Этим свойством обладают, например, иод 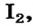 карбон(IV) оксид
карбон(IV) оксид 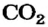 (рис. 84).
(рис. 84).
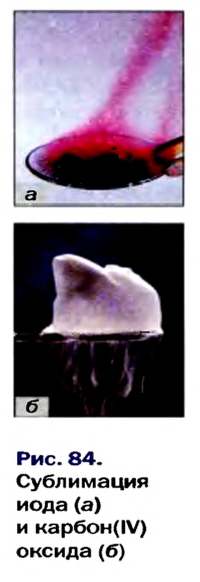
Твердый карбон(IV) оксид называют «сухим льдом». При повышении температуры он превращается не в жидкость, а в газ (углекислый), т. е. не тает, а испаряется («высыхает») (рис. 84, б). Сухой лед раньше использовали в торговле для охлаждения мороженого.
Обычный лед при температуре ниже О°С также превращается в пар, правда, медленно. Благодаря этому выстиранное белье высыхает и на морозе.
Немало молекулярных веществ имеют запах. Вам хорошо известен резкий запах сульфур(IV) оксида, или сернистого газа 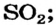 вещество образуется при зажигании спички (сера входит в состав ее головки). Газ аммиак
вещество образуется при зажигании спички (сера входит в состав ее головки). Газ аммиак  также легко узнать по запаху. Он выделяется из водного раствора этого соединения — нашатырного спирта. Нельзя перепутать с другими запах уксусной кислоты
также легко узнать по запаху. Он выделяется из водного раствора этого соединения — нашатырного спирта. Нельзя перепутать с другими запах уксусной кислоты 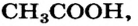 раствор которой (уксус) используют в домашнем хозяйстве.
раствор которой (уксус) используют в домашнем хозяйстве.
Молекулярные вещества не проводят электрический ток. (Попробуйте это объяснить.)
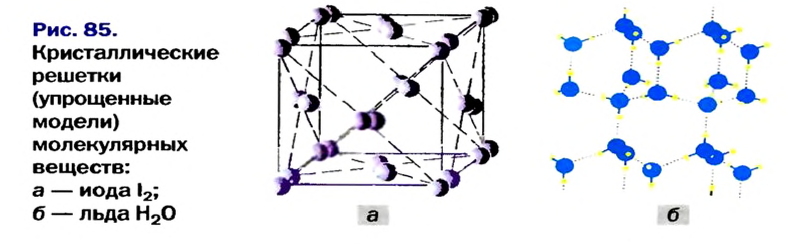
Кристаллическое состояние молекулярных веществ характеризуется упорядоченным расположением молекул в кристалле (рис. 85).
Простейшая и истинная формулы. Химические формулы молекулярных веществ указывают на состав их молекул и в некоторых случаях могут иметь кратные индексы.
В качестве примера возьмем гидроген пероксид (перекись водорода) 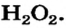 Молекулы именно такого состава (а не
Молекулы именно такого состава (а не 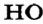 ) содержатся в этом веществе. Каждый атом Гидрогена соединен со «своим» атомом Оксигена простой ковалентной связью; такой же связью соединены и атомы Оксигена:
) содержатся в этом веществе. Каждый атом Гидрогена соединен со «своим» атомом Оксигена простой ковалентной связью; такой же связью соединены и атомы Оксигена:
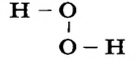
Формулу 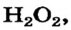 которая показывает реальный состав молекулы, называют истинной (формула
которая показывает реальный состав молекулы, называют истинной (формула  является простейшей).
является простейшей).
Известны случаи, когда одна и та же простейшая формула отвечает нескольким молекулярным веществам с различными истинными формулами. Так, ацетилен 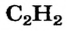 (газ, который используют для сварки металлов) и бензен
(газ, который используют для сварки металлов) и бензен 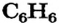 (распространенный органический растворитель; его традиционное название — бензол) имеют одинаковые простейшие формулы —
(распространенный органический растворитель; его традиционное название — бензол) имеют одинаковые простейшие формулы — 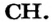
Для большинства молекулярных веществ истинные формулы совпадают с простейшими.
Выводы:
Молекулы притягиваются друг к другу, однако довольно слабо. Поэтому вещества молекулярного строения имеют низкие температуры плавления и кипения.
Для некоторых молекулярных соединений существуют две химические формулы — простейшая и истинная. Индексы в простейшей формуле показывают соотношение атомов элементов в молекуле.
Степень окисления
Известно, что атомы — электронейтральные частицы. Они остаются таковыми, соединяясь в молекулы простых веществ. Однако на атомах, входящих в состав сложных веществ, как правило, сосредоточиваются небольшие заряды — как положительные, так и отрицательные. Это является следствием смещения общих электронных пар к атомам более электроотрицательных элементов.
Была подробно рассмотрена молекула хлороводорода 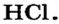 В ней существует ковалентная полярная связь; общая электронная пара смещена к более электроотрицательному атому Хлора
В ней существует ковалентная полярная связь; общая электронная пара смещена к более электроотрицательному атому Хлора 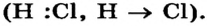 На этом атоме имеется небольшой отрицательный заряд, а на атоме Гидрогена — такой же по значению, но положительный заряд:
На этом атоме имеется небольшой отрицательный заряд, а на атоме Гидрогена — такой же по значению, но положительный заряд: 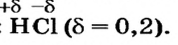
Если общую электронную пару полностью «передать» атому Хлора (тогда она уже не будет общей), то к этому атому вернется его электрон, который принимал участие в ковалентной связи, и поступит электрон от атома Гидрогена. За счет последнего атом Хлора получит заряд —1, а атом Гидрогена, потеряв свой единственный электрон, приобретет заряд +1.
Условный целочисленный заряд атома в веществе называют степенью окисления элемента.
Степень окисления обозначают в химической формуле над символом элемента, записывая сначала знак (плюс или минус), а затем — число:
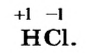
Пример №8
Вычислить степени окисления элементов в карбон(IV) оксиде.
Решение
Карбон(IV) оксид — молекулярное соединение. В молекуле 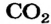 четырехвалентный атом Карбона соединен двойными ковалентными связями с каждым атомом Оксигена:
четырехвалентный атом Карбона соединен двойными ковалентными связями с каждым атомом Оксигена:

Связь 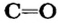 является полярной, поскольку элементы отличаются по электроотрицательности: Оксиген более электроотрицательный, чем Карбон (табл. 8). Передаем все четыре общие электронные пары двум атомам Оксигена. В результате каждый атом Оксигена получает заряд —2, ибо к нему, кроме двух своих электронов, поступают два «чужих» — от атома Карбона. Атом Карбона приобретает заряд +4, т. к. он теряет четыре электрона, передав их атомам Оксигена. Запишем формулу соединения с найденными степенями окисления элементов:
является полярной, поскольку элементы отличаются по электроотрицательности: Оксиген более электроотрицательный, чем Карбон (табл. 8). Передаем все четыре общие электронные пары двум атомам Оксигена. В результате каждый атом Оксигена получает заряд —2, ибо к нему, кроме двух своих электронов, поступают два «чужих» — от атома Карбона. Атом Карбона приобретает заряд +4, т. к. он теряет четыре электрона, передав их атомам Оксигена. Запишем формулу соединения с найденными степенями окисления элементов:
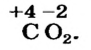
Если вещество является ионным и состоит из простых (одноатомных) ионов, то в нем степень окисления каждого элемента совпадает с зарядом соответствующего иона, т. е. является реальным зарядом частицы, а не условным. Например, степени окисления Натрия и Хлора в натрий хлориде 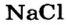 равны соответственно +1 и —1, Алюминия и Оксигена в алюминий оксиде
равны соответственно +1 и —1, Алюминия и Оксигена в алюминий оксиде 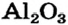 составляют +3 и -2. Запишем формулы соединений вместе со степенями окисления элементов:
составляют +3 и -2. Запишем формулы соединений вместе со степенями окисления элементов:

(Заряд иона, как известно, записывают вверху и справа от символа элемента, причем сначала указывают цифру (единицу опускают), а затем знак: 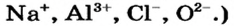
Сумма степеней окисления всех атомов в каждом веществе равна нулю.
Это — правило электронейтральности вещества. О нем упоминалось ранее, но по отношению к ионным веществам. Приведенная выше его формулировка распространяется на вещества любого строения — ионного, молекулярного, атомного. Правило электронейтральности используют при составлении формул химических соединений или для их проверки. Так, формулу алюминий оксида А1203 следует считать правильной, поскольку сумма степеней окисления всех атомов (сумма зарядов всех ионов) в формульной единице соединения составляет 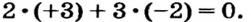
Это интересно. Нитроген может иметь в соединениях все возможные степени окисления от —3 до +5 (всего 9 значений).
Степень окисления элемента может равняться и нулю. Нулевые значения степени окисления имеют элементы в простых веществах — водороде 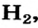 сере
сере 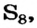 железе Fe и т. д. (объясните это), а также в соединениях, образованных элементами с одинаковой электроотрицательностью — фосфине
железе Fe и т. д. (объясните это), а также в соединениях, образованных элементами с одинаковой электроотрицательностью — фосфине 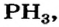 карбон(IV) сульфиде
карбон(IV) сульфиде 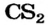 и др.
и др.
Чтобы определять степени окисления элементов в соединениях по их химическим формулам, а также составлять формулы соединений, необходимо знать такие закономерности:
- металлические элементы имеют в соединениях только положительные степени окисления;
- степень окисления Гидрогена в соединениях с неметаллическими элементами, как правило, составляет +1, а в соединениях с металлическими элементами равна —1;
- оксиген почти во всех соединениях имеет степень окисления —2;
- флуор как самый электроотрицательный элемент всегда имеет в соединениях степень окисления —1;
- максимальная (положительная) степень окисления элемента совпадает с номером группы, в которой он находится;
- минимальная (отрицательная) степень окисления неметаллического элемента равна номеру группы минус 8.
Пример №9
Определить степени окисления элементов в калий дифосфате 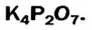
Решение. Калий — металлический элемент. Его степень окисления в соединении должна быть положительной (закономерность 1) и равна +1, поскольку Калий — элемент I группы (закономерность 5). Степень окисления Оксигена в соединении составляет —2 (закономерность 3). Степень окисления Фосфора определяем, воспользовавшись правилом электронейтральности вещества:
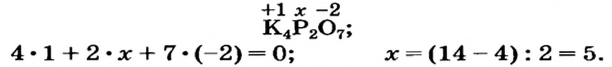
Формула калий дифосфата с найденными степенями окисления элементов — 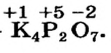
Пример №10
Составить формулу соединения Магния с Нитрогеном.
Решение
Магний — металлический элемент; он находится во II группе и в соединениях имеет степень окисления +2 (закономерности 1 и 5). Нитроген — неметаллический элемент; он принадлежит к V группе. В соединении с металлическим элементом Нитроген проявляет отрицательную степень окисления, равную 5 - 8 = -3 (закономерность 6). Записываем формулу соединения с неизвестными индексами и указываем степени окисления элементов:
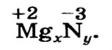
Дальше действуем так, как при составлении формулы бинарного соединения по валентностям элементов. Находим наименьшее число, которое делится без остатка на значения степеней окисления элементов; это число 6. Разделив его на 2, получаем количество атомов Магния в формуле соединения (6 : 2 = 3), а разделив на 3, получаем количество атомов Нитрогена (6 : 3 = 2).
Формула соединения — 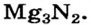
Значения степени окисления и валентности элемента нередко совпадают (например, Гидрогена — в соединении  Карбона — в соединении
Карбона — в соединении  ). Тем не менее их нельзя путать и заменять одно другим, так как понятия «степень окисления» и «валентность» различны по смыслу. Степень окисления все чаще используют как универсальную величину, удобную для классификации веществ, хотя для веществ молекулярного и атомного строения она имеет условный характер. Понятие «валентность» постепенно теряет значение в химии, но останется в истории химической науки.
). Тем не менее их нельзя путать и заменять одно другим, так как понятия «степень окисления» и «валентность» различны по смыслу. Степень окисления все чаще используют как универсальную величину, удобную для классификации веществ, хотя для веществ молекулярного и атомного строения она имеет условный характер. Понятие «валентность» постепенно теряет значение в химии, но останется в истории химической науки.
Выводы:
Степень окисления элемента — это условный целочисленный заряд атома в веществе. Его рассчитывают, полностью смещая общие электронные пары к атомам более электроотрицательных элементов. Степень окисления элемента в простом ионе совпадает с зарядом иона.
Сумма степеней окисления всех атомов в каждом веществе равна нулю. Это — правило электронейтральности. Его используют при составлении формул различных соединений.
Значения степени окисления и валентности элемента часто совпадают.
Химическая связь и строение вещества
В свободном состоянии атомы в природе встречаются довольно редко. В качестве примера можно привести одноатомные молекулы инертных газов гелия, неона, аргона, криптона, незначительные количества которых входят в состав воздуха. Существуют вещества, молекулы которых образуются из двух или нескольких атомов одного элемента. К ним относятся водород 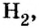 кислород
кислород 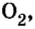 озон
озон 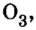 хлор
хлор 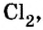 азот
азот 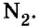 Но большинство веществ образуется из атомов разных химических элементов. (Вспомните оксиды, основания, кислоты, соли.)
Но большинство веществ образуется из атомов разных химических элементов. (Вспомните оксиды, основания, кислоты, соли.)
Химическое взаимодействие, в результате которого соединяются атомы, образуя новые вещества, было предметом размышлений многих поколений ученых. На основе знаний о строении атома в XX в. ввели понятие химической связи.
Химическая связь — это связь между атомами, обеспечивающая существование веществ с четко определенным составом.
Электронная природа химической связи
В образовании химической связи главную роль играют неспаренные электроны, которые получили название валентных электронов. Ядро атома при этом остается без изменений.
Вам известно, что в результате химических реакций образуются новые вещества. Из теории химической связи вытекает еще одно важное следствие — достижение атомами завершенности внешних энергетических уровней. Завершенным внешним энергетическим уровнем называется энергетический уровень из 8 электронов (для водорода и гелия — из двух). Исходя из этого, существует правило октета (латинским языком окто — восемь):
- элементы теряют или приобретают электроны для того, чтобы иметь на внешнем энергетическом уровне 8 электронов.
То есть, при образовании химической связи внешние энергетические уровни атомов приобретают электронную конфигурацию ближайшего инертного элемента, которая является стойкой и энергетически выгодной.
Итак, химические реакции протекают в направлении образования у элементов завершенного внешнего энергетического уровня или как его еще называют — внешнего электронного слоя.
Все химические реакции сопровождаются разрушением одних химических связей и образованием других.
Число атомов одного элемента соединяется с атомами другого элемента не произвольно. Причиной этого является распределение электронов в электронной оболочке атома, число не-спаренных электронов и их способность образовывать общие электронные пары. Так, в атоме водорода 1 неспаренный электрон:  Поэтому водород способен образовывать одну общую электронную пару с любым другим атомом.
Поэтому водород способен образовывать одну общую электронную пару с любым другим атомом.
В атоме азота на внешнем энергетическом уровне находится пять электронов, но неспаренных среди них три: 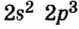
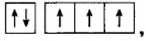 поэтому число общих электронных пар, которые может образовать азот, также три.
поэтому число общих электронных пар, которые может образовать азот, также три.
Заметим, что число неспаренных электронов в атоме неметалла можно определить вычитанием номера группы, в которой находится элемент, из числа восемь. Например, азот — неметаллический элемент 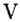 группы, поэтому
группы, поэтому 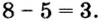
При образовании общей электронной пары двумя атомами разных химических элементов один из них притягивает ее сильнее, чем другой. Поэтому для понимания сущности химической связи между атомами разных химических элементов введено такое понятие, как электроотрицательность.
Электроотрицательность — условная величина, которая характеризует способность атома притягивать к себе электроны в соединении.
Единицей электроотрицательности принято считать электроотрицательность лития и с ней сравнивать электроотрицательности других атомов. Если сравнить электроотрицательность металлических и неметаллических элементов, то результаты будут в пользу последних — они имеют значительно большую электроотрицательность, чем металлические элементы. Наибольшая электроотрицательность у фтора. Поэтому, с каким бы атомом он не образовал общую электронную пару, она будет смещаться к фтору. Итак, фтор — своеобразный чемпион среди элементов по электроотрицательности, второе место занимает кислород, а третье — азот. «Пьедестал» этих чемпионов по электроотрицательности таков:
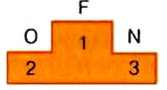
Периодическая зависимость распространяется и на электроотрицательность: в каждом периоде электроотрицательность атомов с увеличением заряда ядра возрастает, а в каждой главной подгруппе — убывает.
Разместив химические элементы по уменьшению величины их электроотрицательности в один ряд, получим ряд электроотрицательности:
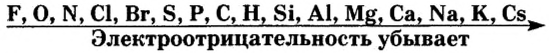
Зная электроотрицательность атомов элементов, можно предусмотреть, к какому атому будут смещаться электроны, которые образовали общую пару.
Итоги:
- Химическая связь — это взаимодействие, благодаря которому удерживаются вместе структурные частицы вещества.
- Благодаря образованию химических связей, достигается завершенность внешнего энергетического уровня атома.
- Электроотрицательность характеризует способность атома в соединении притягивать электроны; наибольшую электроотрицательность имеет фтор.
- Электроотрицательность возрастает: в пределах периода слева направо, а в главных подгруппах — снизу вверх.
Простые вещества, молекулы которых образованы из нескольких атомов одного химического элемента, — явление в химии привычное. Но в настоящее время современный уровень развития науки дает возможность добывать простые вещества с многоатомными молекулами. Так, в 1985 г. английские ученые синтезировали гигантскую молекулу из 60 атомов углерода. Для этого графит выпарили под действием мощного лазерного луча в условиях вакуума. Вещество назвали сначала букминстерфуллереном, а впоследствии — букиболом, или фуллереном.
Пять лет понадобилось ученым, чтобы изучить структуру и свойства нового вещества. Было выяснено, что его молекула  напоминает футбольный мяч. Шаровидная форма молекулы достигается благодаря тому, что все атомы углерода равноудалены от центра молекулы и соединены между собой таким образом, что каждый атом находится одновременно в вершинах двух шестиугольников и одного пятиугольника.
напоминает футбольный мяч. Шаровидная форма молекулы достигается благодаря тому, что все атомы углерода равноудалены от центра молекулы и соединены между собой таким образом, что каждый атом находится одновременно в вершинах двух шестиугольников и одного пятиугольника.
У фуллерена, формула которого 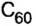 и других представителей этой группы веществ широкие перспективы применения в различных отраслях. Уже теперь на их основе изготовляют высокотемпературные проводники, аккумуляторные батареи, ценные масла и т. п.
и других представителей этой группы веществ широкие перспективы применения в различных отраслях. Уже теперь на их основе изготовляют высокотемпературные проводники, аккумуляторные батареи, ценные масла и т. п.
Синтез веществ, подобных фуллерену, является свидетельством достижений современного природоведения.
Химическая связь и строение электронных оболочек атомов
Завершенности внешнего энергетического уровня атомы достигают несколькими способами.
Способы образования завершенного внешнего энергетического уровня
Атомы могут достичь завершенности внешнего энергетического уровня, отдавая или присоединяя электроны.
У вас может возникнуть вопрос: «Каким образом, отдавая, а не присоединяя электроны, можно достичь завершенности внешнего энергетического уровня?» Найдем на него ответ и одновременно выясним, в какие частицы превращаются атомы, отдавая электроны.
Пример №11
Атом натрия, электронная формула которого 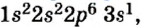 отдает
отдает  и становится частицей, которая сохранила в ядре 11 протонов, но в электронной оболочке отныне имеет 10 электронов и завершенный внешний энергетический уровень. Равновесие зарядов нарушилось, электронейтральность атома потеряна, зато образовалась частица с положительным зарядом +1. Как вы уже знаете, это ион, а поскольку он положительно заряжен, то называется катионом.
и становится частицей, которая сохранила в ядре 11 протонов, но в электронной оболочке отныне имеет 10 электронов и завершенный внешний энергетический уровень. Равновесие зарядов нарушилось, электронейтральность атома потеряна, зато образовалась частица с положительным зарядом +1. Как вы уже знаете, это ион, а поскольку он положительно заряжен, то называется катионом.
Частицы, в которые превращаются атомы, отдавая или присоединяя электроны, называются ионами.
Рассмотренную информацию о натрии запишем в такой форме:
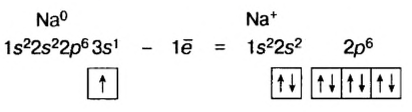
Как видим, ион натрия имеет другое строение электронной оболочки, чем его нейтральный атом. У него не 11, а 10 электронов и не три, а два энергетических уровня. К тому же внешний уровень завершен. Поэтому делаем вывод, что, отдавая электрон, катионы могут достичь завершенности внешнего электронного слоя лишь с той разницей, что статус завершенного электронного слоя уровня приобретает предпоследний энергетический уровень электронной оболочки атома.
Завершенность внешнего энергетического уровня может быть достигнута за счет отдачи электронов.
Пример №12
У атома хлора, электронная формула которого 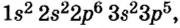 на внешнем энергетическом уровне содержится 7 электронов. Для того чтобы он стал завершенным, не хватает лишь
на внешнем энергетическом уровне содержится 7 электронов. Для того чтобы он стал завершенным, не хватает лишь  Поэтому атом хлора присоединяет
Поэтому атом хлора присоединяет 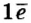 и становится частицей с 17 протонами в ядре, но в электронной оболочке имеет уже 18 электронов —
и становится частицей с 17 протонами в ядре, но в электронной оболочке имеет уже 18 электронов — 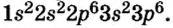 Равновесие зарядов электронейтрального атома нарушилось, зато образовалась частица с отрицательным зарядом -1. Это также ион, а поскольку он отрицательно заряжен, то является анионом.
Равновесие зарядов электронейтрального атома нарушилось, зато образовалась частица с отрицательным зарядом -1. Это также ион, а поскольку он отрицательно заряжен, то является анионом.
Как и для натрия, воспользуемся другой формой записи:
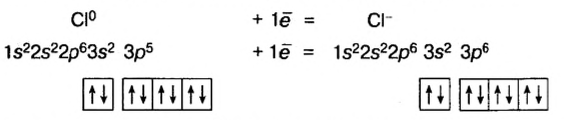
В результате присоединения одного электрона третий энергетический уровень аниона хлора стал завершенным.
Завершенность внешнего энергетического уровня атома может быть достигнута за счет присоединения электронов.
Чтобы лучше понять превращение незавершенных энергетических уровней на завершенные путем отдачи и присоединения электронов, вспомним электронное строение атомов металлических элементов третьего периода — натрия, магния, алюминия и неметаллических элементов этого же периода, — серы, хлора, аргона. Поработав с таблицей 10, сделаем вывод о строении внешнего энергетического уровня (электронного слоя) каждого из них.
Первые три химических элемента являются металлическими, последние три — неметаллическими. Существует ли отличие в строении внешних энергетических уровней металлических и неметаллических элементов? Как видим, число электронов на внешнем электронном слое в атомах металлических элементов небольшое (менее половины, чем у завершенного 8-электрон-ного слоя). У неметаллических элементов серы и хлора наоборот — внешний электронный слой содержит больше половины электронов, чем у завершенного восьмиэлектронного слоя. Поэтому, соединяясь между собой, атомы металлов отдают электроны, а неметаллов — присоединяют.
Присоединение электронов атомом и их отдача другому атому связано с изменением запаса энергии электронов. Атомам, которые на внешнем энергетическом уровне имеют мало электронов, энергетически выгоднее их отдать, чем присоединить в количестве, необходимом для образования завершенного внешнего энергетического уровня.
Существует еще один способ достижения завершенности внешнего энергетического уровня — атомы не отдают и не присоединяют электроны, а образуют общие электронные пары.
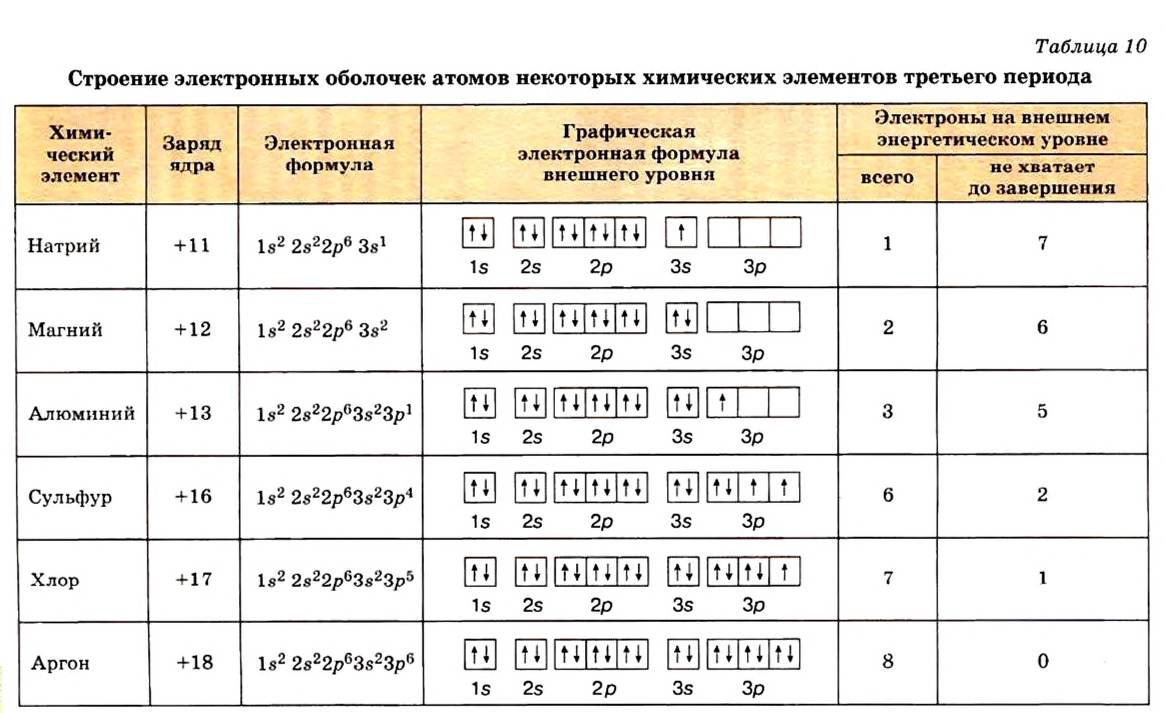
Итоги:
- Образование химической связи связано с изменениями в электронных оболочках атомов.
- В атоме на внешнем энергетическом уровне может быть от 1 до 8 электронов.
- Отдавая или присоединяя электроны, атомы превращаются в ионы — катионы и анионы.
- У ионов, в отличие от электронейтральных атомов, внешние энергетические уровни завершены.
- У элементов первых трех периодов образование химической связи происходит при участии валентных электронов внешнего энергетического уровня, в результате чего изменяются состав и строение электронных оболочек.
Ковалентная связь, ее виды
Еще одним способом достижения завершенности внешнего энергетического уровня электронной оболочки атома является образование общих электронных пар, которые принадлежат обоим атомам. Такой способ характерен для веществ, молекулы которых состоят из атомов неметаллов.
Образование ковалентной неполярной связи
Рассмотрим, как образуется ковалентная связь между одинаковыми атомами.
Пример №13
Образование молекулы водорода. Молекула водорода состоит из двух атомов водорода, которые имеют самое простое строение электронной оболочки:

Чтобы внешняя и единственная 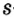 -орбиталь водорода стала завершенной, необходим еще один электрон. Поэтому два атома образуют одну общую электронную пару. (Известно, что общие электронные пары образуются в случае, когда неспаренные электроны имеют разное направление вращения вокруг своей оси.) При приближении двух атомов водорода на определенное расстояние происходит перекрывание их
-орбиталь водорода стала завершенной, необходим еще один электрон. Поэтому два атома образуют одну общую электронную пару. (Известно, что общие электронные пары образуются в случае, когда неспаренные электроны имеют разное направление вращения вокруг своей оси.) При приближении двух атомов водорода на определенное расстояние происходит перекрывание их 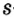 орбиталей. Этот процесс сопровождается выделением энергии и образованием общей электронной пары, которая одновременно принадлежит обоим атомам. Область перекрывания электронных облаков имеет повышенную электронную плотность, потому к ней притягиваются положительно заряженные ядра обоих атомов. В меру их приближения начинают действовать силы отталкивания (одноименно заряженные частицы отталкиваются, разноименно заряженные — притягиваются). На определенном расстоянии эти силы уравновешиваются, ядра и электроны образуют единственную стойкую систему. Так образуется молекула, формула которой
орбиталей. Этот процесс сопровождается выделением энергии и образованием общей электронной пары, которая одновременно принадлежит обоим атомам. Область перекрывания электронных облаков имеет повышенную электронную плотность, потому к ней притягиваются положительно заряженные ядра обоих атомов. В меру их приближения начинают действовать силы отталкивания (одноименно заряженные частицы отталкиваются, разноименно заряженные — притягиваются). На определенном расстоянии эти силы уравновешиваются, ядра и электроны образуют единственную стойкую систему. Так образуется молекула, формула которой 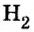 (рис. 26).
(рис. 26).
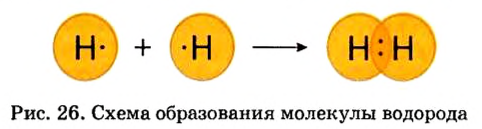
Химическая связь с помощью общих электронных пар называется ковалентной.
Поскольку химическая связь образовалась между атомами одного химического элемента, электроотрицательность которых одинакова, то ядра обоих атомов одинаково влияют на общую электронную пару. Поэтому она равноудалена от центров ядер обоих атомов и не смещается в сторону одного из них. Это передают с помощью электронной формулы молекулы, в которой записывают символы химических элементов и обозначают точками электроны внешнего энергетического уровня 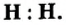
Электронная формула молекулы — это условная запись состава вещества с помощью символов химических элементов и точек, которыми обозначают электроны внешнего энергетического уровня.
Равноудаленность общей электронной пары от ядер атомов, между которыми возникла ковалентная связь, означает, что связь неполярна.
Ковалентной неполярной связью называется связь с помощью общих электронных пар, равноудаленных от ядер обоих атомов.
Пример №14
Образование молекулы кислорода 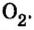
Молекула кислорода, как и молекула водорода, состоит из двух атомов одного химического элемента. У химического элемента кислорода такое строение электронной оболочки атома:
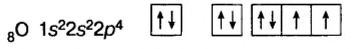
Как видим, на внешнем энергетическом уровне находится 6 электронов и среди них есть два неспаренных. До образования стойкого 8-электронного внешнего энергетического уровня не хватает двух электронов. Их атом получает, образовав две общие электронные пары с другим атомом кислорода. Так достигается завершенность внешних энергетических уровней обоих атомов кислорода.
Обратите внимание — в молекуле водорода атомы водорода образовали внешний энергетический уровень инертного элемента гелия. Атомы кислорода в молекуле кислорода имеют электронные оболочки инертного химического элемента неона, которым завершается второй период.
Продемонстрируем образование молекул с помощью ковалентной связи схематически (рис. 27).
Связь атомов кислорода в молекуле кислорода также ковалентная неполярная, и ее можно записать с помощью такой электронной формулы молекулы кислорода:
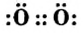
Иногда в электронных формулах, чтобы подчеркнуть, что до образования связи неспаренные электроны принадлежали разным атомам, один электрон общей пары электронов помечают точкой, а второй — крестиком.
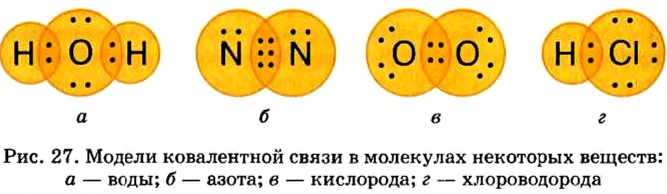
Пользуясь обозначениями, принятыми для электронных формул молекул, образование молекул водорода и кислорода можем изобразить так:
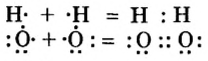
Заменив каждую общую пару электронов в электронной формуле черточкой, получим структурные формулы: 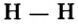
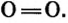 Одна черточка соответствует одной единице валентности.
Одна черточка соответствует одной единице валентности.
Из структурных формул видно, что валентность равна числу общих электронных пар.
Образование ковалентной полярной связи
Рассмотрим, как образуется ковалентная связь между разными атомами.
Пример №15
Образование молекулы хлороводорода 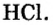
Молекула хлороводорода, как и молекулы водорода и кислорода, состоит из двух атомов. Однако ее атомы имеют разную электроотрицательность. Обратите внимание на размещение водорода и хлора в ряду электроотрицательности (с. 183) и вы увидите, что хлор размещен в начале ряда четвертым, тогда как водород— почти посередине.
Чем больше отдалены элементы в ряду электроотрицательности один от другого, тем большая разница в их способности притягивать общие электроны.
Пользуясь этим правилом, делаем вывод, что в соединении водорода и хлора электроны будут смещены в сторону более электроотрицательного атома хлора. Прежде чем рассмотреть, как между ними образуется химическая связь, напомним электронные и графические электронные формулы атомов этих элементов:
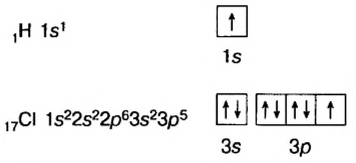
Несмотря на то, что у атома хлора на внешнем энергетическом уровне находится 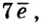 один его атом может образовать лишь одну общую электронную пару с водородом (по числу неспаренных электронов). Таким образом водород достигнет завершенного внешнего энергетического уровня инертного химического элемента гелия, а хлор — аргона.
один его атом может образовать лишь одну общую электронную пару с водородом (по числу неспаренных электронов). Таким образом водород достигнет завершенного внешнего энергетического уровня инертного химического элемента гелия, а хлор — аргона.
Образуется молекула, в которой атомы связаны силой притяжения разноименно заряженных ядер атомов к отрицательно заряженной области перекрывания  -орбитали водорода и
-орбитали водорода и  -орбитали хлора. Схематически ее образование и электронную формулу молекулы можно передать так:
-орбитали хлора. Схематически ее образование и электронную формулу молекулы можно передать так:
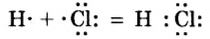
На схеме отображено смещение общей электронной пары в сторону более электроотрицательного элемента хлора.
Химическая связь с помощью общих электронных пар, которые смещены в сторону более электроотрицательного атома, называется ковалентной полярной.
Доказано, что образование общих электронных пар — процесс энергетически выгодный, при этом выделяется энергия. Поэтому молекула энергетически более стойкая, чем одиночный атом, и наделена меньшей энергией, чем сумма энергии атомов, которые ее образуют. Эта энергия характеризует прочность химической связи. Теперь, чтобы разъединить атомы, необходимо затратить столько же энергии, сколько ее выделилось при образовании химической связи.
Итоги:
- Связь с помощью общих электронных пар называется ковалентной связью.
- В соединениях с ковалентной связью электроны общих пар принадлежат обоим атомам. Таким способом достигается завершенность их внешних электронных слоев.
- Различают неполярную ковалентную связь (общие электронные пары равноудалены от ядер обоих атомов) и полярную ковалентную связь (общие электронные пары смещены к более электроотрицательному атому).
Метан — летучее водородное соединение углерода с водородом, который является основной составной частью природного газа, имеет формулу 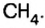 Согласно электронной природе химических связей для образования в этой молекуле 4 связей атом углерода должен иметь 4 неспаренных электрона. Убедимся, насколько это верно, рассмотрев графическую электронную формулу атома углерода:
Согласно электронной природе химических связей для образования в этой молекуле 4 связей атом углерода должен иметь 4 неспаренных электрона. Убедимся, насколько это верно, рассмотрев графическую электронную формулу атома углерода:
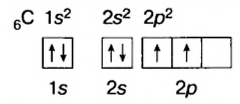
Из графической электронной формулы видно, что неспаренных электронов на внешнем энергетическом уровне лишь 2. Тогда как смогли образоваться 4 ковалентные связи? Это можно объяснить способностью атомов переходить из нормального состояния в возбужденное. Атом углерода имеет свободную энергетическую ячейку на внешнем энергетическом уровне. Поэтому образованию молекулы метана предшествовал переход одного  -электрона второго энергетического уровня на подуровень
-электрона второго энергетического уровня на подуровень  где есть свободная ячейка:
где есть свободная ячейка:
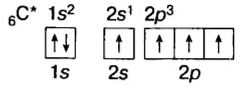
За счет этого в возбужденном состоянии (обозначается звездочкой справа от символа верхним индексом) атом углерода имеет 4 неспаренных электрона и соответственно образует 4 общие электронные пары.
Ионная связь
Известно, что органических веществ существует свыше 10 миллионов. В состав их молекул входят неметаллические элементы — углерод, водород, кислород, азот и некоторые другие. Химическая связь между их атомами — ковалентная. Поэтому соединений с ковалентной химической связью — большинство. Однако многие неорганические вещества образовались из атомов металлических и неметаллических элементов, например оксиды, основания, соли. Химическая связь в этих соединениях не ковалентная, а ионная.
Понятие об ионной связи
Образование этого вида химической связи также подчиняется правилу октета. Однако завершение внешних энергетических уровней происходит не путем образования общих электронных пар, а за счет отдачи электронов одними атомами и присоединения другими.
Рассмотрим образование ионной связи на примере хлорида натрия  Металлический элемент натрий достигает завершенности внешнего энергетического уровня, отдав единственный электрон, который находится на третьем энергетическом уровне. Неметаллический элемент хлор, наоборот, присоединяет электрон, которого не хватает до завершения внешнего энергетического уровня. Такое объяснение полностью согласовывается с положением этих элементов в ряду электроотрицательности.
Металлический элемент натрий достигает завершенности внешнего энергетического уровня, отдав единственный электрон, который находится на третьем энергетическом уровне. Неметаллический элемент хлор, наоборот, присоединяет электрон, которого не хватает до завершения внешнего энергетического уровня. Такое объяснение полностью согласовывается с положением этих элементов в ряду электроотрицательности.
Учитывая их размещение в этом ряду, делаем вывод, что по способности притягивать электроны натрий значительно уступает хлору. А так как внешний энергетический уровень его атома далек до завершенного 8-электронного, то для атома натрия энергетически более выгодно отдать 1 электрон, чем присоединить 7. Отдавая один электрон, атом превращается в положительно заряженный ион:
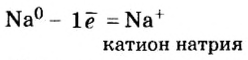
Сравнивая строения нейтрального атома натрия и положительно заряженного иона этого элемента, описанное в § 41, видно, что строение ядра у них общее, но разное строение электронных оболочек. Так, атом натрия имеет три энергетических уровня, у катиона их два.
Хлор имеет 7 электронов на внешнем энергетическом уровне. Поэтому ему энергетически выгодно присоединить 1 электрон, а не отдавать 7 электронов. Имея высокую электроотрицательность, он настолько смещает к себе валентный электрон атома натрия, что тот переходит на его электронную оболочку. И нейтральный атом хлора превращается в отрицательно заряженный ион:
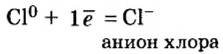
Запишем уравнение взаимодействия простых веществ натрия и хлора и обозначим переход электронов в этой реакции:
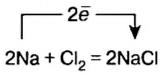
Ионы удерживаются друг с другом силами притяжения, которые всегда возникают между разноименно заряженными частицами. Воспользовавшись условным обозначением валентных электронов внешнего энергетического уровня с помощью точек, запишем переход электронов при образовании ионной связи между натрием и хлором:
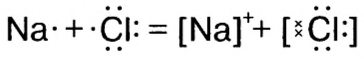
Между положительно заряженным катионом натрия и отрицательно заряженным анионом хлора образуется прочная ионная связь, вещество хлорид натрия при обычных условиях находится в твердом агрегатном состоянии.
Из определения ионной связи вытекает, что происходит переход электронов от менее электроотрицательного атома к атому с большей электроотрицательностью. В действительности же абсолютно чистой ионной связи не существует, потому что отдельные атомы, из которых образуется соединение, имеют хотя и незначительную, однако не нулевую, электроотрицательность. По этой причине при доминировании ионной связи есть небольшой процент образования общих электронных пар.
Как отмечалось в начале параграфа, ионная связь свойственна солям бескислородных кислот, основным оксидам, основаниям. (Приведите, примеры соответствующих соединений и их формулы.)
Разнообразие веществ по агрегатному состоянию
Из природоведения и физики вам известно, что вещества могут находиться в разных агрегатных состояниях. (Вспомните, какое отличие между размещением структурных частиц вещества при разном агрегатном состоянии.) При обычных условиях большинство веществ находится в твердом агрегатном состоянии, хотя есть и жидкости (вода, серная кислота, ацетон и др.), а также газообразные (кислород, аммиак, углекислый газ и т. п.). Снижая температуру, можно достичь перехода в твердое состояние любого жидкого или газообразного вещества.
Твердому агрегатному состоянию веществ свойственен определенный порядок размещения структурных частиц. Размещаясь в определенном порядке, частицы твердого вещества образуют кристаллы (рис. 28).

Трехмерная система размещения структурных частиц твердого вещества называется кристаллической решеткой вещества.
Точки, в которых размещаются структурные частицы кристалла, назвали узлами решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают ионные, атомные, молекулярные виды решеток.
Ионные кристаллические решетки
Они свойственны веществам, образованным за счет ионной связи. Размещение ионов у них не хаотическое, а определенным образом упорядоченное. В узлах ионных кристаллических решеток находятся катионы и анионы, размещенные поочередно.
Так, например, в кристалле хлорида натрия каждый катион натрия окружают шесть анионов хлора и наоборот (рис. 29).
Как видно из рисунка, ионы натрия и хлора в кристалле поваренной соли размещены в шахматном порядке: вокруг каждого иона 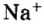 группируются ионы
группируются ионы 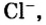 вокруг каждого иона
вокруг каждого иона 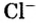 — ионы
— ионы 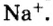 Взаимное притяжение ионов
Взаимное притяжение ионов 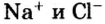 предопределяет прочность кристалла.
предопределяет прочность кристалла.
Особенностью ионных соединений является то, что силы притяжения в них действуют одинаково во всех направлениях. Поэтому ионы в узлах кристаллической решетки связаны крепко, вещества при комнатной температуре являются твердыми, а тепловое движение ионов очень незначительно. Однако нагревание веществ до температуры более высокой, чем их температура плавления, увеличивает тепловое движение ионов, и ионный кристалл плавится — переходит в жидкое состояние. Силы взаимодействия между катионами и анионами в кристалле большие, потому нужно много энергии, чтобы его расплавить, и еще больше, чтобы перевести в парообразное состояние. Поэтому все ионные соединения имеют сравнительно высокую твердость, тугоплавкие и нелетучие. Так, 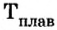 хлорида натрия равна
хлорида натрия равна 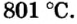 Ионные кристаллические решетки превышают по прочности молекулярные, но уступают атомным; многие вещества с таким типом кристаллической решетки хорошо растворяются в воде.
Ионные кристаллические решетки превышают по прочности молекулярные, но уступают атомным; многие вещества с таким типом кристаллической решетки хорошо растворяются в воде.
Атомные кристаллические решетки
В узлах атомных кристаллических решеток находятся атомы, между которыми за счет общих электронных пар существует ковалентная связь. Они свойственны немногим твердым веществам. Представителями таких веществ являются алмаз, оксид кремния Эти вещества имеют высокую твердость, тугоплавкие и мало растворимы.
Эти вещества имеют высокую твердость, тугоплавкие и мало растворимы.
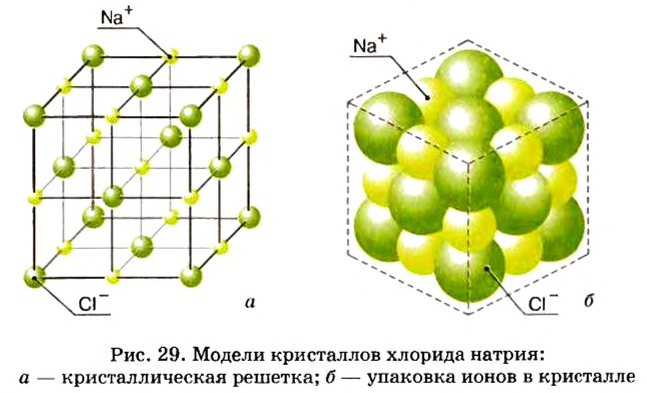
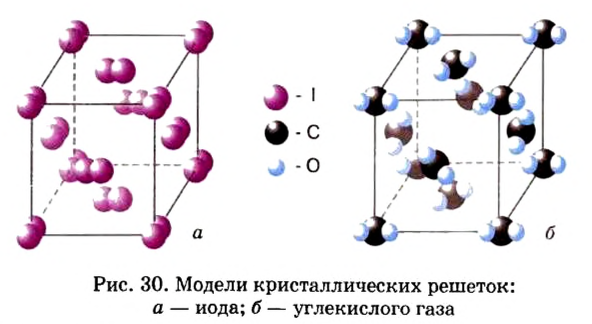
Молекулярные кристаллические решетки
В узлах молекулярных кристаллических решеток находятся молекулы веществ с ковалентной связью. Среди веществ с молекулярной кристаллической решеткой есть твердые при обычных условиях вещества, например иод (рис. 30, а), большинство органических веществ, а также жидкости — бром, вода, газообразные — хлор, углекислый газ (рис. 30, б) и другие. Их удерживают слабые силы межмолекулярного взаимодействия. В результате молекулы с молекулярной кристаллической решеткой не притягиваются в соединениях друг к другу так сильно, как в ионных соединениях. Этим объясняется отличие таких свойств веществ с ионным и молекулярным строением, как твердость, переход из твердого агрегатного состояния в жидкое или газообразное, из жидкого в газообразное, способность растворяться в воде и т. п. (Приведите примеры веществ с ионным и молекулярным строением.)
Поскольку в веществах молекулярного строения молекулы связаны слабой силой межмолекулярного взаимодействия, необходимо немного энергии, чтобы отделить молекулы одну от другой. Вспомните, что для этого воду достаточно слегка нагреть (не говоря уже о кипячении), парафиновую свечу зажечь спичкой, нафталин оставить на некоторое время без упаковки.
Теперь, зная вид химической связи в веществе, вы можете охарактеризовать не только его количественный и качественный состав, но и физические свойства.
Итоги:
- Ионная связь — это связь за счет притяжения разноименно заряженных ионов. Ионы — заряженные частицы, в которые превращаются атомы, отдавая или присоединяя электроны.
- Кристаллическая решетка вещества — это трехмерное изображение порядка размещения ионов, атомов, молекул вещества в пространстве.
- Свойства веществ зависят не только от их состава, но и от вида химической связи и размещения структурных частиц вещества в кристалле.
Степень окисления
Долгое время составляли формулы веществ и расставляли коэффициенты в уравнениях реакций, используя понятие валентности атомов. Вам также приходилось неоднократно выполнять такие задания. Но наука не стоит на месте. Одно из доказательств этого — открытие новых законов, обоснование теорий, введение новых понятий. Это касается и понятия степени окисления.
Степень окисления — это условно принятый электрический заряд, который имел бы атом данного элемента в соединении, если бы все связи в нем были ионными.
И хотя степень окисления — величина условная, она оказалась удобной при объяснении протекания химических реакций, нахождении коэффициентов, то есть уравнивании уравнений реакций. Этим понятием пользуются не меньше, чем понятием валентности.
Для бинарных соединений с ионной связью заряд иона и степень окисления по величине и заряду совпадают. Заряды ионов помечают после символа химического элемента наверху и первым записывают арабской цифрой числовое значение заряда иона, а вторым — знак заряда, например:
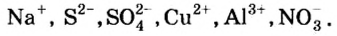
Степени окисления помечают над символом посередине и первым записывают знак заряда, а вторым — его числовое значение:
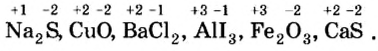
Обратите внимание, что в формулах химические символы элементов с положительными зарядами ионов и положительными степенями окисления записывают первыми (существуют исключения).
Относительно бинарных соединений неметаллов, в молекулах которых связь ковалентная и ионы отсутствуют, допускают условность, взятую за основу формулировки определения степени окисления. Представляют, что общие электронные пары полностью переходят к более электроотрицательному атому, и такому атому присваивают отрицательную степень окисления, числовое значение которой равно сумме количества смещенных электронных пар. Атомам другого элемента, напротив, присваивают положительное числовое значение степени окисления. Заметим, что степень окисления рассчитывают на один атом.
А как бытье атомами элементов, которые образуют двухатомные молекулы простых веществ, ведь каждый атом имеет одну и ту же электроотрицательность? Применяя к таким молекулам понятие степени окисления, общую электронную пару делят поровну между обоими атомами. И тогда каждый атом получает столько электронов, сколько он имел до образования связи. Рассмотрим это на примере азота, молекулярная формула которого 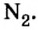 Но вначале напишем электронную формулу атома азота:
Но вначале напишем электронную формулу атома азота:

Как видим, атом имеет 7 электронов. Из 5 электронов на внешнем энергетическом уровне — 3 неспаренных. Этим объясняется, что в молекуле азота атом азота образует три ковалентные связи и его валентность в этом соединении равна 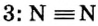
После условного разделения общих электронных пар поровну между двумя атомами
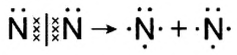
у каждого из атомов азота на внешнем энергетическом уровне окажется по 5 электронов. Это отвечает числу электронов на внешнем энергетическом уровне атома азота. Таким образом, степень окисления азота в молекуле азота 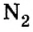 нулевая, тогда как оба атома трехвалентные.
нулевая, тогда как оба атома трехвалентные.
У простых веществ с двухатомными молекулами валентность и степень окисления атомов разные.
Что же касается сложных веществ, то в большинстве случаев валентность и степень окисления элементов имеют одинаковые числовые значения.
По известной степени окисления одного элемента можно определять степень окисления другого элемента.
Определение степени окисления атома элемента по химической формуле соединения
Чтобы определить степень окисления, стоит знать и использовать правила, учитывающие электроотрицательность атомов:
- Степень окисления элемента в простом веществе равна нулю (электроотрицательность атомов одинакова).
- Металлические элементы в соединениях с неметаллическими всегда имеют положительную степень окисления (их: электроотрицательность мала и электроны смещаются к атомам неметаллических элементов).
- Неметаллические элементы в соединениях с металлическими всегда имеют отрицательную степень окисления (их электроотрицательность больше, чем у металлических элементов).
- Водород в соединениях имеет степень окисления +1 (за исключением бинарных соединений с металлическими элементами).
- Кислород в соединениях имеет степень окисления -2 (за исключением соединения с фтором, пероксида водорода
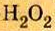 и т. п.).
и т. п.). - Величина степени окисления атома в соединении равна числу валентных электронов, которые приняли участие в образовании химической связи.
- Алгебраическая сумма степеней окисления всех атомов в соединении равна нулю.
- В бинарном соединении неметаллов положительную степень окисления имеет элемент с меньшей электроотрицательностыо.
Используя необходимые правила, потренируйтесь определять степени окисления атомов элементов в бинарных соединениях на примере таких формул:
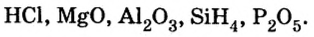
Можно также составлять формулы соединений по известным степеням окисления атомов элементов.
Составление формул соединений по известным степеням окисления атомов
Их составляют так же, как и формулы соединений по валентности.
Пример №16
Используя известную степень окисления серы +4, составить формулу ее соединения с кислородом.
Решение
1. Запишем рядом символы элементов, начиная с того, у которого степень окисления положительная: 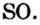
2. Согласно правилам, степень окисления кислорода в соединении равна -2, а серы — указана в условии. Поэтому запишем соответствующие степени окисления над символами элементов:
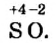
3. Для числовых значений степеней окисления серы и кислорода в этом соединении найдем наименьшее общее кратное. Для 4 и 2 оно равно 4. Разделим его на степень окисления каждого атома и найдем индексы: для серы 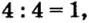 для кислорода
для кислорода 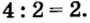
Ответ: 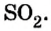
Итоги:
- Степень окисления — это условный заряд атома в соединении, вычисленный согласно предположению, что соединение состоит только из ионов.
- Степень окисления может иметь положительное, отрицательное и нулевое значения.
- При определении степеней окислений пользуются рядом электроотрицательности. В бинарных соединениях элементы с большим значением электроотрицательности имеют отрицательные значения степеней окисления.
- Используя известные степени окисления, можно составлять формулы веществ, а по формулам веществ — определять степени окисления.
Степень окисления в соединениях из трех и более элементов определяют по рассмотренным выше правилам.
Пример №17
Определить степень окисления серы в серной кислоте 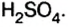
Решение
Обозначим степени окисления атомов в формуле и запишем их алгебраическую сумму: 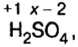 где
где 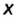 — степень окисления серы.
— степень окисления серы.
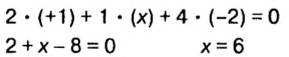
Ответ: 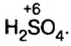
Пример 2. Определить степень окисления фосфора в дигидрофосфате натрия 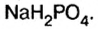
Решение
Обозначим степени окисления атомов в формуле и запишем их алгебраическую сумму: 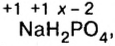 где
где 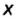 — степень окисления фосфора.
— степень окисления фосфора.
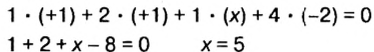
Ответ: 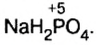
Периодическая таблица элементов и периодический закон
В процессе изучения неорганической химии вы ознакомились с историей открытия периодического закона и создания периодической таблицы химических элементов.
- В конце IX и начале X веков Абу ар-Рази классифицировал вещества на основе их растительного, животного и минерального происхождения. • В 1620 году A. Сала классифицировал растворители как водные, кислотные и масляные.
- В 1718 году Е. Жоффруа составил таблицу сходства веществ.
- В XVIII веке было известно около 30 элементов.
- В XIX веке стало известно более 60 элементов.
- Немецкие ученые И. Деберейнер (1829) и Ю. Meйер (1864), английские ученые У. Одлинг и Дж. Ньюлэндс (1863), французские ученые Дж. Дюма и А. Шанкуртуа (1862) и др. пытались систематизировать химические элементы.
- В 1869 году проблему систематизации успешно решил русский ученый Д.И.Менделеев.
Д.И.Mенделеев первоначально сформулировал периодический закон так: Свойства простых веществ, а также форма и свойства соединений элементов находятся в периодической зависимости от величины их атомных весов. Впоследствии с углублением знаний и расширением представлений о строении атома была предложена следующая новая формулировка периодического закона:
Свойства химических элементов и образованных ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов этих элементов.
Периодический закон – закон природы, который отражает все связи, существующие в природе. На основе периодического закона появилась периодическая таблица элементов.
Если в первоначальном варианте (1 марта 1869 г.) периодическая таблица включала 63 элемента, то в ее современном варианте – 118 элементов. Порядок расположения элементов в периодической таблице обусловлен периодичностью изменения их физических и химических свойств. Под периодичностью понимается повторяемость свойств через определенный интервал. Например, в таблице щелочные металлы, галогены и инертные газы располагаются через интервал (период), состоящий из 8 или 18 элементов. Такой порядок изменения свойств связан с заполнением электронных оболочек (слоев) атомов.
Периодическая таблица и периодический закон химических элементов с точки зрения строения атома
Открыт периодический закон и составлена периодическая таблица. Однако Д.И.Менделеев не смог объяснить сходство и различия свойств элементов, причину периодичности изменений. В XIX веке считалось, что атом — это неделимая частица, которая в химических реакциях не подвергается изменениям. Эти представления изменились благодаря открытиям, сделанным в конце XIX и начале ХХ веков.
Открытие электрона (английский ученый Дж.Томсон, 1897 г.).
Равенство заряда ядра элемента его порядковому номеру в периодической таблице (английский ученый Д.Mозли, 1913 г.).
Создание протонно-нейтронной теории строения атомного ядра (русские ученые Д.Д.Иваненко и Е.Н.Гапон, а также немецкий ученый В. Гейзенберг, 1932 г.).
Местоположение химического элемента в периодической таблице зависит от строения и свойств его атома. Изучение радиоактивности (M.Склодовская-Kюри, П.Kюри, Э.Резерфорд) показало, что атом химического элемента является сложной системой. Атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов (электрон  имеет массу, равную
имеет массу, равную 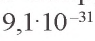 кг, и отрицательный заряд, равный
кг, и отрицательный заряд, равный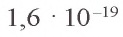 Kл). Совокупность электронов в атоме называется электронной оболочкой (электронным слоем). Атом – электронейтральная частица, следовательно, число электронов на электронной оболочке равно заряду ядра или порядковому номеру (Z) элемента в периодической таблице.
Kл). Совокупность электронов в атоме называется электронной оболочкой (электронным слоем). Атом – электронейтральная частица, следовательно, число электронов на электронной оболочке равно заряду ядра или порядковому номеру (Z) элемента в периодической таблице.
Согласно протоннонейтронной теории, ядро атома состоит из протонов и нейтронов (протон (p) – частица, имеющая массу 1 a.е.м. и заряд +1; нейтрон (n) – электронейтральная частица, имеющая массу, близкую к массе протона).
Заряд ядра определяется числом протонов, входящих в его состав, следовательно, число протонов атомного ядра равно порядковому номеру элемента в периодической таблице. Абсолютная масса атома (A) равна сумме масс всех частиц, входящих в состав атома:
A = масса протонов + масса нейтронов + масса электронов.
Так как масса электронов очень мала, можно считать, что масса атома состоит только из массы протонов и нейтронов. Относительная атомная масса Ar элемента равна:
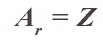 (число протонов, порядковый номер) + N (число http:eduportal.uz нейтронов).
(число протонов, порядковый номер) + N (число http:eduportal.uz нейтронов).
Число нейтронов в ядре атома равно разности между относительной атомной массой элемента и его порядковым номером: 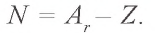 . Таким образом, по местоположению элемента в периодической таблице можно определить состав его атома (табл. 1)
. Таким образом, по местоположению элемента в периодической таблице можно определить состав его атома (табл. 1)
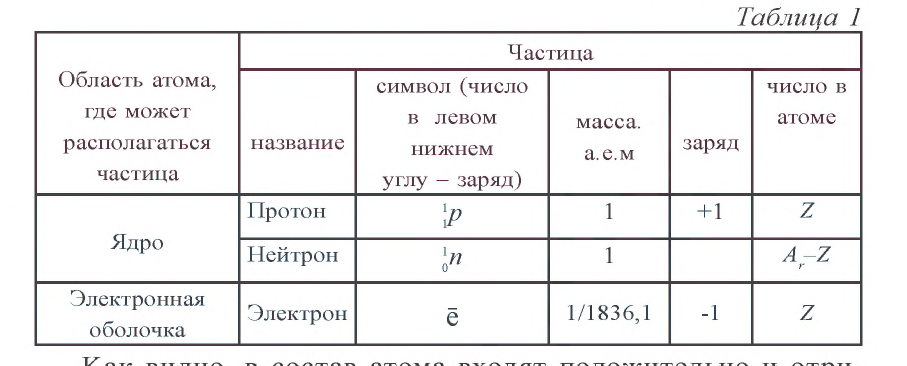
Kак видно, в состав атома входят положительно и отрицательно заряженные частицы – протоны и электроны, т.е. атом состоит из совокупности частиц с противоположными свойствами.
Протоны, нейтроны и электроны являются элементарными частицами, наряду с ними в настоящее время известно множество частиц с различными свойствами (массой, зарядом и др.). Хотя мы их не видим, существование их доказано экспериментальными данными ученых. Элементарные частицы, как и атомы и молекулы, являются разновидностью материи.
Как показало изучение строения атома, элементы в периодической таблице располагаются в определенном порядке в соответствии со строением электронных оболочек атомов.
В невозбужденном состоянии электронное строение атома определяется числом электронов в нем. При этом электроны занимают орбиты с минимальной энергией. Число электронов равно заряду ядра. Таким образом, именно заряд ядра определяет электронное строение атома и вместе с тем свойства элемента. Из этого вытекает следующая формулировка периодического закона.
Свойства химических элементов и образованных ими простых и сложных веществ находятся в периодической зависимости от зарядов атомных ядер этих элементов.
Количество электронных слоев у атома любого элемента равно номеру периода, в котором расположен этот элемент. Водород H и гелий He имеют один электронный слой и расположены в первом периоде; атомы элементов лития Li, бериллия Be, бора B, углерода C, азота N, кислорода O, фтора F и неона Ne имеют два электронных слоя и расположены во втором периоде и т.д. Атомы элементов не могут иметь на внешнем электронном слое более восьми электронов, и в периодической таблице имеется восемь групп. Каждая группа подразделяется на основную и побочную подгруппы. Число электронов на внешнем электронном слое атомов основной подгруппы (кроме He) равно номеру группы:
- Начало периода соответствует возникновению нового энергетического уровня. Каждый период начинается с щелочного металла и оканчивается инертным газом. Внешний уровень атомов этих элементов (кроме гелия) содержит восемь электронов и обозначается символами
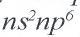 (где n – число электронных слоев).
(где n – число электронных слоев). - Элементы основной и побочной подгрупп различаются завершаемостью энергетических уровней. У всех элементов основных подгрупп заполняется или внешний s-подуровень (s-элементы первой и второй групп), или внешний p-подуровень (p-элементы третьей и восьмой групп). В первой побочной подгруппе, состоящей из трех декад (Sc–Zn, Y–Cd, La– Hg), завершается заполнение внутреннего d-подуровня, и поэтому эти элементы называются d-элементами. Во второй побочной подгруппе лантаноидов и актиноидов заполняется f-подуровень, расположенный еще глубже, поэтому эти элементы называются f-элементами.
Таким образом, электронное строение aтома не только объясняет строение периодической таблицы на основе количества групп, основных и побочных подгрупп, числа элементов в группах и периодах, но и расположение в периодической таблице таких элементов, как калий и аргон, кобальт и никель, теллур и йод (см. строение их атомов) и др.
Изменение свойств элементов в периодах и группах
Электронная теория строения атома объясняет изменение свойств элементов исходя из взаимосвязи их атомного строения и места в периодической таблице. Согласно этой теории, в основе химических реакций лежат электронные взаимоотношения – процессы перестройки электронных уровней атомов. В указанных процессах участвуют в основном электроны внешнего электронного слоя (валентные электроны). Так, строение внешнего электронного слоя атома углерода имеет вид  , а в возбужденном состоянии –
, а в возбужденном состоянии –  . Максимально заполненные слои бывают самыми устойчивыми. Такие электронные слои называются завершенными и имеют
. Максимально заполненные слои бывают самыми устойчивыми. Такие электронные слои называются завершенными и имеют 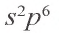 (8 электронов) электронную конфигурацию (кроме He). Поэтому инертные газы с трудом вступают в реакцию. Во внешних электронных слоях атомов металлов обычно содержится до четырех электронов, которые слабо связаны с ядром. Вступая в химические реакции, атомы теряют валентные электроны. Щелочные металлы, по сравнению с другими металлами, обладают сильно выраженными металлическими свойствами, так как они легче, чем другие металлы, теряют валентные электроны. Для сравнения металлических свойств элементов обычно используется специальная величина – энергия ионизации (I).
(8 электронов) электронную конфигурацию (кроме He). Поэтому инертные газы с трудом вступают в реакцию. Во внешних электронных слоях атомов металлов обычно содержится до четырех электронов, которые слабо связаны с ядром. Вступая в химические реакции, атомы теряют валентные электроны. Щелочные металлы, по сравнению с другими металлами, обладают сильно выраженными металлическими свойствами, так как они легче, чем другие металлы, теряют валентные электроны. Для сравнения металлических свойств элементов обычно используется специальная величина – энергия ионизации (I).
Энергия ионизации – это количество энергии, необходимое для отделения электрона от атома
Энергия ионизации выражается отношением электронвольта к атому (эВ). Энергия ионизации атомов находится в периодической зависимости от порядкового номера элемента. Во внешнем электронном слое атомов неметаллов имеется четыре и более электрона, тесно связанных с ядром. Вступая в химические реакции, атомы неметаллов обычно присоединяют электроны. Для сравнения неметаллических свойств элементов используется специальная величина – сродство к электрону (E).
Сродство к электрону – это количество энергии, которая выделяется или поглощается в результате присоединения одного электрона к нейтральному атому
Сродство к электрону измеряется отношением электронвольта к атому (эВ/aтом). Самой большой величиной сродства к электрону обладают типичные неметаллы – элементы основной подгруппы седьмой группы (F, Cl, Br, I). Рассмотрим изменение химических свойств в зависимости от строения атома на примере элементов одного, например третьего, периода. Атом каждого элемента этого периода имеет три электронных слоя K, L и M, при этом строение электронных слоев K и L для всех элементов данного периода одинаково, и различаются они лишь строением внешнего слоя M (табл. 2).
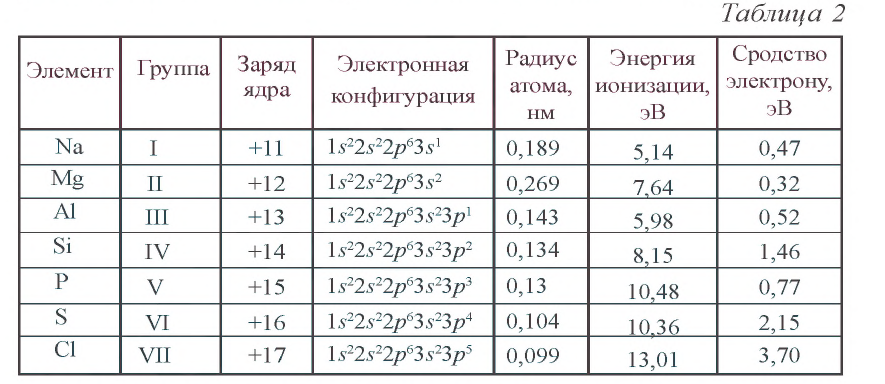
По мере увеличения заряда ядра атомов элементов в периодах радиус атома уменьшается, число электронов во внешнем электронном слое увеличивается. В результате усиливается притяжение к ядру электронов внешнего электронного слоя, возрастают энергия ионизации и сродство к электрону. Поэтому к концу периода металлические свойства элементов ослабевают, а неметаллические – усиливаются.
Действительно, третий период начинается с типичного щелочного металла – натрия. За ним располагается другой типичный щелочной металл магний, который, однако, обладает меньшими, чем натрий, металлическими свойствами. Следующий металл – алюминий – в некоторых соединениях проявляет неметаллические свойства. У элементов Si, P, S, Cl неметаллические свойства усиливаются от Si к Cl. Хлор – типичный неметалл. Период завершается инертным газом аргоном. Такие изменения химических свойств элементов наблюдаются во всех периодах. В больших периодах металлические свойства элементов медленно ослабевают относительно элементов малых периодов, а неметаллические свойства постепенно усиливаются. Рассмотрим изменение химических свойств и строения атомов элементов основной подгруппы на примере элементов первой группы A (табл. 3).

У элементов одной подгруппы ст роение внешнего электронного слоя атомов одинаковое. Во внешних электронных слоях атомов элементов первой группы А имеется по одному s-электрону. Однако с увеличением порядкового номера (заряда ядра) элемента возрастают радиусы атомов и число электронов. Это приводит к ослаблению притяжения внешних электронов к ядру и уменьшению энергии ионизации.
Поэтому в основных подгруппах с возрастанием порядковых номеров элементов сверху вниз их металлические свойства усиливаются, а неметаллические свойства – ослабевают. Изменение свойств элементов по периодам и группам можно охарактеризовать следующим образом:
- С возрастанием порядковых номеров (зарядов ядер) элементов в группах их металлические свойства усиливаются, неметаллические свойства ослабевают.
- С возрастанием порядковых номеров (зарядов ядер) элементов в периодах их металлические свойства ослабевают, неметаллические свойства усиливаются
Следовательно, самые сильные металлические свойства проявляются у цезия, самые сильные неметаллические свойства – у фтора. С возрастанием зарядов ядер атомов периодически изменяются число электронов во внешнем электронном слое и радиусы атомов
Ядро атома
Ядро атома состоит из нейтронов и протонов. Нейтрон – нейтральная частица, обозначаемая буквой n. Его относительная масса равна 1 а.е.м. Протон – положительно заряженная частица, обозначаемая буквой p. Его относительная масса 1 а.е.м. Следовательно, ядро атома заряжено положительно, и заряд ядра равен порядковому номеру элемента в периодической таблице.
Строение электронных слоев атомов
Будучи электронейтральной системой, атом состоит в основном из положительно заряженного ядра и вращающихся вокруг ядра отрицательно заряженных электронов. Число протонов в электронейтральном атоме равно числу электронов. Электроны вращаются вокруг ядра на энергетических уровнях. Энергетические уровни подразделяются на подуровни подуровни, в свою очередь, на энергетические ячейки.
1. Энергетический уровень n
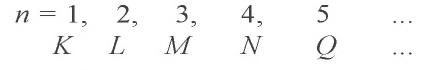
Чем меньше значение энергетического уровня, тем больше энергия связывания электронов этого уровня с ядром.
Число электронов любого энергетического уровня определяется по формуле 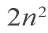 : при n = 1: 2 .
: при n = 1: 2 . 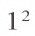 = 2 электрона; при n = 2: 2 .
= 2 электрона; при n = 2: 2 . 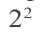 = 8 электронов; при n = 3: 2 .
= 8 электронов; при n = 3: 2 . 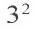 = 18 электронов; при n = 4: 2 .
= 18 электронов; при n = 4: 2 . 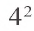 = 32 электрона. 2. Энергетический подуровень l. Различается по s-, p-, d-, f-электронам, вращающимся вокруг ядра, и определяет энергию подуровневых электронов или форму электронных «облаков». Его значения составляют от 0 до n–1: при n = 1 l = 0; при n = 2 l = 0,1; при n = 3 l = 0,1,2... (табл. 4).
= 32 электрона. 2. Энергетический подуровень l. Различается по s-, p-, d-, f-электронам, вращающимся вокруг ядра, и определяет энергию подуровневых электронов или форму электронных «облаков». Его значения составляют от 0 до n–1: при n = 1 l = 0; при n = 2 l = 0,1; при n = 3 l = 0,1,2... (табл. 4).
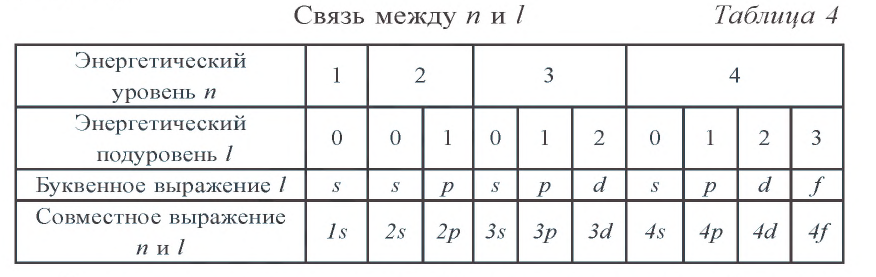
Число электронов на подуровнях определяется по формуле: 2 ·(2l+1). s-Электроны вращаются вокруг ядра по шарообразной траектории, и на каждом энергетическом уровне (слое) находится по два электрона (2 · (2 · 0 + 1) = 2). p-Электроны вращаются вокруг ядра по осям x, y и z перпендикулярно, и в каждом слое, начиная со второго, находится до шести электронов (2 · (2 · 1 + 1) = 6). d- и f-Электроны вращаются вокруг ядра по более сложной траектории. Начиная с третьего слоя, в каждом слое имеется до 10 d-электронов и, начиная с четвертого слоя, в каждом слое имеется до 14 f-электронов.
Химические элементы подразделяются на s-, p-, d- и fэлементы в зависимости от того, на каком энергетическом подуровне вращается последний присоединенный электрон. Незаполненные ячейки в подуровнях сначала по одному максимально заполняются электронами, затем оставшиеся электроны по порядку спариваются. Порядок заполнения энергетических уровней и подуровней электронами можно представить следующим образом:
Справочный материал по химической связи
Электронная теория строения атома объясняет способность атомов соединяться в молекулы, т.е. механизм и природу образования химической связи.
Химическая связь – это взаимодействие двух и более атомов, в результате которого образуются химически устойчивые двух- или многоатомные системы (например, молекула или кристалл).
Направленность связи определяет пространственную структуру и форму молекулы.
Полярность связи определяется асимметрией размещения общей электронной пары вокруг оси связи.
Кратность связи определяется числом электронных пар, связывающих атомы.
Длина связи – это равновесное состояние расстояния между ядрами атомов (измеряется в нм).
Энергия связи равна работе, совершаемой для разрыва связи (измеряется в кДж/моль).
Образование химической связи представляет собой экзотермический процесс, который сопровождается выделением энергии. Разрыв связи – эндотермический процесс, который сопровождается поглощением энергии. Основными видами химической связи считаются ковалентная, ионная, металлическая, водородная связи.
Связывание атомов при помощи общих электронных пар называется ковалентной связью.
Способность атома химического элемента притягивать общую электронную пару, участвующую в связи, называется электроотрицательностью:
- a) ковалентная связь между атомами с одинаковым значением электроотрицательности называется неполярной ковалентной связью (общая электронная пара располагается симметрично между соседними ядрами);
- б) ковалентная связь между атомами с различным значением электроотрицательности называется полярной ковалентной связью (общая электронная пара смещается в сторону одного из ядер).
Простые вещества (такие, как  обладают неполярной ковалентной связью, многие сложные вещества (такие, как H
обладают неполярной ковалентной связью, многие сложные вещества (такие, как H – полярной ковалентной связью. При нормальных условиях вещества с ковалентной связью могут быть твердыми (парафин, лед), жидкими (вода, спирт) и газообразными (кислород, азот, аммиак).
– полярной ковалентной связью. При нормальных условиях вещества с ковалентной связью могут быть твердыми (парафин, лед), жидкими (вода, спирт) и газообразными (кислород, азот, аммиак).
При образовании соединений из атомов элементов, резко различающихся электроотрицательностью (типичные металлы и типичные неметаллы), общая электронная пара полностью смещается в сторону атома с большей электроотрицательностью. В результате образуются ионы (положительно заряженные катионы и отрицательно заряженные анионы). Например, при горении натрия в хлоре 3s-электрон натрия спаривается с 3p-электроном хлора, и общая электронная пара полностью смещается в сторону атома хлора, в результате чего образуются катион Na+ и анион Cl–
Частицы, образованные в результате присоединения или потери электронов атомами, называются ионами.
Соединения, образованные из ионов, называются ионными.
Связь между ионами называется ионной
Между ионной и ковалентной связями не существует четкой границы. Ионную связь можно считать предельным состоянием полярной ковалентной связи. Однако, в отличие от ковалентной связи, ионная связь не имеет направленности.
Процесс отдачи электронов называется окислением.
Процесс присоединения электронов называется восстановлением
Например, при взаимодействии натрия и хлора атом натрия отдает электрон и окисляется, образуя катион: Na – ē → Na+ . Атом хлора присоединяет электрон и восстанавливается, образуя анион: Cl + ē → Cl– . Металлы основной подгруппы первой и второй групп образуют типичные ионные соединения с неметаллами основной подгруппы седьмой группы.
Ионные соединения при нормальных условиях – это твердые вещества.
Атом водорода, связанный с атомом элемента с сильной электроотрицательностью (фтор, кислород, азот), обладает способностью образовывать еще одну связь с атомом другого элемента с сильной электроотрицательностью. Например, в молекуле воды водород связан с сильно электроотрицательным элементом кислородом посредством полярной ковалентной связи. Общая электронная пара смещена в сторону атома кислорода, атом водорода заряжен положительно, а атом кислорода отрицательно. Положительно заряженный атом водорода одной молекулы воды притягивается отрицательно заряженным атомом кислорода другой молекулы воды, что приводит к образованию связи между двумя атомами кислорода посредством водорода
Связь между двумя электроотрицательными атомами (неметалла) через атом водорода (точнее через протон) называется водородной.
Водородная связь характерна для воды, жидкого аммиака, фторида водорода и многих органических соединений. Meталлам свойственны самая низкая энергия ионизации и наличие большого количества подвижных электронов. В структуре кристаллической решетки металла электроны легко отрываются от атомов, в результате чего образуются электронный газ и положительно заряженные ионы металла. Электроны по всему кристаллу считаются общими.
Валентность элементов и степень их окисления
Атом одного элемента может присоединять только определенное число атомов другого элемента.
Валентность – это способность атома элемента присоединять определенное количество атомов другого элемента.
Валентность элементов определяется числом общих электронных пар, связывающих атом одного элемента с атомом другого элемента.
Валентность не может быть равна нулю и иметь отрицательное или положительное значение. Понятие «валентность» целесообразно применять только по отношению к соединениям с ковалентной связью. Для характеристики состояния атома в соединениях используется понятие, называемое степенью окисления
Степень окисления – это условный заряд, приобретаемый атомом молекулы при превращении его в ион (т.е. при полном или частичном смещении общей электронной пары в сторону атома с большей электроотрицательностью.
Степень окисления не всегда численно равна валентности. При определении степени окисления каждого элемента в соединениях необходимо помнить следующее:
Степень окисления атомов в молекулах, состоящих из одинаковых атомов, равна нулю.
Степень окисления водорода в гидридах металлов равна –1, а во всех других соединениях +1.
Степень окисления кислорода во многих соединениях равна –2, в соединениях с фтором +2, в пероксидах (E–O– O–E) –1.
Степень окисления фтора во всех соединениях равна –1.
Степень окисления щелочных металлов во всех соединениях равна +1.
Степень окисления элементов основной подгруппы второй группы во всех соединениях равна +2.
Степень окисления атомов простых веществ равна нулю.
Поскольку алгебраическая сумма степеней окисления всех элементов в соединении равна нулю, с помощью элементов, степень окисления которых известна, можно определить неизвестную степень окисления других элементов этого соединения.
Многие элементы имеют переменную степень окисления.
Самая высокая степень окисления равна номеру группы периодической таблицы, в которой расположен этот элемент.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |