
Газовые законы в физике - формулы и определения с примерами
Содержание:
Газовые законы:
С помощью уравнения состояния идеального газа можно исследовать процессы, при которых сохраняются постоянными масса газа и один из его макроскопических параметров.
Газовыми законами называются законы, определяющие количественную зависимость между двумя макроскопическими параметрами газа данной массы 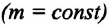
Изопроцессами (греч.: izos - "равный ") называются процессы, протекающие в газах данной массы 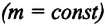
Закон Бойля-Мариотта
Этот закон был определен в 1662 году английским физиком Робертом Бойлем (1627-1691) и в 1676 году французским физиком Эдом Мариоттом (1620-1684).
Для данной массы газа при неизменной температуре произведение давления газа на его объем постоянно 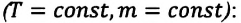

Для данной массы газа при неизменной температуре произведение давления начального состояния 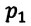 на его первоначальный объем
на его первоначальный объем 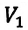 равно произведению значений этих параметров
равно произведению значений этих параметров 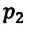 и
и 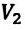 произвольного состояния:
произвольного состояния:
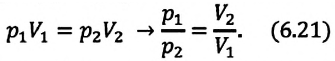
Изотермическим называется процесс изменения состояния данной массы идеального газа при постоянной температуре 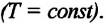 В изотермическом процессе давление газа и его объем обратно пропорциональны друг другу (b).
В изотермическом процессе давление газа и его объем обратно пропорциональны друг другу (b).
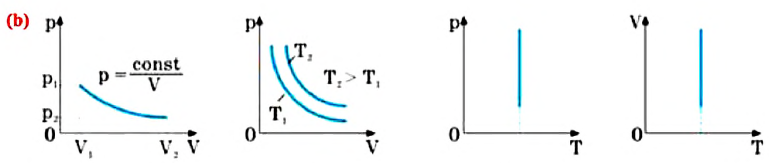
Закон Гей-Люссака
Этот закон был экспериментально установлен в 1802 году французским физиком Джозефом Луи Гей-Люссаком (1778-1850).
Для данной массы газа при неизменном давлении отношение объема газа к его абсолютной температуре постоянно 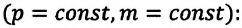
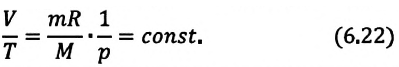
При неизменном давлении отношение первоначального объема газа 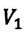 к его первоначальной температуре
к его первоначальной температуре 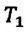 равно отношению параметров
равно отношению параметров 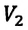 к
к 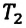 в произвольном состоянии:
в произвольном состоянии:

Закон Гей-Люссака можно выразить и так:
Для данной массы идеального газа при неизменном давлении относительное
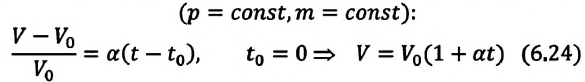
Где 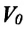 -объем идеального газа при постоянном давлении при температуре 0°С,
-объем идеального газа при постоянном давлении при температуре 0°С, 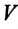 -объем конечного состояния,
-объем конечного состояния, 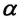 — коэффициент объемного расширения. Опыты показывают, что при нагревании любого разряженного газа на
— коэффициент объемного расширения. Опыты показывают, что при нагревании любого разряженного газа на 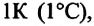 при постоянном давлении, его объем увеличивается приблизительно на
при постоянном давлении, его объем увеличивается приблизительно на 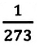 часть объема первоначального состояния:
часть объема первоначального состояния:
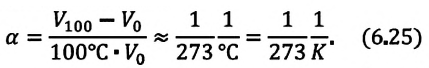
Изобарным называют процесс изменения состояния данной массы идеального газа при постоянном давлении 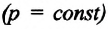 (с). При изобарном процессе объем данной массы газа прямо пропорционален его температуре.
(с). При изобарном процессе объем данной массы газа прямо пропорционален его температуре.
Закон Шарля
Этот закон экспериментально определил в 1787 году французский физик Шарль Жак Александр Сезар (1746-1823):
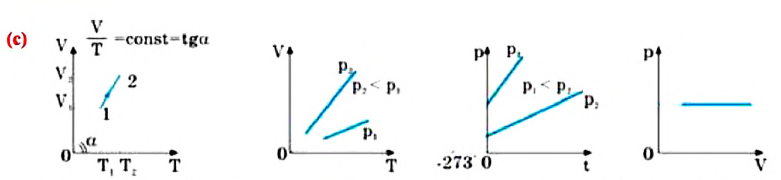
Для данной массы газа при постоянном объеме отношение давления газа к его абсолютной температуре остается неизменным 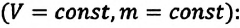
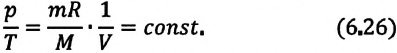
Отношение первоначального давления 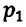 газа к его температуре
газа к его температуре 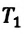 равно отношению параметров
равно отношению параметров 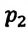 к
к 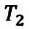 в произвольном состоянии:
в произвольном состоянии:

Закон Шарля можно выразить и так:
Для данной массы идеального газа при неизменном объеме относительное изменение давления прямо пропорционально изменению температуры 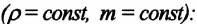
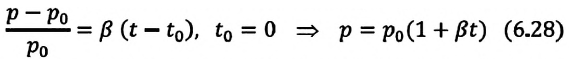
Где 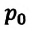 - давление начального состояния идеального газа (при температуре
- давление начального состояния идеального газа (при температуре 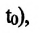
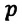 — давление конечного состояния (при температуре
— давление конечного состояния (при температуре 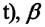 - коэффициент изменения давления. Из опытов было определено, что при нагревании любого разряженного газа на
- коэффициент изменения давления. Из опытов было определено, что при нагревании любого разряженного газа на 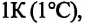 при постоянном объеме, его давление увеличивается приблизительно на
при постоянном объеме, его давление увеличивается приблизительно на 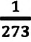 часть давления первоначального состояния:
часть давления первоначального состояния:
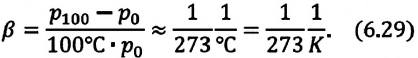
Изохорным называется процесс изменения состояния данной массы идеального газа при постоянном объеме 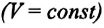 (d). При изохорном процессе давление данной массы газа прямо пропорционально его температуре.
(d). При изохорном процессе давление данной массы газа прямо пропорционально его температуре.
Закон Дальтона
Этот закон в 1801 году установил английский исследователь Джон Дальтон (1766-1844):
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений этих газов:
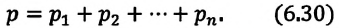
Парциальное давление — это давление отдельно взятого газа из газовой смеси.
Закон Авогадро
Этот закон, как предположение, был выдвинут в 1811 году итальянским физиком Амедео Авогадро (1776-1856). В последующем это предположение было подтверждено многочислеными опытами.
В равных объемах различных газов, взятых при одинаковых температурах и давлении, содержится одинаковое число молекул. Например, число молекул в 1 моле произвольного газа равно: 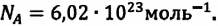 При нормальных условиях объём 1 моля газа равен 22,4 л (л/моль). Этот объём называют молярным объёмом идеального газа.
При нормальных условиях объём 1 моля газа равен 22,4 л (л/моль). Этот объём называют молярным объёмом идеального газа.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |