
Физические и химические явления в химии - формулы и определения с примерами
Содержание:
Физические и химические явления:


Сравните картинки. В результате какого явления гвозди ржавеют, черешня сгнивает, а вода превращается из жидкого состояния в твёрдое или газообразное состояния. Чем отличаются эти явления друг от друга? Как это можно объяснить? Какие признаки имеют химические реакции?
Каждому из нас в повседневной жизни доводилось наблюдать, как нагретая вода, превратившись в пар, «исчезает» (переходит в состояние невидимого газа), и как этот пар при соприкосновении с холодной поверхностью предмета вновь превращается в капельки воды. Точно так же все видели превращение воды в лед в выставленной наружу в холодный морозный день посуде и обратный переход его в жидкое состояние при внесении в помещение. Образуется ли новое вещество при этих превращениях?
Возьмите две миски небольшой ёмкости. В одной из мисок смешайте небольшое количество соли с водой, а в другой - сахара с водой и поставьте на слабый огонь. Что вы наблюдаете? Запишите свои мысли в тетради.
Из курса физики нам известно, что все происходящие в природе изменения называются явлением. Например, выпадение дождя, восход солнца, удар грома, землетрясение, таяние ледников и др. (рис.1).

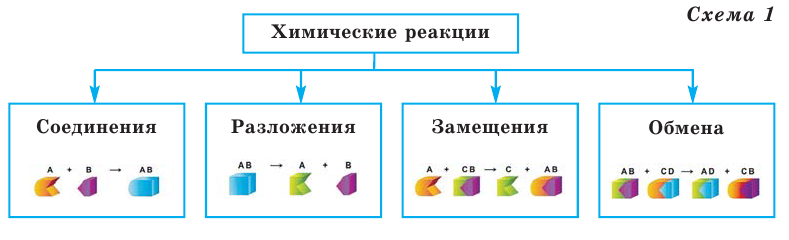
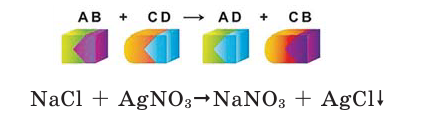
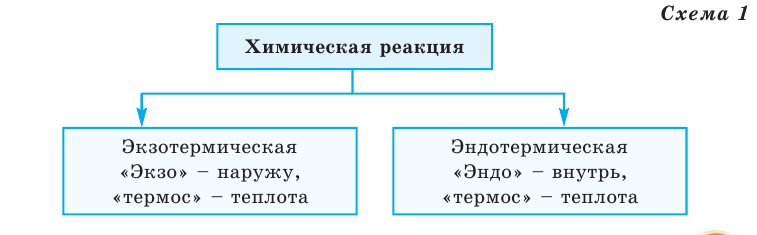
Все происходящие в природе явления делятся на 2 группы (схема 1)
Схема 1
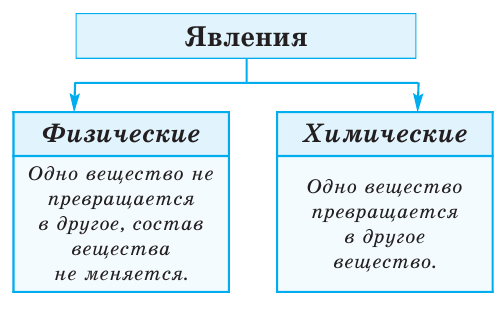
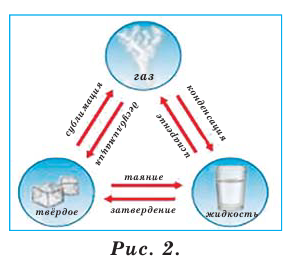
Во время физических явлений изменяются лишь агрегатное состояние, форма, размеры, объём, давление, температура и скорочть движения вещества (рис.2). Например, замерзание воды, таяние льда, кипение воды и др.
1. Нагрейте медную проволку. 2. В отстоявшуюся известковую воду с помощью трубочки вдуньте воздух или же добавьте немного раствора соды. 3. Подожгите кусочек серы размером с горошину. Что вы наблюдаете в каждом случае?
Во время химических явлений из исходного вещества образуются новые вещества. Например, такие химические явления, как горение, брожение, гниение, электролиз, разложение на составные части, ржавление (коррозия) и др. называют химическими реакциями.
Химические реакции имеют несколько признаков. Эти признаки показывают протекание химических реакций (рис. 3).
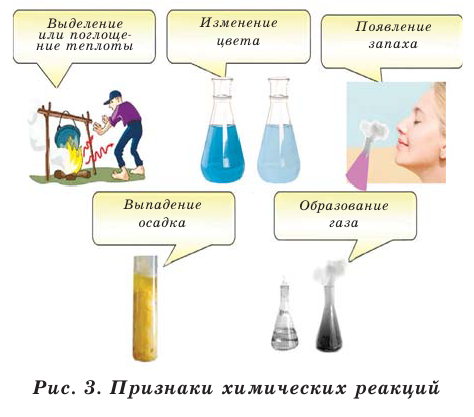
Химические явления всегда сопровождаются физическими явлениями. Например, при горении природного газа, наряду с образованием углекислого газа и воды (химическое явление), также выделяются свет и теплота (физическое явление).
Значение физических и химических явлений
Из курса «Познание мира» вам известно, какое значение имеют физические явления, происходящие вокруг нас. Так, например, испарение воды, конденсация водяных паров и выпадение дождя составляют круговорот воды в природе. В промышленном производстве, придавая металлам, пластмассам и другим материалам определенную форму (штамповка, прокатка), получают разнообразные предметы.
Химические реакции имеют огромное значение. Ими пользуются для получения различных металлов (железа, алюминия, меди, цинка, свинца, олова и др.), а также пластмасс, минеральных удобрений, лекарственных препаратов и т.д. Выделяемая при сгорании топлива энергия используется в быту и в промышленности.
Условия начала и хода химических реакций бывают разными. Для протекания ряда реакций (например, реакций горения) достаточно соприкосновения (трения) частиц веществ и подогревания до определенной температуры. Доведение реакции до конца обеспечивается за счет выделяемой тепловой энергии.
Некоторые же реакции (например, разложение воды на кислород и водород) требуют подачи дополнительной энергии до конца.
В природе физические и химические явления (реакции) протекают непрерывно, постоянно, обеспечивая этим циркуляцию веществ, климатические изменения, условия жизни для живых организмов.
Химические уравнения. Знаки сохранения массы веществ
Смочите в пробирке около 2-х г хлорида натрия небольшим количеством воды. Влив в пробирку до четверти её объёма концентрированной серной кислоты, закройте её горлышко пробкой, через которую проходит газоотводная трубка. При этом кислота должна быть концентрированной, а соль - в виде кристаллов. Пробирку с содержащимися в ней солью и серной кислотой слегка подогрейте. Что вы наблюдаете? Происходят ли изменения в массах веществ в результате реакции? Запишите уравнение реакции.
Происходящие в природе химические превращения в письменном виде выражают посредством химических уравнений. Условная запись химической реакции посредством формул, знаков и коэффициентов называется химическим уравнением.
Химическое уравнение составляется на основе нижеприведённых правил:
- Записываются химические формулы веществ, вступающих в реакцию.
- Если число вступающих в реакцию веществ два и больше, между ними ставится знак « + ».
- Затем ставится знак
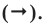
- После знака стрелки записываются химические формулы полученных веществ.
- При получении двух и более продуктов между ними ставится знак
Например, составим уравнение реакции горения водорода в кислороде:
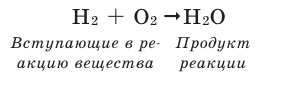
Здесь количество атомов в правой и левой частях неодинаковое. Такую запись называют схемой реакции. Для того, чтобы превратить данную схему в уравнение, следует уравнять число атомов в левой и правой частях уравнения.
Уравнивание количества атомов элементов в правой и левой частях уравнения называют коэффицированием уравнения. Определим число атомов элементов, входящих в состав веществ в реакции образования воды.
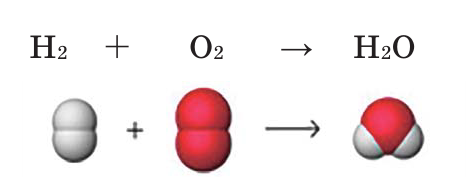
Если обратим внимание на реакцию, то увидим, что количество атомов водорода в обеих частях одинаковое. А количество атомов кислорода в правой части на единицу меньше количества атомов кислорода в левой части. Вследствие этого, вначале уравним число атомов кислорода. Для этого число атомов в правой части реакции умножается на 2, и на основе этого определяется коэффициент веществ на левой стороне.
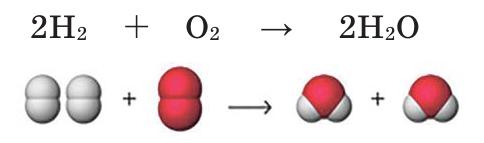
В результате количество атомов водорода и кислорода в левой и правой частях уравнивается и получается уравнение химической реакции. 2 молекулы водорода, вступая в реакцию с 1 молекулой кислорода, образуют 2 молекулы воды.
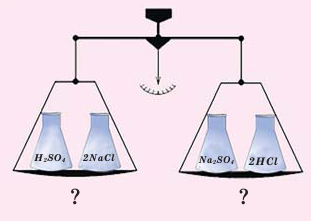
Впервые в 1748-ом году знаменитым русским учёным М.В.Ломоносовым, и независимо от него, в 1789-ом году французским учёным А.Лавуазье был открыт закон о том, что во время химических реакций сумма масс, вступающих в реакцию веществ, равна сумме масс, полученных в результате реакции веществ.
Закон сохранения массы веществ выражается следующим образом: Сумма масс веществ, вступивших в химическую реакцию, равна сумме масс веществ, полученных в результате реакции.
В колбу насыпают небольшое количество серы, после этого её закупоривают пробкой и взвешивают на весах (1). Затем колбу вместе с серой осторожно нагревают (2). На основе появления в колбе дыма, состоящего из частиц оксида серы (IV), можно определить протекание химической реакции.
При повторном взвешивании обнаруживается, что в результате реакции масса вещества осталась неизменной (3).
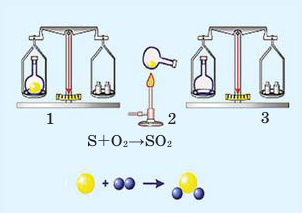
Типы химических реакций

Поместите в керамический тигель немного бихромата аммония 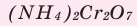 и поставьте на большую асбестовую плитку. Нагрев стеклянную палочку, прикоснитесь ею к веществу.
и поставьте на большую асбестовую плитку. Нагрев стеклянную палочку, прикоснитесь ею к веществу.
Что вы видите? Изложите свои соображения относительно происходящего процесса и запишите уравнение реакции. Почему эту реакцию называют «химическим вулканом»?
Химические реакции классифицируются по различным признакам. По количеству веществ, вступивших в реакцию и полученных в результате реакции, химические реакции подразделяются на 4 типа (схема 1):
Реакции соединения
Реакции, при которых из двух и более простых или сложных веществ получают одно сложное вещество, называют реакциями соединения.
Для протекания химических реакций иногда требуется нагревание. В таком случае в уравнениях реакций над стрелкой ставится
знак t.
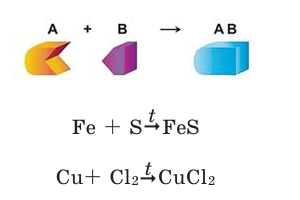
Реакции разложения
Реакции, при которых из одного сложного вещества получают два и более простых или сложных веществ, называют реакциями разложения.
Если во время реакции выделяется газ, в таком случае, рядом с её химической формулой проставляется стрелка, направленная вверх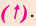
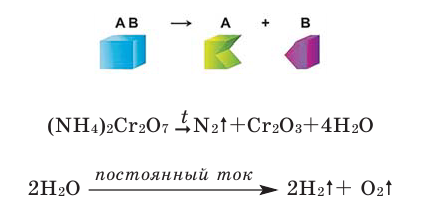
Реакции замещения
Если в реакциях, протекающих между простым и сложным веществом, атомы одного из элементов сложного вещества замещаются атомами простого вещества, то такие реакции называются реакциями замещения.
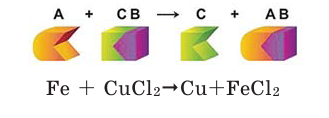
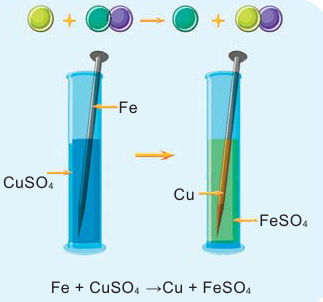
Опустите в раствор сульфата меди (II)  голубого цвета очищенный железный гвоздь или железную пластинку. Что вы наблюдаете?
голубого цвета очищенный железный гвоздь или железную пластинку. Что вы наблюдаете?
Если во время реакции выпадает осадок, в таком случае, рядом с химической формулой полученного вещества проставляется стрелка, направленная вниз 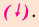
Реакции обмена
Если в реакциях, протекающих между двумя сложными веществами, составные части сложных веществ, меняясь местами, образуют новые сложные вещества, то такие реакции называются реакциями обмена.
Тепловой эффект химических реакций

Наблюдаете ли вы за тем, какие изменения происходят в вашем организме во время занятий спортом, приготовления уроков и приёма пищи? Как в это время изменяется ваша энергия?
В жизни мы постоянно принимаем пищу, а также занимаемся определённой деятельностью (умственной и физической). Вначале мы, приняв пищу, увеличиваем свою энергию, а занимаясь различной деятельностью, тратим ту энергию, которую получили благодаря приёму пищи (т.е. наша энергия уменьшается), и в результате мы чувствуем себя усталыми и утомлёнными. Как и человек, каждое химическое вещество обладает определённым запасом энергии. Химические реакции веществ сопровождаются выделением или поглощением теплоты.
Количество выделяемой или поглощаемой в ходе химической реакции теплоты называется тепловым эффектом.
Тепловой эффект обозначается буквой Q, а единица его измерения — кДж. В зависимости от выделения или поглощения теплоты химические реакции делятся на 2 группы (схема 1)
Химические реакции, протекающие с выделением теплоты, называются экзотермическими реакциями. В уравнениях экзотермических реакций выделяемая теплота (Q) указывается в правой стороне реакции знаком «+» (Q>0).
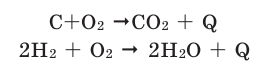
Все реакции горения - экзотермические. Реакция между азотом и кислородом - эндотермическая. (Это не реакция горения).
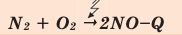
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими реакциями. В уравнениях эндотермических реакций поглощённая теплота указывается в правой стороне реакции знаком «— ». То есть Q < 0:
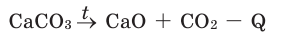
Большинство реакций разложения и некоторые реакции соединения - эндотермические. Реакция разложения монооксида азота - экзотермическая.
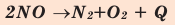
Уравнения химических реакций, в которых указаны агрегатное состояние и тепловой эффект вступающих в реакцию и полученных веществ, называются термохимическими уравнениями. В термохимических уравнениях вместо стрелки 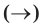 проставляется знак
проставляется знак 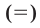 .
.
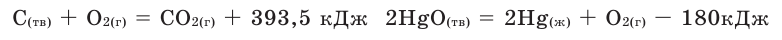
Количество тепла, выделяемого или поглощаемого во время образования 1 моля сложного вещества из простых веществ, называется теплотой образования. Теплота образования обозначается в виде 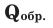 и измеряется в кДж/моль. Для вычисления теплоты образования полученного продукта в термохимическом уравнении, следует тепловой эффект реакции поделить на коэффициент продукта. Например:
и измеряется в кДж/моль. Для вычисления теплоты образования полученного продукта в термохимическом уравнении, следует тепловой эффект реакции поделить на коэффициент продукта. Например:
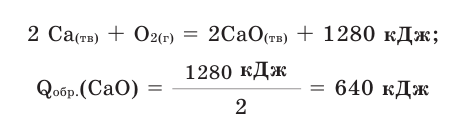
Процесс отрыва электрона от того или иного атома является эндотермическим, а присоединение к атому электрона - экзотермическим процессом. Например:
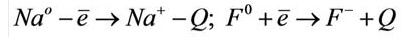
Горение. Рациональное сжигание топлива
Обратите внимание на картинки. Что вы наблюдаете, разжигая костёр?
Реакции, протекающие с выделением теплоты и света при взаимодействии веществ с кислородом, называются реакциями горения или просто горением.
Реакции горения - это процесс окисления, протекающий с большой скоростью.
Теплота, выделяемая во время полного сгорания 1 моля того или иного вещества, называется теплотой горения (измеряется в к Дж/моль). При вычислении теплоты горения тепловой эффект реакции делится на коэффициент сгорающего вещества.
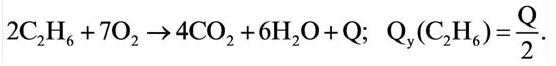
Для горения веществ нужны два условия:
- а) нагревание вещества до температуры возгорания - каждое вещество имеет свою температуру возгорания. Например, белый фосфор воспламеняется при 40
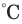 , сера и древесина - при 270
, сера и древесина - при 270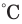 , древесный уголь при 350
, древесный уголь при 350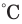 и т. д.
и т. д. - б) соприкосновение кислорода с частицами вещества - реакции горения веществ в чистом кислороде протекают во много раз быстрее реакций горения в воздухе. Это объясняется тем, что кислород составляет лишь 1/5 часть воздуха.
Для получения тепловой энергии используют различные виды топлива в природе. По своему агрегатному состоянию топливо подразделяется на 3 вида (схема 1)
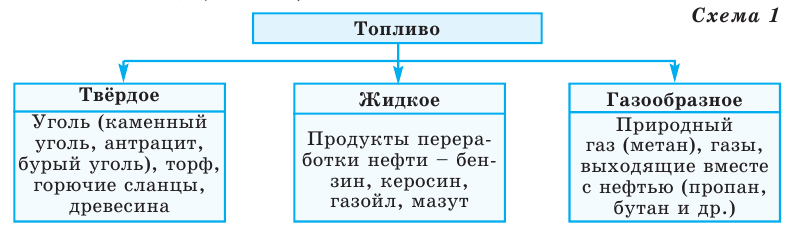
Газообразное топливо имеет ряд преимуществ по сравнению с твердым и жидким топливом: его добыча и транспортировка экономически более выгодны; упрощается регулирование процесса горения; достигается более полное сжигание топлива; устраняется загрязнение окружающей среды. Качество топлива определяется его теплотворной способностью, т.е. количеством теплоты (в кДж), выделяемой при сжигании 1 кг топлива.
А теплотворная способность топлива определяется количеством углерода в составе топлива.
Как следует поступить, если произойдёт пожар?
Для предотвращения процесса горения следует: 1) охладить температуру горящего материала с доведением её до более низкой, чем при его воспламенении, температуры; 2) предотвратить соприкосновение кислорода (или воздуха) с горящим материалом.
При погашении огня водой горящий материал одновременно и остывает и в то же время образующийся от нагрева воды пар в достаточной степени устраняет соприкосновение материала с кислородом (с воздухом). Кроме воды, соприкосновение воздуха с горящим материалом предотвращается при помощи песка, грунта, огнетушителей и некоторых взрывчатых веществ. Если огонь охватил малую площадь, то горящую часть вещества следует накрыть одеялом, паласом, плотной тканью и т.д., не пропускающими воздух (рис. 1). Если загорелась ваша одежда, следует незамедлительно принять меры, указанные выше.

Вычисления по химическим уравнениям
Вычисления по химическим уравнениям производятся в следующей последовательности:
- Вначале следует составить уравнение соответствующей реакции и проставить коэффициенты;
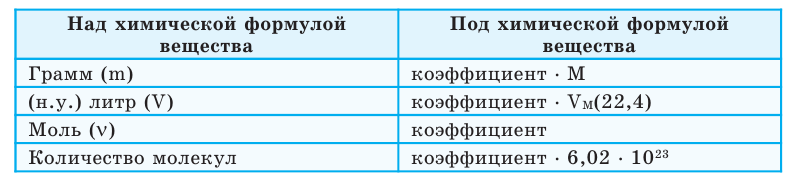
- Указанные в условии задачи данные (х) (вместе с единицей измерения) записать над соответствующей формулой вещества;
- Отметить количество веществ (v, N, m, V) под химическими формулами, учитывая соответствующие единицы измерения и их коэффициенты;
- Составив пропорцию, производить вычисления.
I. Вычисление массы и количества полученного вещества (или вступающего в реакцию другого вещества) при указании в условии задачи массы одного из вступающих в реакцию веществ (или наоборот).
Задача 1. Вычислите массу (в граммах) и количество вещества (моль) углекислого газа, полученного при полном сгорании 24 г угля: 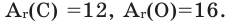
Решение:
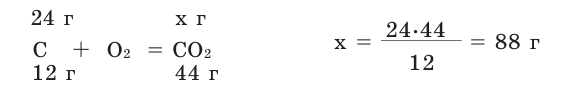
б) Находим количество вещества  по формуле
по формуле 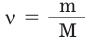
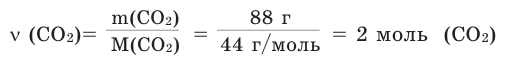
II. Вычисление количества и массы полученного вещества (или вступающего в реакцию другого вещества) при указании в условии задачи количества одного из вступающих в реакцию веществ (или наоборот).
Задача 2. Какое количество (моль) и сколько граммов кислорода необходимо для вступления в реакцию с 8 молями водорода? 
Решение:
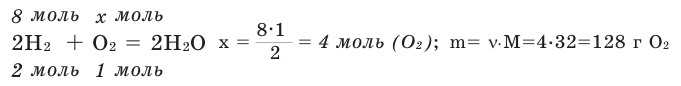
III. Правила решения задач по закону сохранения массы веществ в химических реакциях. Определение относительной атомной массы неизвестного химического элемента.
Задача 3. Определите относительную атомную массу металла, если 4,6 г одновалентного металла, вступая в реакцию с водородом, образует 4,8 г гидрида этого металла.
Решение: 4,8—4,6=0,2 г 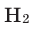 вступает в реакцию.
вступает в реакцию.

IV. Правило вычисления теплового эффекта по теплоте образования.
Тепловой эффект химической реакции равен разнице между суммой теплоты образования продуктов реакции и суммой теплоты образования исходных веществ.
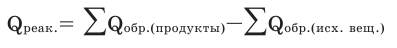
Задача 4. Вычислите тепловой эффект реакции 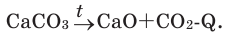
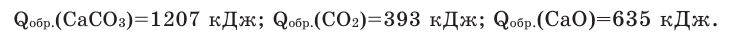
Решение: 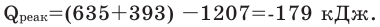
V. Закон Гесса и решение задач по данному закону.
Тепловой эффект реакции зависит не от путей протекания и количества этапов реакции, а только от природы и физического состояния вступающих в реакцию и получаемых в результате реакции веществ. Т.е. тепловой эффект общей реакции равен сумме тепловых эффектов её этапов.
Задача 5. I этап: 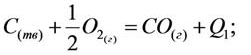
Общая реакция 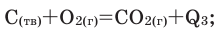 Вычислите
Вычислите 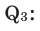 Решение:
Решение: 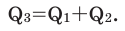
VI. Вычисление выхода продукта

Здесь 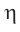 называется - эта, а
называется - эта, а 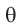 - тета.
- тета.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |