
Белки в химии - свойства, формула, получение, номенклатура и определение с примерами
Содержание:
Белки:
Белки входят в состав всех живых организмов и выполняют важнейшие функции в обеспечении жизнедеятельности всего живого на Земле.
Белки содержатся в ядре и протоплазме всех растительных и животных клеток. Они составляют основу костной и соединительных тканей человека и животных, а также основу шерсти, роговых образований. Белки есть в коже, крови, нервных тканях. Содержание белков в пересчете на сухое вещество в растительных организмах достигает в среднем 15 %, а в животных — 50 %.
В основе важнейших процессов жизнедеятельности живого организма лежит функционирование белков. Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген), двигательные (миозин), транспортные (гемоглобин), защитные (интерферон), запасные (казеин) и др. Среди белков встречаются антибиотики и вещества, оказывающие токсическое действие.
Строение белков
Белки — это природные высокомолекулярные соединения, полипептиды, построенные из остатков 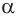
Практически все белки построены из 20 видов 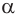
В белковых молекулах остатки аминокислот связаны пептидной связью 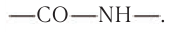
В начале XX в. немецкий химик Э. Фишер доказал, что белки построены из остатков 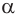 -аминокислот, связанных пептидной связью.
-аминокислот, связанных пептидной связью.
Белковая молекула может содержать от одной до нескольких сотен, а иногда и более тысячи аминокислотных остатков, поэтому относительные молекулярные массы белков могут составлять от нескольких десятков тысяч до десятков миллионов.
Молекулы многих белков имеют не только значительные относительные молекулярные массы, но и большие размеры (табл. 36).
Таблица 36. Относительные молекулярные массы и размеры молекул некоторых белков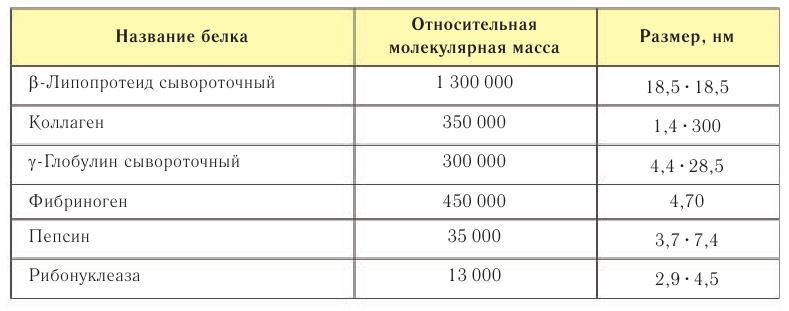
Различают три уровня организации белковых молекул — первичную, вторичную, третичную структуры.
Каждый индивидуальный белок имеет свою строгую последовательность аминокислотных остатков. Последовательность аминокислотных остатков в линейной полипептидной цепи называют первичной структурой молекулы белка. Такая структура определяет порядок повторяемости аминокислотных остатков и выражает химическое строение белков, например:
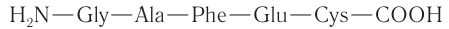
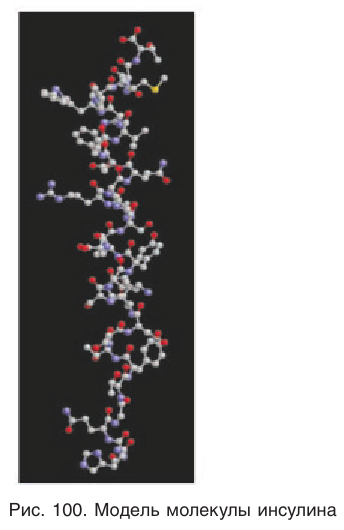
Возможности образования различных первичных структур неисчислимы. В организме человека большинство белков содержит сотни аминокислотных остатков. В настоящее время расшифрована первичная структура значительного числа белков, в том числе и очень сложного строения (рис. 100), содержащих 1400 и более аминокислотных остатков. Первый белок, у которого была расшифрована первичная структура (1955), — инсулин, гормон, регулирующий содержание глюкозы в крови. Инсулин содержит всего 51 аминокислотный остаток, но на установление его структуры потребовалось почти десять лет.
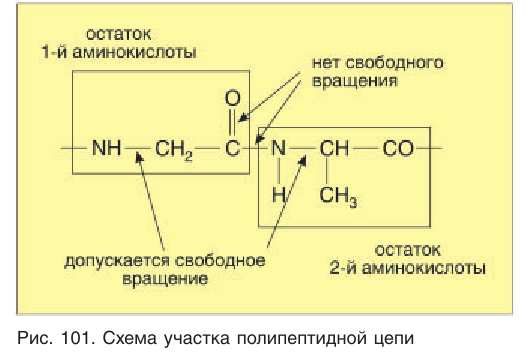
Полипептидная цепь обычно свернута в спираль. Несмотря на плоскую жесткую структуру пептидной связи, в полипептидной цепи имеются места, допускающие свободное вращение вокруг одинарных связей (рис. 101). Благодаря этому в результате изгибания и сворачивания полипептидной цепи возможно взаимодействие между ее отдельными участками. Это взаимодействие приводит к образованию водородных связей между группами 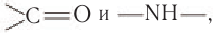 которые регулярно чередуются вдоль оси спирали. Водородные связи между этими группами способствуют образованию регулярной спиралевидной структуры, которая и называется вторичной структурой белковой молекулы (рис. 102). В одном витке
которые регулярно чередуются вдоль оси спирали. Водородные связи между этими группами способствуют образованию регулярной спиралевидной структуры, которая и называется вторичной структурой белковой молекулы (рис. 102). В одном витке 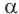 -спирали укладывается четыре аминокислотных остатка.
-спирали укладывается четыре аминокислотных остатка.

Лайнус Карл Полинг
(1901—1994)
Американский химик. Один из авторов модели альфа-спирали молекулы белка. Нобелевский лауреат (1954) за исследование природы химической связи. Нобелевский лауреат премии Мира (1962) за вклад в борьбу против атмосферных испытаний ядерного оружия.
В расшифровке вторичной структуры белков принимали участие многие выдающиеся ученые различных стран. В середине XX в. было доказано существование в белке вторичной структуры, в том числе 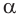 -спирали, предсказанной Л. Полингом, который за исследование природы химической связи в 1954 г. получил Нобелевскую премию.
-спирали, предсказанной Л. Полингом, который за исследование природы химической связи в 1954 г. получил Нобелевскую премию.
В процессе закручивания полипептидной цепи в спираль функциональные группы 
 могут строго определенным способом взаимодействовать между собой с образованием дисульфидных
могут строго определенным способом взаимодействовать между собой с образованием дисульфидных
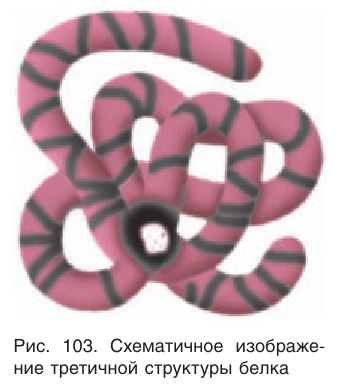
 сложноэфирных и других мостиков. Кроме того, между карбонильными и аминогруппами, а также с участием обеих групп и молекул воды возникают водородные связи. В результате этого спираль как бы изгибается, происходит стабилизация структуры, напоминающей по форме клубок. Такая структура называется третичной (рис. 103), именно она обусловливает специфическую биологическую активность белковой молекулы.
сложноэфирных и других мостиков. Кроме того, между карбонильными и аминогруппами, а также с участием обеих групп и молекул воды возникают водородные связи. В результате этого спираль как бы изгибается, происходит стабилизация структуры, напоминающей по форме клубок. Такая структура называется третичной (рис. 103), именно она обусловливает специфическую биологическую активность белковой молекулы.
Белки — природные высокомолекулярные полипептиды, построенные из остатков  -аминокислот, соединенных пептидной связью.
-аминокислот, соединенных пептидной связью.
Каждый индивидуальный белок характеризуется специфической последовательностью остатков 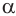 -аминокислот и индивидуальной пространственной структурой.
-аминокислот и индивидуальной пространственной структурой.
Различают первичную, вторичную, третичную структуры белков.
Свойства белков
Физические свойства: Различают белки твердые, жидкие, полужидкие (студнеобразные). Твердые белки нерастворимы в воде и солевых растворах. Жидкие и полужидкие белки растворяются в воде и солевых растворах. Растворимость белков также связана с их молекулярной массой и строением. Белки, имеющие небольшую массу, растворяются в воде лучше. Примером может быть белок альбумин, содержащийся в яичном белке.
Белки принято подразделять по их растворимости на глобулярные (от лат. globulus — шарик) — растворимые в воде или образующие в ней коллоидные растворы, например такие белки, как гемоглобин, ферменты, многие гормоны, и фибриллярные (от лат. fibrilla— волоконце, ниточка)— нерастворимые вводе, например такие белки, как коллагены (белки, содержащиеся в коже и соединительных тканях), эластины (белки, содержащиеся в легких, артериях), кератины (белки, содержащиеся в волосах, ногтях).
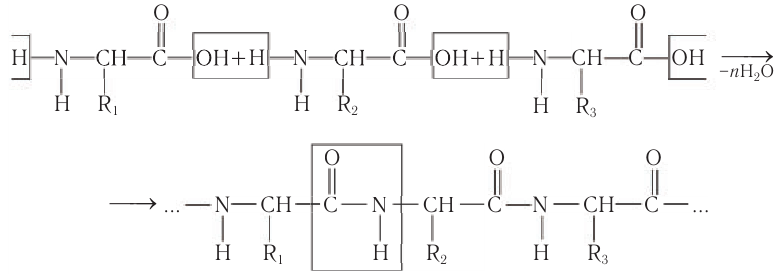
Химические свойства: 1) Важное свойство белка — способность подвергаться гидролизу. Ферментативный, кислотный или щелочной гидролиз белков проходит последовательно с образованием полипептидов и затем пептидов все меньшей молярной массы, а далее аминокислот, из которых построен индивидуальный белок. Рассмотрим для примера схему гидролиза участка молекулы белка:
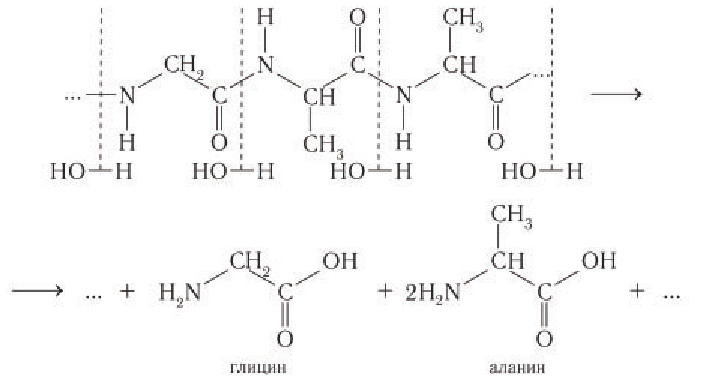
В процессе гидролиза разрушаются все пептидные связи белковых молекул. Это процесс, обратный процессу синтеза белков. Белки пищи в желудке и кишечнике подвергаются гидролизу до аминокислот под действием ферментов.
2) При действии сильных кислот, щелочей, солей тяжелых металлов, радиации и нагревании происходит разрушение пространственной структуры белка с сохранением его первичной структуры, т.е. без разрыва пептидных связей. Это явление называют денатурацией (слово «денатурация» происходит от лат. denature, de — отделение и nature — природа). Один из примеров денатурации белка известен практически каждому человеку. Это пример «свертывания» яичных белков при варке яиц (рис. 104). В процессе денатурации белок теряет свойственные ему качества. Денатурация белка, как правило, процесс необратимый.

3) При сильном нагревании может происходить не только денатурация, но и разложение молекул белка с образованием летучих веществ, обладающих специфическим запахом.
Белки горят с образованием азота, углекислого газа, воды, а также некоторых других веществ. Горение белков сопровождается характерным запахом жженых перьев. Если сжигать шерстяные или шелковые нити, то на конце нити образуется шарик черного цвета, который легко растирается в порошок.
4) Белки дают ряд цветных реакций, обусловленных наличием в их составе определенных аминокислотных остатков или химических группировок 
 К важнейшим цветным реакциям относится универсальная биуретовая реакция. Если к раствору любого белка в щелочной среде прилить раствор соли двухвалентной меди, то наблюдается сине-фиолетовое окрашивание, указывающее на наличие в белках пептидных связей (рис. 105, а).
К важнейшим цветным реакциям относится универсальная биуретовая реакция. Если к раствору любого белка в щелочной среде прилить раствор соли двухвалентной меди, то наблюдается сине-фиолетовое окрашивание, указывающее на наличие в белках пептидных связей (рис. 105, а).

Биуретовая реакция может использоваться не только для качественного обнаружения белков в растворе, но также для определения концентрации белков.
Существует также несколько специфических цветных реакций, указывающих на наличие в составе остатков аминокислот белка конкретных группировок атомов. Так, если раствор белка обработать концентрированной азотной кислотой, то появится желтая окраска. Эта реакция доказывает наличие бензольных колец в остатках аминокислот и называется ксантопротеиновой (от греч. ксантос — желтый) (рис. 105, б).
Роль белков как питательных веществ: В организме человека содержатся тысячи различных индивидуальных белков, которые синтезируются в организме и отличаются по структуре от белков, поступающих с пищевыми продуктами. Основой для синтеза индивидуальных белков являются те аминокислоты, из остатков которых состоят белки пищи.
Под влиянием ферментов, содержащихся в желудке и кишечнике, белки пищи подвергаются гидролизу. Конечным результатом гидролиза являются аминокислоты. Эти аминокислоты через лимфу поступают в кровь, которая доставляет их во все ткани и клетки организма. Некоторые аминокислоты, необходимые человеку для синтеза собственных белков и не содержащиеся в пищевых продуктах, могут синтезироваться из других, близких по строению, аминокислот. Но существует десять аминокислот, которые организм человека не может синтезировать из других, поэтому они должны обязательно поступать с белком пищи. Такие кислоты получили название незаменимые. К ним относятся фенилаланин, треонин, лизин, валин, метионин, лейцин, изолейцин, триптофан, гистидин и аргинин.
Большая часть аминокислот расходуется на синтез собственных белков человека, который происходит с поглощением энергии под действием специфических ферментов. Часть аминокислот подвергается постепенному распаду и окислению. Эти процессы идут с выделением энергии.
Различают белки твердые, жидкие, полужидкие.
Белки подвергаются гидролизу, денатурации; им свойственны цветные реакции, по которым можно качественно различать белки.
Белковая пища должна обязательно входить в ежедневный рацион питания человека, так как продукты ее гидролиза — аминокислоты — являются основой синтеза индивидуальных специфических белков человека.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |