
Ароматические углеводороды в химии - основные понятия, формулы, определения и примеры
Содержание:
Бензол:
Строение и свойства ароматических углеводородов рассмотрим на примере простейшего представителя, которым является бензол.
Строение бензола
Молекулярная формула бензола 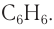
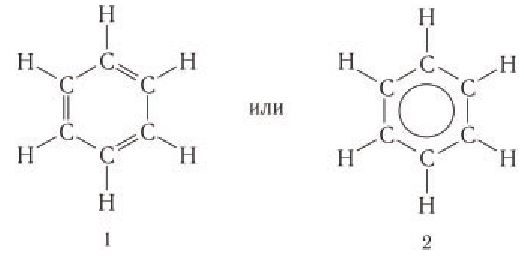
Существование двух структурных формул бензола имеет свое экспериментальное объяснение. Структурная формула 1 была впервые предложена немецким ученым Ф. Кекуле.

Фридрих Август Кекуле
(1829—1896)
Немецкий химик. Впервые предложил циклическую формулу бензола. Один из создателей теории химического строения органических соединений.
Запись формулы 1 подтверждают следующие экспериментальные данные по изучению пространственного строения: все атомы углерода и водорода в молекуле бензола лежат в одной плоскости с валентными углами связей, равными 120°, как у алкенов; для гидрирования бензола химическим количеством 1 моль до циклогексана требуется водород химическим количеством 3 моль — как будто бы имеется три двойные связи.
Как видно из записи структурной формулы 1, двойные связи в молекуле бензола чередуются с одинарными связями. Вы уже знаете, что такое чередование двойных и одинарных связей называется сопряжением. Такое чередование связей в молекуле бутадиена-1,3 приводит к образованию единого электронного облака, которое охватывает четыре атома углерода. В случае бензола — это единое электронное облако, охватывающее все шесть атомов углерода.
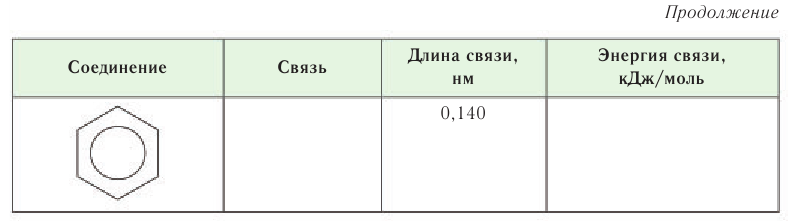
Экспериментальные данные по определению длин связей в молекуле бензола (табл. 18) свидетельствуют о том, что в ней нет двойных и одинарных связей. Длины всех  -связей в молекуле бензола одинаковы и равны 0,140 нм, что длиннее двойной и короче одинарной связи. Эти факты позволяют для бензола использовать формулу 2.
-связей в молекуле бензола одинаковы и равны 0,140 нм, что длиннее двойной и короче одинарной связи. Эти факты позволяют для бензола использовать формулу 2.
В дальнейшем будет использоваться сокращенная структурная формула бензола:
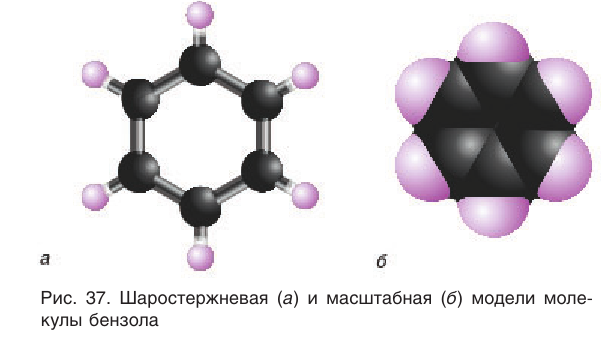
Шаростержневая и масштабная модели молекулы бензола представлены на рисунке 37.
Физические свойства бензола
Бензол представляет собой бесцветную жидкость с характерным запахом, которая легко кристаллизуется при охлаждении (т. пл. 5,5 °С) и кипит при 80,1 °С. Бензол относится к чрезвычайно токсичным соединениям, вдыхание его паров в течение длительного периода времени может привести к серьезным заболеваниям крови. Опасно не только вдыхание паров, но и проникновение жидкого вещества через кожу. Первыми признаками отравления являются головокружение и головная боль.
Химические свойства бензола
Реакции замещения. Все реакции замещения у бензола происходят таким образом, что атомы водорода молекулы бензола замещаются на частицы, имеющие положительный заряд.
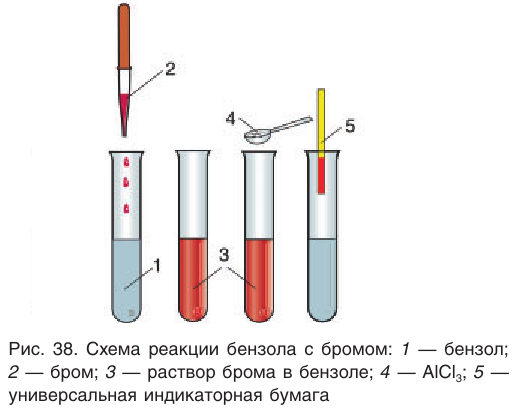
1) Галогенирование. При обработке бензола раствором брома в тетрахлорметане в обычных условиях никакой реакции не наблюдается, однако в присутствии катализаторов 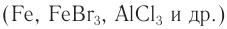 бензол вступает в реакцию замещения. Роль катализатора заключается в поляризации молекулы галогена с образованием комплекса
бензол вступает в реакцию замещения. Роль катализатора заключается в поляризации молекулы галогена с образованием комплекса 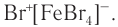 Например, бензол в присутствии любого из указанных катализаторов реагирует с бромом (рис. 38) или хлором даже при комнатной температуре:
Например, бензол в присутствии любого из указанных катализаторов реагирует с бромом (рис. 38) или хлором даже при комнатной температуре:
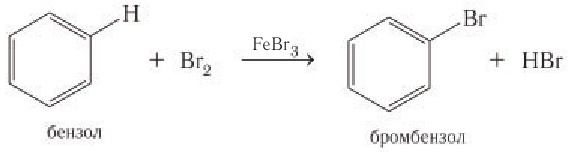
Как видно из уравнения бромирования, при таком соотношении реагентов любой один атом водорода в молекуле бензола замещается на атом брома.
2) Нитрование. Другим примером реакции замещения является взаимодействие бензола с азотной кислотой, роль катализатора в которой играет серная кислота:
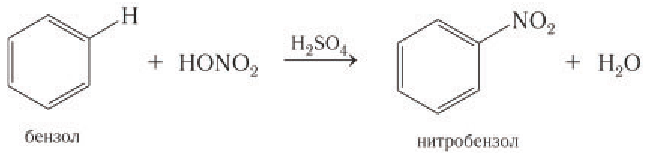
В обоих случаях — при галогенировании и нитровании — наблюдается сохранение ароматической структуры молекулы бензола.
Реакции присоединения. В жестких условиях бензол может вступать в реакции присоединения с потерей ароматической структуры. Например, в присутствии никеля и при нагревании бензол присоединяет водород с образованием циклогексана:
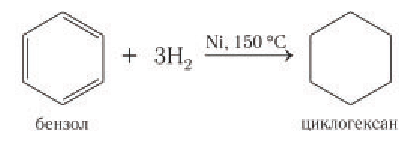
Окисление бензола
Бензол не реагирует с раствором перманганата калия или других окислителей, разрыв кольца происходит лишь в жестких условиях.
Бензол горит на воздухе с образованием коптящего пламени:
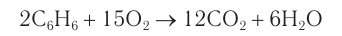
Все атомы молекулы бензола лежат в одной плоскости, и длины всех  -связей равны между собой.
-связей равны между собой.
Характерными свойствами бензола являются реакции замещения. В жестких условиях бензол может подвергаться реакциям присоединения.
Получение и применение ароматических соединений
Получение в промышленности:
Самый первый способ получения бензола в промышленности основан на перегонке каменноугольной смолы, образующейся при коксовании угля.
Бензол и его гомологи в основном получают при термических и каталитических превращениях (ароматизации) некоторых продуктов перегонки нефти. Упрощенная схема получения бензола из гексана:
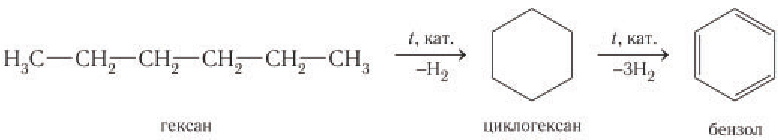
Из гомологов бензола наиболее известны метилбензол (толуол) и этилбензол. Этилбензол используют главным образом для получения стирола, который в результате радикальной полимеризации превращают в полистирол:
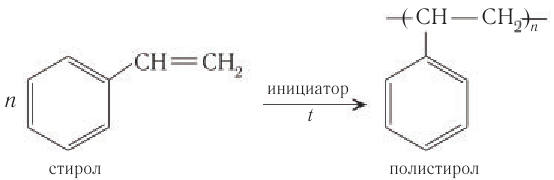
Полистирол идет на производство игрушек, предметов домашнего обихода и перерабатывается в пенополистирол, который применяют как упаковочный и термоизоляционный материал.
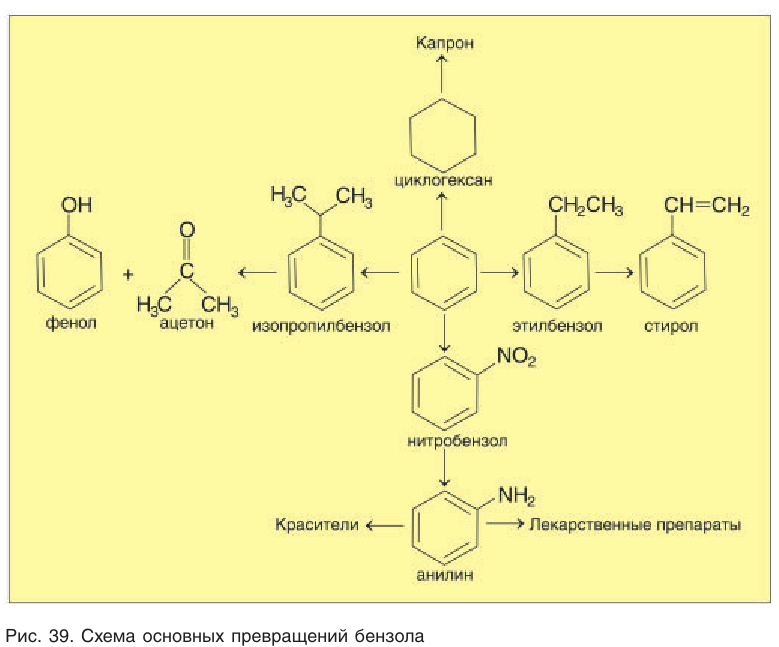
Многочисленные производные бензола широко используются в качестве растворителей и полупродуктов для различных отраслей химической промышленности. Основные превращения бензола и его производных показаны на рисунке 39.
Взаимные превращения представителей различных классов углеводородов:
На рисунке 39 даны превращения органических соединений в пределах одного класса — ароматических соединений. Возможность таких превращений основана на знании химических свойств органических соединений и необходима химикам для того, чтобы синтезировать нужные вещества.
Рассматривая химические свойства углеводородов, вы уже неоднократно убеждались, что вещества одних классов можно получать из веществ других классов.
Например, бензол можно получить пропусканием ацетилена через нагретый активированный уголь:
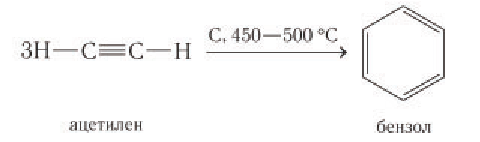
При высокой температуре и в присутствии никелевого катализатора бензол химическим количеством 1 моль может присоединять водород химическим количеством 3 моль с образованием циклогексана:
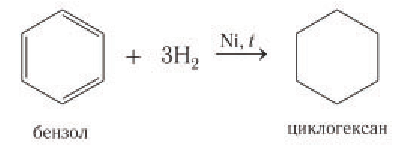
Наиболее доступным и дешевым сырьем являются алканы и арены, так как их получают при переработке нефти. Представителей других классов углеводородов синтезируют промышленной переработкой алканов и аренов.
Все превращения углеводородов, показанные в таблице 19, основаны на реакциях гидрирования-дегидрирования и циклизации. Эти схемы иллюстрируют реакции, происходящие в промышленных органических синтезах, осуществляемых на основе переработки нефти.

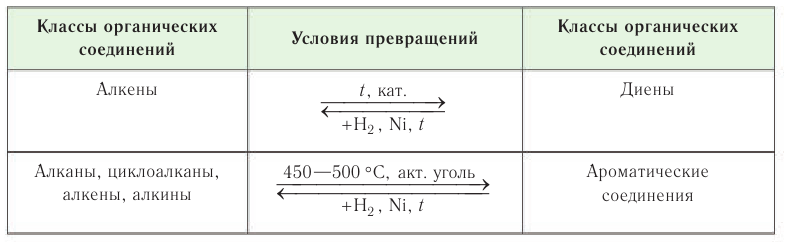
Ароматические соединения получают при термической и каталитической ароматизации некоторых продуктов перегонки нефти.
Ароматические соединения широко применяются в качестве исходных веществ для получения пластмасс, волокон, красителей, взрывчатых веществ и других продуктов, а также как растворители.
Углеводороды в природе и переработка нефти
Основными источниками углеводородов являются природный газ, нефть и каменный уголь.
Природный газ в основном состоит из метана и небольших примесей этана, пропана и изомерных бутанов. Значительно больше гомологов метана находится в попутных нефтяных газах.
Нефть представляет собой в основном смесь насыщенных и циклических углеводородов, содержащих в составе молекул 50 и более атомов углерода.
Первый этап переработки нефти заключается в ее перегонке. Вам уже известно, что существует определенная закономерность: чем больше относительная молекулярная масса углеводорода, тем выше его температура кипения. Поэтому нефть перегонкой разделяют на отдельные части, или фракции — смеси различных веществ, имеющих близкие температуры кипения. Фракции различаются составом и интервалом температур перегонки. Приблизительный состав фракций и их температуры кипения приведены в таблице 20.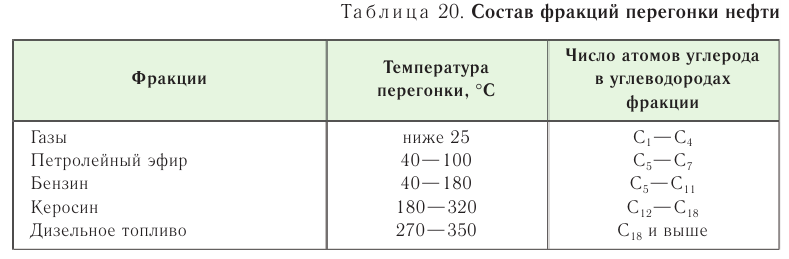
Петролейный эфир применяют в качестве растворителя. Керосин используется как топливо для авиационных двигателей, газойль — топливо для дизельных двигателей (автомобили и трактора).
Для более эффективного использования нефти производят переработку фракций нефти, которая заключается в расщеплении (крекинге) углеводородов с большой относительной молекулярной массой на углеводороды с низкой относительной молекулярной массой. Различают крекинг термический и каталитический.
Термический крекинг фракций нефти проводится при температурах 450— 550 °С и применяется для получения легких нефтяных фракций, а при температурах выше 750° — для получения алкенов.
Рассмотрим этот процесс на примере расщепления углеводорода с 6 атомами углерода:
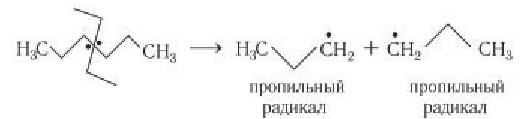
Химическая связь  осуществляется парой электронов, и при высокой температуре происходит ее разрыв с образованием радикалов. Радикалы являются чрезвычайно реакционноспособными, поэтому существуют короткое время. Дальнейшие реакции алкильных радикалов могут привести к образованию алкана и алкена:
осуществляется парой электронов, и при высокой температуре происходит ее разрыв с образованием радикалов. Радикалы являются чрезвычайно реакционноспособными, поэтому существуют короткое время. Дальнейшие реакции алкильных радикалов могут привести к образованию алкана и алкена:
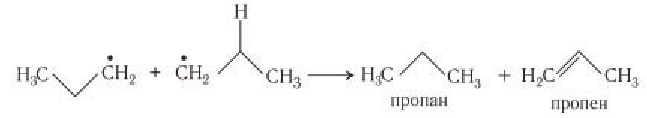
Расщепление может происходить по любой  -связи углеводорода, поэтому при крекинге фракций нефти образуются смеси углеводородов.
-связи углеводорода, поэтому при крекинге фракций нефти образуются смеси углеводородов.
Углеводородные фракции, образующиеся при термическом крекинге, имеют небольшое октановое число.
В современных автомобильных двигателях происходит сильное сжатие (компрессия) воздушно-бензиновой смеси, при котором горючая смесь нагревается, и чем сильнее сжатие, тем выше температура. Этот фактор, а также образование органических пероксидов (ROOR) в смеси приводят к тому, что спокойное горение смеси в цилиндрах заменяется на взрывное (детонация), что сильно уменьшает мощность двигателя. Антидетонационная стойкость углеводородов зависит от их строения и определяется октановым числом. Чем выше октановое число (80, 92, 95 и 98), тем лучшими антидетонационными свойствами обладает бензин. Например, октановое число бензина 92 говорит о том, что данный бензин работает в двигателе так же, как экспериментальная смесь углеводородов, содержащая 92 % изооктана.
Октановые числа некоторых углеводородов приведены в таблице 21.
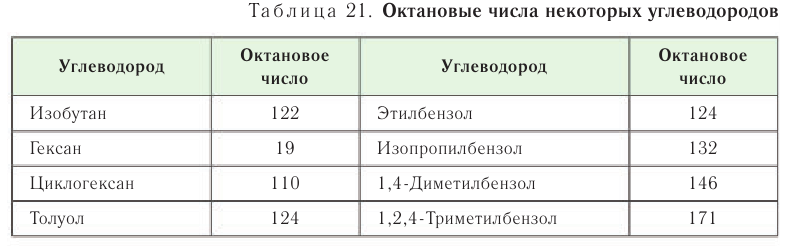
Из данных, приведенных в таблице, видно, что высокие октановые числа характерны для углеводородов с разветвленным углеродным скелетом.
Ранее для повышения октанового числа топлива применяли чрезвычайно ядовитый тетраэтилсвинец 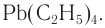
Каталитический крекинг в присутствии катализаторов является основным процессом получения алканов 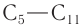 с разветвленным углеродным скелетом, которые обладают высокими октановыми числами. Например, превращение бутана:
с разветвленным углеродным скелетом, которые обладают высокими октановыми числами. Например, превращение бутана:
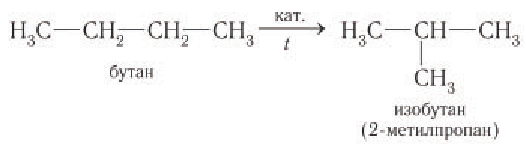
Около 95 % добываемой нефти перерабатывается на бензин и другие виды топлива (рис. 40). Лишь небольшая часть нефти используется как сырье для химической промышленности.
Загрязнение окружающей среды нефтью и продуктами ее переработки:
Загрязнение окружающей среды нефтью при ее транспортировке уже не раз приводило к экологическим катастрофам (рис. 41). Особенно опасно появление нефти и нефтепродуктов в реках, озерах и морях, что может привести не только к гибели живых организмов, но и к попаданию нефтепродуктов в питьевую воду.
При сгорании бензина и других видов топлива образуются отработанные газы, содержащие, кроме оксида углерода(IV) и воды, опасные для здоровья человека вещества, такие как оксид углерода(II) и оксиды азота. Во многих странах для уменьшения их токсичности в автомобилях применяют катализаторы, содержащие платину, с помощью которых происходит каталитическое окисление несгоревших углеводородов, оксида углерода(II) и оксидов азота до 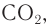
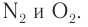
Другим побочным эффектом использования двигателей внутреннего сгорания является выделение большого количества оксида углерода( IV). Чрезмерное употребление природного газа и нефтепродуктов для отопления и других нужд также приводит к выделению большого количества 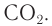
Вероятно, оксид углерода(IV), метан и галогеналканы, попадая в атмосферу, приводят к так называемому парниковому эффекту, т. е. повышению температуры нашей планеты.
Переработка фракций нефти заключается в термических и каталитических процессах изомеризации и расщепления (крекинга) углеводородов с большой относительной молекулярной массой на углеводороды с низкой относительной молекулярной массой.
В результате каталитического крекинга получают алканы с разветвленным углеродным скелетом, обладающие высокими октановыми числами.
Решение расчетных задач
Рассмотрим примеры решения задач на определение молекулярной формулы углеводородов.
Пример 1.
Определите молекулярную формулу алкана, относительная молекулярная масса которого равна 58, и назовите его.
Решение
1. Общая формула алканов 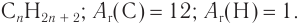
2. Следовательно, 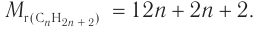
Составляем уравнение: 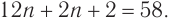 Решая его, получим:
Решая его, получим: 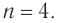
Формула алкана — 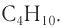
Ответ: 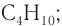 бутан.
бутан.
Пример 2.
Определите молекулярную формулу алкана, массовая доля углерода в котором равна 0,833.
Решение
1. Общие формулы, используемые при решении задачи:
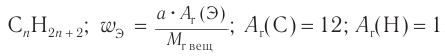
2. Следовательно, 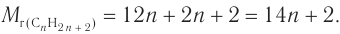 Составляем уравнение:
Составляем уравнение:
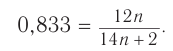
Решая его, получим: 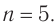
Формула алкана — 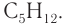
Ответ: 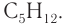
Пример 3.
Определите молекулярную формулу газообразного алкина, плотность которого равна 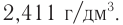
Решение
1. Общие формулы, используемые при решении задачи:
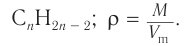
2. Значение молярного объема и молярных масс:
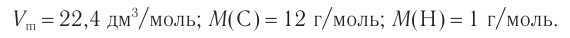
3. Определяем молярную массу алкина и далее его молекулярную формулу:
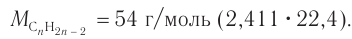
Составляем уравнение: 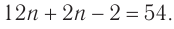 Решая его, получим:
Решая его, получим: 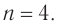 Формула алкина —
Формула алкина — 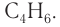
Ответ: 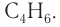
Пример 4.
Определите молекулярную формулу газообразного алифатического углеводорода, плотность которого равна 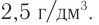
Решение
1. Общие формулы, используемые при решении задачи:
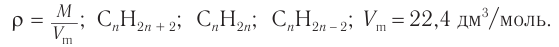
2. Определяем молярную массу углеводорода и далее, исследуя общие формулы углеводородов, — его формулу.
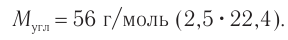
а) Если углеводород относится к алканам, то при 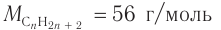 ,
,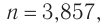 что не соответствует решению.
что не соответствует решению.
б) Если углеводород относится к алкинам, то при 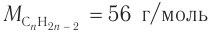
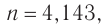 что не соответствует решению.
что не соответствует решению.
в) Если углеводород относится к алкенам, то при 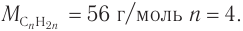
Следовательно, углеводород — алкен, формула которого 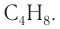
Ответ: 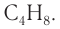 .
.
Пример 5.
При сжигании неизвестного алкина химическим количеством 0,05 моль затратили кислород объемом (н. у.) 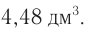 Определите молекулярную формулу углеводорода.
Определите молекулярную формулу углеводорода.
Решение
1. Общие формулы, используемые при решении задачи:
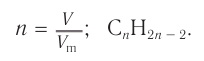
2. Значение молярного объема:
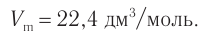
3. Определяем химическое количество кислорода и далее на основе анализа уравнения горения углеводорода определяем его формулу.
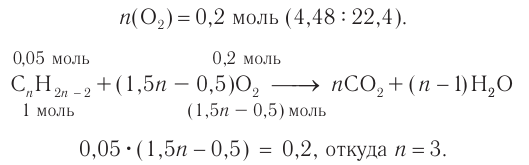
Формула алкина — 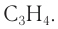
Ответ: 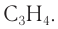
Пример 6.
При сгорании неизвестного углеводорода массой 11,76 г получили оксид углерода(IV) объемом (н. у.) 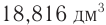 и воду массой 15,12 г. Относительная плотность паров углеводорода по воздуху равна 2,896. Определите молекулярную формулу углеводорода.
и воду массой 15,12 г. Относительная плотность паров углеводорода по воздуху равна 2,896. Определите молекулярную формулу углеводорода.
Решение
1. Общие формулы, используемые при решении задачи: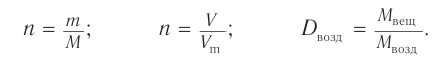
2. Значения молярных масс, молярного объема:
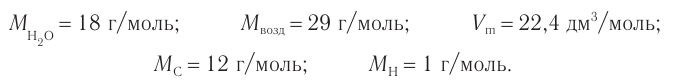
3. Определяем молярную массу неизвестного углеводорода, его химическое количество и химические количества углекислого газа и воды:
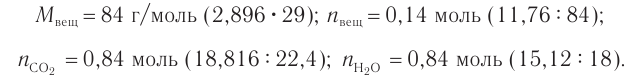
4. Проанализируем схему процесса сгорания углеводорода и определим химические количества полученных продуктов реакции в расчете на вещество химическим количеством 1 моль. Далее определим химические количества углерода и водорода в составе неизвестного углеводорода:
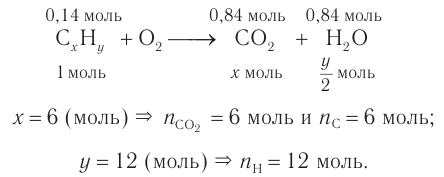
Следовательно, молекулярная формула углеводорода — 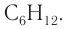
Ответ: 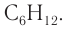
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |