
Амины в химии - свойства, формула, получение, номенклатура и определение с примерами
Содержание:
Амины:
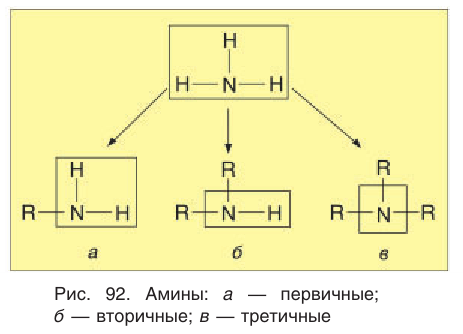
Аминами называют органические производные аммиака, в молекулах которого один или несколько атомов водорода замещены на углеводородный заместитель.
При замещении одного атома водорода образуются первичные амины, двух — вторичные, трех — третичные (рис. 92).
Первичные амины можно рассматривать как производные углеводородов, в молекулах которых атом водорода замещен на функциональную группу 
Общая формула первичных насыщенных аминов 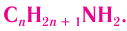
Строение аминов
Рассмотрим электронное строение функциональной аминогруппы. Атом азота в молекулах аминов, как и в молекулах аммиака, имеет тетраэдрическую ориентацию орбиталей, поэтому валентный угол близок к тетраэдрическому. Молекулы аминов по форме напоминают тригональную пирамиду. Связи 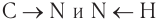 поляризованы, так как атом азота обладает большей электроотрицательностью, чем атомы углерода и водорода. Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары:
поляризованы, так как атом азота обладает большей электроотрицательностью, чем атомы углерода и водорода. Основной отличительной чертой электронного строения аминов является наличие у атома азота, входящего в функциональную группу, неподеленной электронной пары:

Номенклатура. Названия первичных алифатических насыщенных аминов по номенклатуре ИЮПАК составляют, взяв за основу названия исходных углеводородов и прибавляя слово -амин. Например,  — метанамин (метиламин),
— метанамин (метиламин), 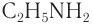 — этанамин (этиламин). Метанамин и этанамин — гомологи.
— этанамин (этиламин). Метанамин и этанамин — гомологи.
Шаростержневая модель молекулы простейшего амина — метиламина — представлена на рисунке 93, а.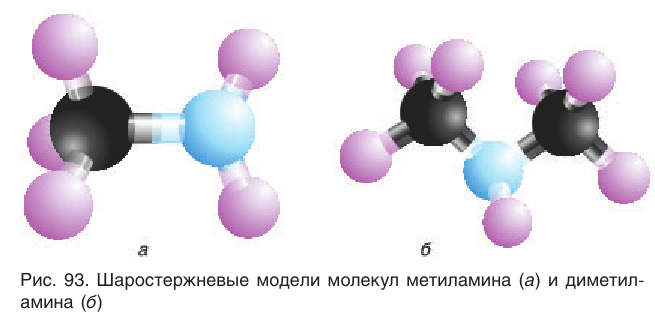
Вторичные амины в соответствии с правилами номенклатуры ИЮПАК называют, указывая наличие атома азота символом N, далее после дефиса перечисляют углеводородные заместители в алфавитном порядке и добавляют слово -амин. Например:  -метилэтанамин.
-метилэтанамин.
Изомерия аминов
Для первичных насыщенных аминов характерна структурная изомерия, которая обусловлена изомерией углеродного скелета и изомерией положения функциональной группы. Например, изомерия углеродного екелета представлена изомерами:
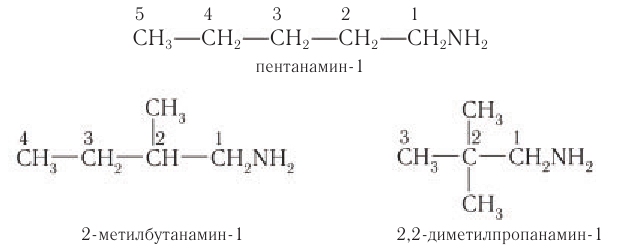
Для названия первичных аминов с разветвленной углеродной цепью выбирают самую длинную цепь, содержащую функциональную группу, и нумеруют с того конца, к которому ближе расположена аминогруппа. Названия заместителей, если они различные, перечисляют в алфавитном порядке с указанием номера атома углерода, с которым они связаны.
Изомерия положения функциональной группы:

При названии первичных аминов с неразветвленной углеродной цепью цифрой указывается атом углерода, с которым связана аминогруппа. Нумерация углеродных атомов начинается с того конца, ближе к которому расположена аминогруппа.
Первичные, вторичные и третичные амины с одинаковым числом атомов углерода изомерны друг другу. Например, этиламин 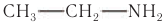 изомерен диметиламину. Шаростержневая модель молекулы диметиламина приведена на рисунке 93, б.
изомерен диметиламину. Шаростержневая модель молекулы диметиламина приведена на рисунке 93, б.
Амины широко распространены в природе. Многие биологически активные вещества относятся к классу аминов. Некоторые амины образуются в живых организмах, их принято называть биогенными аминами.
Например, в картофеле, яичном желтке, грибах содержится в свободном виде биогенный амин — холин, образующийся в организме в результате обмена веществ. Холин оказывает на организм человека лечебное действие — способствует понижению кровяного давления. В организме человека почти во всех тканях обнаруживается биогенный амин — гистамин, который усиленно выделяется при некоторых аллергических состояниях и вызывает целый ряд болезненных симптомов. Лечение аллергии основано на приеме лекарств, подавляющих влияние гистамина. Такие препараты называют антигистаминными, их синтезируют на основе аминов.
Органические производные аммиака, в молекулах которого один или несколько атомов водорода замещены на углеводородный заместитель, называют аминами.
Общая формула первичных насыщенных аминов 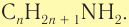 Для первичных насыщенных аминов характерна структурная изомерия (изомерия углеродного скелета и положения функциональной группы).
Для первичных насыщенных аминов характерна структурная изомерия (изомерия углеродного скелета и положения функциональной группы).
К первичным аминам относятся производные углеводородов (насыщенных и ароматических), в молекулах которых атом водорода замещен на функциональную аминогруппу —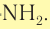
Физические и химические свойства аминов. Получение аминов
Алифатические насыщенные амины:
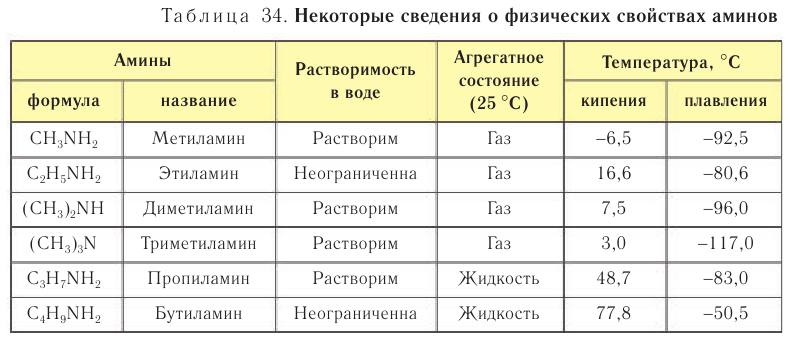
Физические свойства. Простейшие представители насыщенных аминов — метиламин, этиламин, диметиламин и триметиламин — газообразные вещества при обычных условиях. Средние члены гомологического ряда аминов — жидкости, высшие — твердые вещества. Некоторые сведения о физических свойствах аминов приведены в таблице 34.
Как вы знаете, амины являются полярными соединениями в силу того, что связь 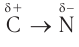 поляризована. По этой причине первичные и вторичные амины ассоциируются в результате образования межмолекулярных водородных связей:
поляризована. По этой причине первичные и вторичные амины ассоциируются в результате образования межмолекулярных водородных связей:
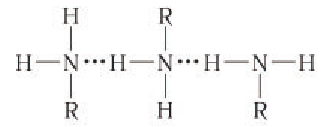
Благодаря сильному межмолекулярному взаимодействию низшие амины хорошо растворимы в воде, по мере увеличения числа атомов углерода растворимость в воде уменьшается. Высшие амины в воде не растворимы. Амины растворяются в органических растворителях.
Низшие амины обладают неприятным запахом. Запах метиламина и этиламина напоминает аммиак. Триметиламин присутствует в селедочном рассоле. Впервые триметиламин выделили из продуктов перегонки селедочного рассола в середине XIX в., и он получил название «рыбный газ». Высшие амины в основном запаха не имеют.
Химические свойства: Амины, являясь производными аммиака, как и аммиак, проявляют ярко выраженные основные свойства, что обусловлено наличием неподеленной электронной пары у атома азота функциональной аминогруппы 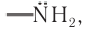 способной к образованию химической связи по донорно-акцепторному механизму. Именно наличие неподеленной электронной пары у атома азота обусловливает свойства аминов как органических оснований в реакциях с водой, минеральными и органическими кислотами.
способной к образованию химической связи по донорно-акцепторному механизму. Именно наличие неподеленной электронной пары у атома азота обусловливает свойства аминов как органических оснований в реакциях с водой, минеральными и органическими кислотами.
Амины являются самыми сильными органическими основаниями.
1) При растворении в воде молекулы алкиламинов связывают протоны за счет неподеленной электронной пары атома азота, при этом в растворе возрастает концентрация ионов 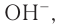 так как устанавливается равновесие системы:
так как устанавливается равновесие системы:
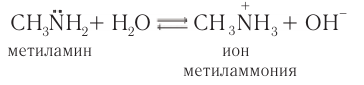
Водные растворы аминов окрашивают фенолфталеин в малиновый цвет, что свидетельствует об образовании гидроксид-ионов.
2) При взаимодействии с минеральными кислотами амины превращаются в аммониевые соли, которые являются достаточно устойчивыми и могут быть выделены как индивидуальные вещества:
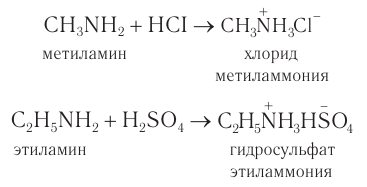
В реакциях с кислотами амины выступают в качестве органических оснований. При этом основные свойства аминов выражены сильнее, чем у аммиака.
Под действием щелочи алкиламмониевые соли разрушаются с образованием свободных аминов:
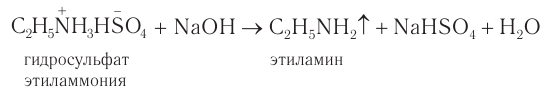
3) Газообразные алифатические амины горят на воздухе с образованием азота, углекислого газа и воды:
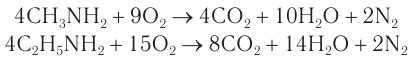
Ароматические амины: Ароматическими называют амины, у которых аминогруппа связана непосредственно с атомом углерода бензольного кольца.
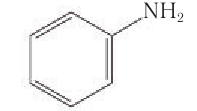
Анилин (фениламин) 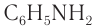 — простейший ароматический амин. Структурная формула анилина:
— простейший ароматический амин. Структурная формула анилина:
Название «анилин» для 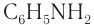 принято по рекомендации ИЮПАК.
принято по рекомендации ИЮПАК.
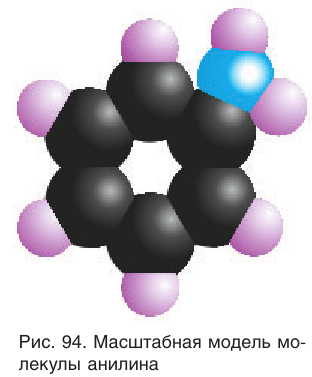
Масштабная модель молекулы анилина приведена на рисунке 94.
Анилин — бесцветная маслянистая жидкость со своеобразным запахом, малорастворимая в воде, но хорошо растворимая в этаноле и бензоле. Анилин — ядовитое вещество, поэтому опыты с ним так же, как с бензолом и фенолом, в школьном химическом кабинете не проводятся.
Химические свойства: Химические свойства ароматического амина анилина обусловлены строением его молекул. Рассмотрим кратко электронное строение молекулы анилина.
Неподеленная электронная пара атома азота функциональной аминогруппы вступает в сопряжение с  -электронной системой бензольного кольца, что приводит к перераспределению электронной плотности — увеличению ее на втором, четвертом и шестом атомах углерода и уменьшению на атоме азота. Эти процессы можно выразить схемой, показанной на рисунке 11. Перераспределение электронной плотности в молекуле анилина увеличивает реакционную способность соединения в реакциях замещения в бензольном кольце и уменьшает основность. Основность анилина ниже, чем алифатических аминов и аммиака. Его водный раствор не вызывает окраски фенолфталеина, т. е. практически не содержит гидроксидионов.
-электронной системой бензольного кольца, что приводит к перераспределению электронной плотности — увеличению ее на втором, четвертом и шестом атомах углерода и уменьшению на атоме азота. Эти процессы можно выразить схемой, показанной на рисунке 11. Перераспределение электронной плотности в молекуле анилина увеличивает реакционную способность соединения в реакциях замещения в бензольном кольце и уменьшает основность. Основность анилина ниже, чем алифатических аминов и аммиака. Его водный раствор не вызывает окраски фенолфталеина, т. е. практически не содержит гидроксидионов.
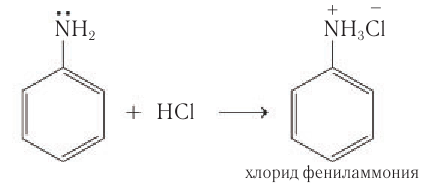
Основные свойства анилина проявляются в реакциях с сильными минеральными кислотами, в результате которых образуются соли фениламмония:
Анилин вступает в реакции замещения в бензольном кольце, которые протекают намного легче, чем у бензола. Так, при действии на раствор анилина бромной воды наблюдается обесцвечивание и образование белого осадка 2,4,6-триброманилина (рис. 95):
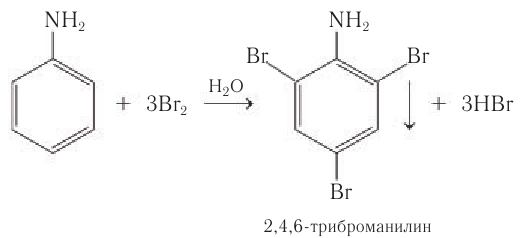
Реакцию бромирования используют для качественного обнаружения анилина.

При окислении анилина смесью хромата калия с серной кислотой образуются промежуточные продукты разных цветов — от зеленого до черного. Такие окислительные превращения лежат в основе производства анилиновых красителей.
Получение аминов: В лаборатории первичные амины получают восстановлением нитросоединений водородом в присутствии никелевого катализатора:
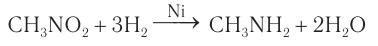
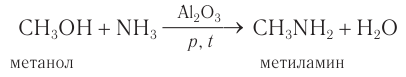
В промышленности метиламин и этиламин получают в реакции насыщенного одно-атомного спирта и аммиака под давлением над поверхностью катализатора:
Анилин в лаборатории получают восстановлением нитробензола действием металлического железа в присутствии соляной кислоты:
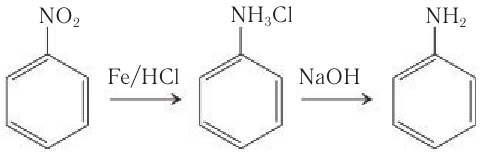
Образующуюся соль анилина разлагают щелочью.
В промышленности анилин получают гидрированием нитробензола под давлением:
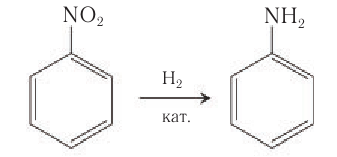

Впервые синтетический анилин был получен восстановлением нитробензола русским ученым Н. Н. Зининым в середине XIX в. Данная реакция известна как реакция Зинина. В качестве восстановителя Н. Н. Зинин использовал сульфид аммония. В настоящее время для получения анилина в лаборатории используют олово в солянокислой среде.
Анилин служит исходным веществом в синтезе разнообразных анилиновых красителей (рис. 96), лекарственных препаратов (например, парацетамола), пластмасс (например, анилиноформальдегида) и др.

Николай Николаевич Зинин
(1812—1880)
Российский химик-органик. Открыл реакцию восстановления нитробензола в анилин. Синтезировал много новых органических веществ — продуктов восстановления нитросоединений.
Амины — органические основания, они взаимодействуют с кислотами, образуя соли, аналогичные солям аммония.
Ароматический амин анилин — более слабое основание, чем алифатические насыщенные амины.
Химические свойства анилина обусловлены наличием в молекуле аминогруппы (взаимодействие с кислотами) и бензольного кольца (бромиро-вание).
Получают амины восстановлением нитросоединений. В промышленности метиламин и этиламин получают в реакции одноатомных насыщенных спиртов с аммиаком.
Аминокислоты
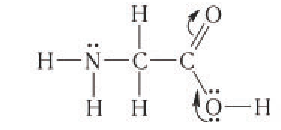
Строение: Аминокислоты — это органические соединения, в состав молекул которых входят карбоксильная группа —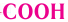 и аминогруппа —
и аминогруппа —
Аминокислоты могут рассматриваться как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Аминокислоты, в молекулах которых аминогруппа — и карбоксильная группа —СООН связаны с одним и тем же атомом углерода, относятся к так называемым
и карбоксильная группа —СООН связаны с одним и тем же атомом углерода, относятся к так называемым 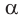 -аминокислотам. Такие аминокислоты в виде аминокислотных остатков входят в состав природных белков. Общая формула
-аминокислотам. Такие аминокислоты в виде аминокислотных остатков входят в состав природных белков. Общая формула 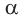 -аминокислот:
-аминокислот:
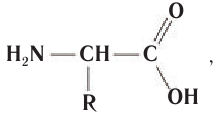
где R — атом водорода или группа атомов.
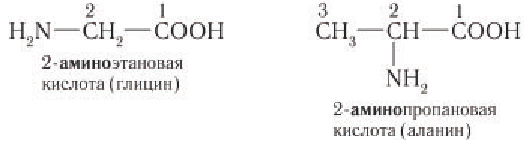
Простейшим представителем  -аминокислот является аминоуксусная кислота
-аминокислот является аминоуксусная кислота 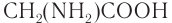 (или 2-аминоэтановая кислота, или глицин), структурная формула которой:
(или 2-аминоэтановая кислота, или глицин), структурная формула которой:
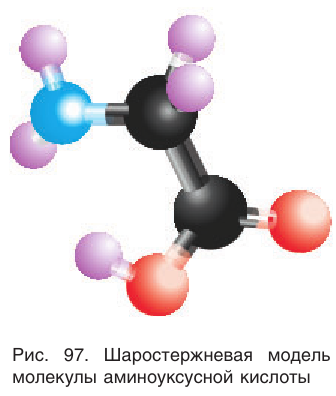
Шаростержневая модель молекулы аминоуксусной кислоты приведена на рисунке 97.
Примеры некоторых природных аминокислот, входящих в состав белков в виде аминокислотных остатков, и их тривиальные названия представлены в таблице 35. В таблице (в ознакомительном плане) приведены условные трехбуквенные обозначения, образованные от английских названий аминокислот. Такие обозначения принято использовать в биологии и биохимии при изучении состава и строения белков.
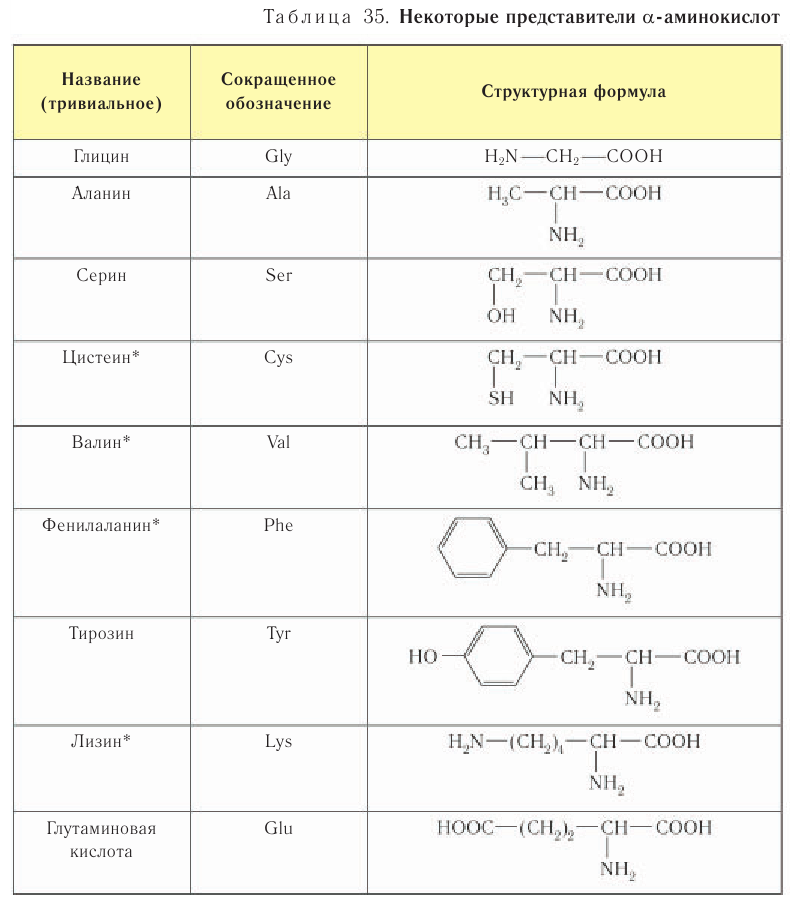
Организм человека не способен синтезировать десять из двадцати аминокислот, остатки которых входят в состав собственных белков. Эти кислоты называются незаменимыми. Они должны поступать в организм вместе с пищей. Знаком * в таблице 35 отмечены четыре из десяти незаменимых для человека аминокислот.
Обращаем ваше внимание на то, что формулы аминокислот даны в ознакомительном плане и не требуют запоминания.
 -Аминокиелоты классифицируют в зависимости от свойств боковой группы — заместителя R (см. общую формулу
-Аминокиелоты классифицируют в зависимости от свойств боковой группы — заместителя R (см. общую формулу  -аминокислот). Этот заместитель может иметь нейтральную, основную или кислотную природу.
-аминокислот). Этот заместитель может иметь нейтральную, основную или кислотную природу.
Аминокислоты с неполярными заместителями R (нейтральная природа заместителя):

Аминокислоты с кислотными боковыми группами R:
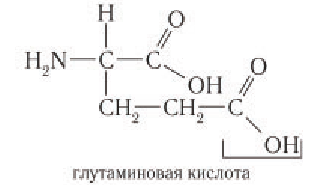
Аминокислоты с основными боковыми группами R:
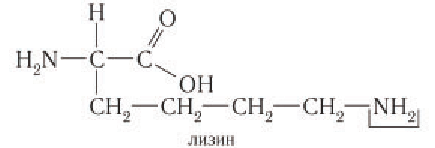
Номенклатура и изомерия: По систематической номенклатуре ИЮПАК названия аминокислот производят от названий соответствующих карбоновых кислот с добавлением префикса амино-, а нумерация атомов углерода производится, начиная с атома углерода карбоксильной группы:
Взаимное расположение обеих функциональных групп в углеродной цепи обозначают обычно цифрами, а в некоторых случаях буквами греческого алфавита: 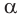 (альфа),
(альфа), 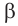 (бета),
(бета), 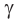 (гамма) и т. д. Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы:
(гамма) и т. д. Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы:
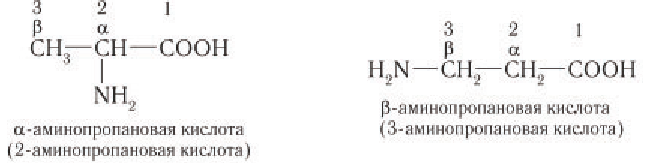
Структурная изомерия аминокислот обусловлена взаимным расположением аминогруппы и карбоксильной группы в открытой углеродной цепи и различным строением углеродного скелета. Например, 2-аминобутановая, 3-аминобутановая, 4-аминобутановая и 2-амино-2-метилпропановая кислота — изомеры аминокислот состава 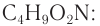
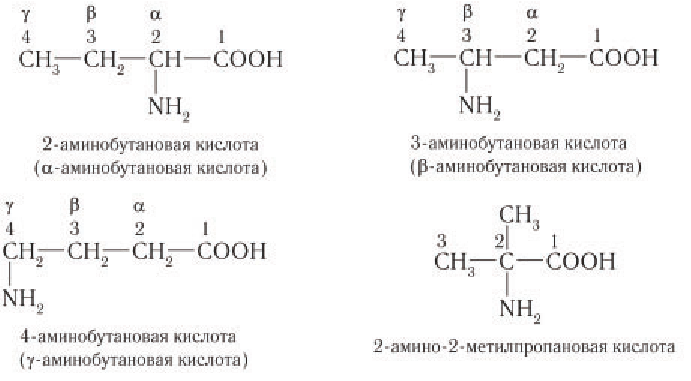
Физические свойства: Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических (неполярных) растворителях. Многие из них имеют сладкий вкус.
Аминокислоты хорошо кристаллизуются, имеют высокую плотность и высокие температуры плавления, например для серина температура плавления -253 °С, для лейцина — -337 °С.
Химические свойства 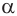 -аминокислот. Химические свойства
-аминокислот. Химические свойства 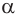 -аминокислот определяются функциональными группами противоположного характера: карбоксильной группой с кислотными свойствами и аминогруппой с основными свойствами. Аминокислоты реагируют как с основаниями, так и с кислотами, проявляя при этом амфотерные свойства.
-аминокислот определяются функциональными группами противоположного характера: карбоксильной группой с кислотными свойствами и аминогруппой с основными свойствами. Аминокислоты реагируют как с основаниями, так и с кислотами, проявляя при этом амфотерные свойства.
Рассмотрим химические свойства 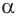 -аминокислот на примере глицина.
-аминокислот на примере глицина.
1) Реакция по карбоксильной группе. Как кислоты аминокислоты реагируют с основаниями с образованием солей:
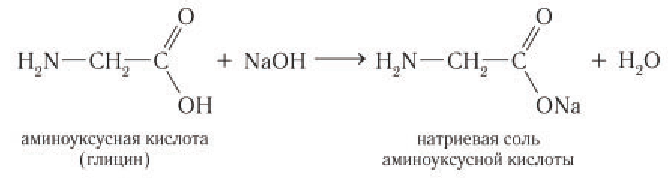
Для аминокислот, аминогруппа которых защищена солеобразованием, реакции по карбоксильной группе протекают аналогично превращениям карбоно-вых кислот. Аминокислоты легко образуют соли, сложные эфиры.
Реакция аминокислот со спиртами в присутствии сухого хлороводорода 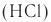 приводит к образованию сложных эфиров аминокислот в виде соли по аминогруппе:
приводит к образованию сложных эфиров аминокислот в виде соли по аминогруппе:
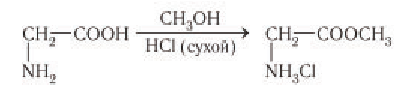
2) Реакции аминогруппы. Реакции аминогруппы аминокислот аналогичны превращениям аминов. Как амины аминокислоты взаимодействуют с сильными минеральными кислотами, присоединяя протон:
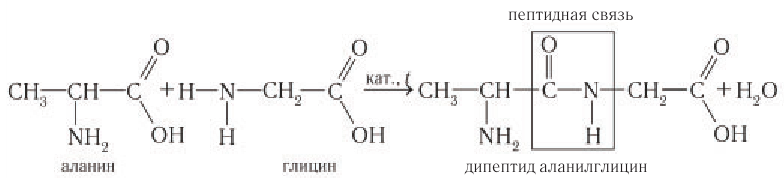
3) Специфические свойства. Важнейшее свойство аминокислот — их способность взаимодействовать друг с другом. При определенных условиях карбоксильная группа одной молекулы аминокислоты может реагировать с аминогруппой другой молекулы. При этом отщепляется молекула воды и образуется соединение, в котором остатки аминокислот связаны так называемой пептидной связью 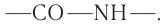 Продукт реакции называют дипептидом. Например:
Продукт реакции называют дипептидом. Например:
Группу атомов 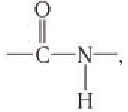 образующуюся при взаимодействии молекул аминокислот, называют пептидной или амидной.
образующуюся при взаимодействии молекул аминокислот, называют пептидной или амидной.
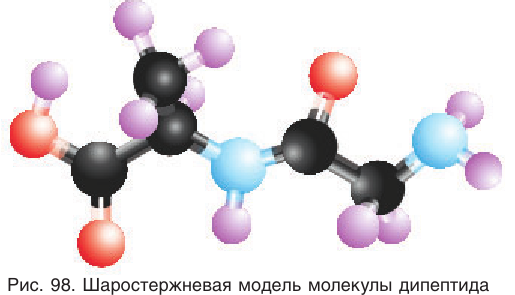
Шаростержневая модель молекулы дипептида аланилглицина приведена на рисунке 98.
Дипептид так же, как и аминокислота, содержит две функциональные группы — аминогруппу и карбоксильную группу и может реагировать еще с одной молекулой аминокислоты с образованием трипептида. В процессе дальнейшей реакции могут быть получены тетра-, пвнтапептиды и т.д., вплоть до образования полипептида. Природные полипептиды называют белками. Термин пептид предложен Э. Фишером. К пептидам относятся органические вещества, молекулы которых построены из остатков 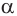 -аминокислот, соединенных в цепь пептидными связями
-аминокислот, соединенных в цепь пептидными связями 
Многие пептиды, состоящие даже из небольшого числа аминокислотных остатков, являются биологически активными веществами. Так, трипептид глутатион относится к группе гормонов, ответственных за детоксикацию чужеродных соединений в организме человека. В состав этого гормона входят остатки аланина, цистеина и глутаминовой кислоты. Гормон окситоцин — нонапептид, вызывающий сокращение гладких мышц, содержит остатки девяти аминокислот.
Получение и применение:
Синтетически 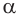 -аминокислоты можно получать различными способами. Общим лабораторным способом синтеза а-аминокислот является реакция аммиака с
-аминокислоты можно получать различными способами. Общим лабораторным способом синтеза а-аминокислот является реакция аммиака с 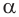 -галогензамещенными карбоновыми кислотами. При этом галоген замещается на аминогруппу:
-галогензамещенными карбоновыми кислотами. При этом галоген замещается на аминогруппу:
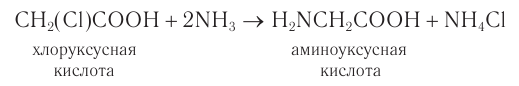
Ароматические аминокислоты получают при восстановлении нитропроизводных ароматических кислот по реакции Зинина:
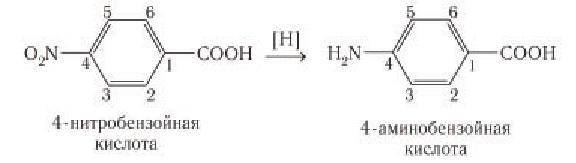
Природные 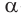 -аминокислоты (а точнее, их смесь) можно получить гидролизом белков.
-аминокислоты (а точнее, их смесь) можно получить гидролизом белков.
Аминокислоты, необходимые для построения белков организма, человек получает в составе белковой пищи. Некоторые аминокислоты используют как лекарственные средства в медицине, в пищевой промышленности, как пищевые добавки (например, натриевая соль глутаминовой кислоты со вкусом мяса и др.). Применяют аминокислоты в фармацевтической промышленности, в производстве красителей, пластмасс, синтетических волокон (капрон, найлон).
Аминокислоты — это органические амфотерные соединения, содержащие в составе молекул две различные функциональные группы: карбоксильную группу и аминогруппу. Они проявляют как кислотные, так и основные свойства.
Для аминокислот характерна структурная изомерия (изомерия углеродного скелета и изомерия, обусловленная взаимным расположением аминогруппы и карбоксильной группы в открытой углеродной цепи).
Аминокислоты способны взаимодействовать друг с другом с образованием пептидов.
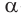 -Аминокислоты и их производные имеют важнейшее биологическое значение для жизнедеятельности человека.
-Аминокислоты и их производные имеют важнейшее биологическое значение для жизнедеятельности человека.
Полиамидные волокна и капрон
Как вам известно, некоторые высокомолекулярные соединения могут использоваться для получения химических волокон — искусственных и синтетических (см. рис. 77).
Искусственные волокна, например ацетатные, получают на основе природных высокомолекулярных соединений, главным образом целлюлозы. Синтетические волокна производят из синтетических высокомолекулярных соединений. Среди них наибольшее распространение получили материалы на основе известных вам полиэфиров (лавсан) и полиамидов. К полиамидным волокнам относятся капрон и найлон.
Для получения высокомолекулярных полиамидных соединений используют аминокислоты неразветвленного строения с функциональными группами на концах молекул.
Капрон:
Полимер, из которого можно получить волокно капрон, образуется в реакции поликонденсации 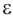 -аминокапроновой (6-аминогексановой) кислоты с выделением воды и образованием соединения, в котором остатки аминокислот связаны амидной связью
-аминокапроновой (6-аминогексановой) кислоты с выделением воды и образованием соединения, в котором остатки аминокислот связаны амидной связью 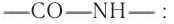
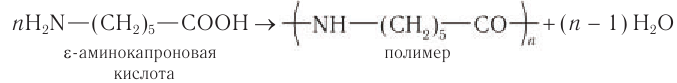
Полимер капрон в промышленности получают в результате полимеризации циклического амида — лактама, называемого капролактамом, который получают при нагревании  -аминокапроновой кислоты:
-аминокапроновой кислоты:
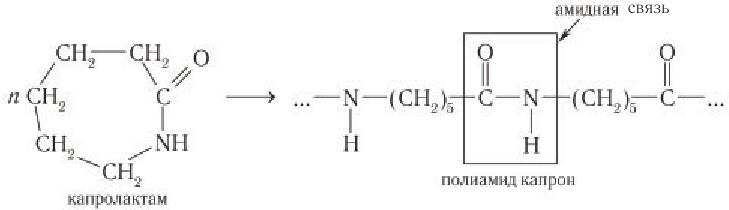
Макромолекулы капрона содержат большое число остатков  -аминокап-роновой кислоты, связанных амидными группами
-аминокап-роновой кислоты, связанных амидными группами 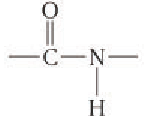 (в белках такую группу принято называть пептидной), поэтому капрон относят к полиамидам.
(в белках такую группу принято называть пептидной), поэтому капрон относят к полиамидам.
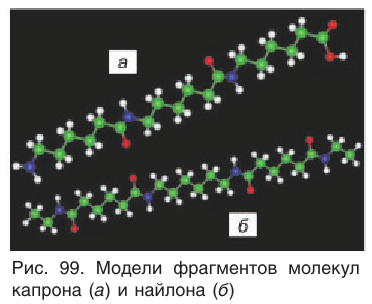
Макромолекулы капрона имеют линейную структуру. На рисунке 99, а приведена модель фрагмента макромолекулы капрона.
Полимер представляет собой смолу, из расплава которой формуют волокна так же, как и полиэфирное волокно лавсан. Капроновые волокна вытягивают, после чего они становятся высокопрочными. Прочность волокон объясняется образованием межмолекулярных водородных связей.
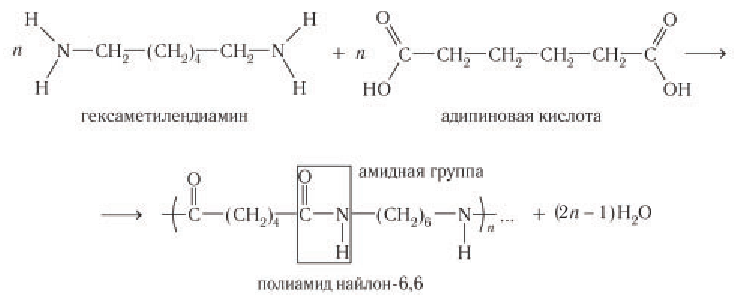
К полиамидным волокнам относится найлон-6,6 (рис. 99,6), который получают поликонденсацией гексаметилендиамина и адипиновой кислоты:
Свойства волокна капрон и применение: Капроновые волокна отличаются высокой прочностью, устойчивостью к истиранию, не впитывают влагу. Поэтому они применяются для получения различных видов ткани, из которых изготавливают одежду, искусственный мех, ковровые изделия, кордную ткань. Из капроновой смолы получают пластмассы для изготовления различных деталей машин и других предметов.
К полиамидным волокнам относится также кевлар, образующийся из дихлорангидрида терефталевой кислоты и n-фенилендиамина:
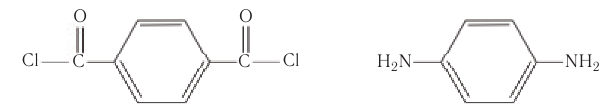
Кевлар находит применение при изготовлении пуленепробиваемых жилетов, сверхлегких летательных аппаратов и т.д. Прочность кевлара в 5 раз выше прочности стали и в 10 раз выше прочности алюминия (на одну массу).
Волокно канрон относится к синтетическим полиамидным волокнам.
В структуре макромолекул полиамидных полимеров содержатся амидные связи 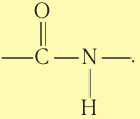
Капроновые волокна отличаются высокой прочностью и используются для производства разнообразных тканей и изделий.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |